
Читайте также:
|
1. Экспериментальное определение тепловых эффектов химических реакций проводят в специальных устройствах – калориметрах. Калориметр представляет собой сосуд, снабженный теплоизолирующей рубашкой для уменьшения теплообмена с окружающей средой. Простейший калориметр (рис. 6.) состоит из двух стаканов: наружного (1) и внутреннего (2) – собственно калориметра, установленного на теплоизолирующей подставке и снабженного крышкой (3) с отверстиями для термометра (4), воронки (5) и мешалки (6). Чтобы свести потери тепла к минимуму, внутренний стакан не должен касаться стенок внешнего.
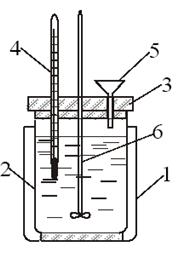
Рис. 6. Схема простейшего калориметра: 1 – наружный стакан; 2 – внутренний стакан; 3 – крышка; 4 – термометр; 5 – воронка; 6 – мешалка
2. Определите и запишите массу внутреннего стакана калориметра 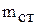 .
.
3. Получите у лаборанта 1 н. растворы соляной кислоты и гидроксида натрия, выдержанные при комнатной температуре. Запишите показания термометра  с точностью до 0,2 °С.
с точностью до 0,2 °С.
3. Отмерьте мерным цилиндром 50 мл раствора соляной кислоты и налейте ее во внутренний стакан калориметра.
4. С помощью другого мерного цилиндра отмерьте 50 мл раствора гидроксида натрия и влейте его через воронку в кислоту. При постоянном перемешивании раствора мешалкой наблюдайте изменение температуры и записывайте её значения в табл. 4.
Таблица 4
| Время, мин | ||||||
 °,С °,С
|
5. Определите скачок температуры  .
.
Расчет
1. Вычислите количество теплоты, выделившееся в калориметре.
Тепловой эффект химической реакции может быть рассчитан по формуле:
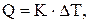
где  – теплоемкость калориметра;
– теплоемкость калориметра;
ΔТ – изменение температуры в ходе реакции.
По физическому смыслу теплоемкость калориметра – это количество теплоты, необходимое для нагревания калориметра с его содержимым на один градус. Теплоемкость калориметра складывается из теплоемкости раствора, который находится во внутреннем стакане 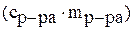 , и теплоемкости самого стакана
, и теплоемкости самого стакана 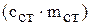 . Таким образом, тепловой эффект химической реакции может быть рассчитан по формуле:
. Таким образом, тепловой эффект химической реакции может быть рассчитан по формуле:

где  – удельная теплоемкость раствора;
– удельная теплоемкость раствора;
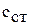 – удельная теплоемкость стекла, из которого изготовлен химический стакан;
– удельная теплоемкость стекла, из которого изготовлен химический стакан;
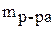 – масса раствора;
– масса раствора;
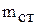 – масса стакана;
– масса стакана;
 – скачок температуры.
– скачок температуры.
Поскольку концентрация раствора мала, удельная теплоемкость раствора принимается равной теплоемкости воды, то есть 4,18 Дж/г. Удельная теплоемкость стекла, из которого изготовлен химический стакан, равна 0,78 Дж/г.
2. Вычислите количество вещества соляной кислоты или гидроксида натрия, взятых для опыта.
3. Вычислите тепловой эффект и энтальпию реакции нейтрализации сильной кислоты сильным основанием в кДж/моль.
4. Рассчитайте теоретическую величину энтальпии реакции нейтрализации.
5. Сравните полученное значение энтальпии нейтрализации с теоретическим и вычислите относительную ошибку опыта (в %).
Опыт №2. Определение энтальпии реакции гидратации сульфата меди (II)
1. Определите и запишите массу внутреннего стакана калориметра 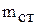 .
.
2. Во внутренний стакан калориметра налейте 200 мл дистиллированной воды и запишите показания термометра  с точностью до 0,2 °С.
с точностью до 0,2 °С.
3. Взвесьте на электронных весах с точностью до 0,01 г навеску безводного сульфата меди (II) массой 7 – 8 г.
4. Быстро и аккуратно внесите навеску во внутренний стакан калориметра через воронку.
5. При постоянном перемешивании раствора мешалкой наблюдайте изменение температуры и записывайте её значения в табл. 5.
Таблица 5
| Время, мин | ||||||
| Т °,С |
6. Определите скачок температуры DТ.
7. Взвесьте на электронных весах с точностью до 0,01 г навеску кристаллогидрата 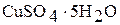 массой 9 – 10 г. Повторите опыт с навеской кристаллогидрата (пункты 1 – 6).
массой 9 – 10 г. Повторите опыт с навеской кристаллогидрата (пункты 1 – 6).
Расчет
Процесс растворения сульфата меди (II) в воде можно разбить на две стадии:
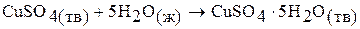
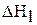 ;
;
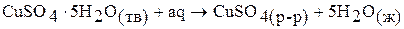
Первая стадия – процесс гидратации, то есть получение кристаллогидрата сульфата меди (II), вторая стадия – растворение кристаллогидрата в воде. Суммарная энтальпия реакций 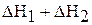 равна энтальпии процесса растворения безводной соли
равна энтальпии процесса растворения безводной соли 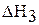 согласно закону Гесса:
согласно закону Гесса:
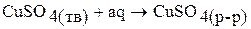
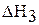 .
.
Измерив энтальпии процессов растворения кристаллогидрата  и безводной соли
и безводной соли 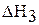 , можно вычислить энтальпию реакции гидратации безводного сульфата меди (II)
, можно вычислить энтальпию реакции гидратации безводного сульфата меди (II) 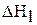 :
:
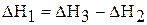 .
.
1. Рассчитайте количество теплоты, выделившееся в калориметре при растворении навески безводной соли сульфата меди (II), по формуле:
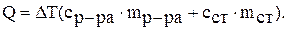
2. Рассчитайте энтальпию реакции растворения безводного сульфата меди (II) 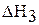 . Энтальпия реакции растворения (в кДж/моль) может быть рассчитана по формуле:
. Энтальпия реакции растворения (в кДж/моль) может быть рассчитана по формуле:
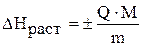 ,
,
где 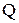 – теплота, выделившаяся (поглотившаяся) в калориметре, кДж;
– теплота, выделившаяся (поглотившаяся) в калориметре, кДж;
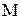 – молярная масса вещества, г/моль;
– молярная масса вещества, г/моль;
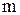 – масса навески соли, г.
– масса навески соли, г.
3. Рассчитайте количество теплоты, поглощенное в калориметре при растворении кристаллогидрата.
4. Рассчитайте энтальпию реакции растворения кристаллогидрата 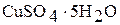
 (в кДж/моль).
(в кДж/моль).
5. Рассчитайте энтальпию гидратации безводного сульфата меди (II) 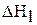 по формуле:
по формуле:
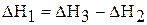 .
.
6. Сравните полученное значение энтальпии гидратации сульфата меди (II) с теоретическим и вычислите относительную ошибку опыта (в %).
Справочная величина энтальпии гидратации сульфата меди (II) равна – 78, 87 кДж/моль. В выводе укажите на возможные причины погрешности.
Дата добавления: 2015-07-25; просмотров: 314 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №5. Очистка углекислого газа | | | Опыт №3. Определение энтальпии реакции гидратации карбоната натрия |