
Читайте также:
|
Объем колбы, мл
Масса пустой колбы  , г
, г
Масса колбы с оксидом углерода (IV)  , г
, г
1-е взвешивание, г
2-е взвешивание, г
Давление по барометру  , мм рт.ст.
, мм рт.ст.
Температура  , ºС
, ºС
Расчет
1. Вычислите объем газа 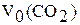 (мл) при нормальных условиях, используя уравнение объединенного газового закона Бойля-Мариотта и Гей-Люссака.
(мл) при нормальных условиях, используя уравнение объединенного газового закона Бойля-Мариотта и Гей-Люссака.
2. Вычислите массу воздуха  (г) в объеме колбы, учитывая, что при нормальных условиях масса одного литра воздуха равна 1,293 г.
(г) в объеме колбы, учитывая, что при нормальных условиях масса одного литра воздуха равна 1,293 г.
3. Вычислите массу  (г) пустой (без воздуха) колбы с пробкой:
(г) пустой (без воздуха) колбы с пробкой:
 .
.
4. Вычислите массу оксида углерода (IV) в объеме колбы:
 .
.
5. Определите относительную плотность оксида углерода (IV) по воздуху:
 .
.
6. Вычислите молярную массу оксида углерода (IV) тремя способами:
а) по воздуху:  ;
;
б) по закону Авогадро:  ;
;
в) по уравнению Менделеева-Клапейрона:  .
.
7. Вычислите среднее значение молярной массы оксида углерода (IV) c точностью до одного знака после запятой.
8. Определите относительную погрешность опыта, сравнивая среднее опытное значение молярной массы оксида углерода (IV) с теоретической величиной:
 .
.
Контрольные вопросы
1. Перечислите основные способы определения молекулярных масс газообразных веществ.
2. Какой закон лежит в основе известных способов определения молекулярных масс? Сформулируйте его.
3. Что называется а) относительной плотностью газа; б) плотностью газа по водороду; в) плотностью газа по воздуху?
4. Как можно вычислить молекулярную массу газа, если известна его плотность относительно другого газа? Приведите примеры.
5. Опишите установку для получения и очистки оксида углерода (IV).
6. Какая химическая реакция протекает в аппарате Киппа? Напишите уравнение реакции получения оксида углерода (IV) в аппарате Киппа.
7. В аппарате Киппа для получения оксида углерода (IV) из мрамора используется соляная кислота. Почему нельзя использовать более дешевую серную кислоту?
8. С какой целью, определяя молекулярную массу оксида углерода (IV), газ пропускают через склянки Дрекселя с водой и серной кислотой?
9. Почему нужно высушивать оксид углерода (IV)?
10. Как проверить полноту заполнения колбы оксидом углерода (IV)?
11. Почему объем газов при расчете масс газов и их молекулярных масс необходимо приводить к нормальным условиям? Какие условия называются нормальными?
Задачи
1. При температуре 17 °С и давлении 104 кПа масса 624 мл газа равна 1,56 г. Вычислите молекулярную массу газа.
2. Газообразное соединение азота с водородом содержит 12,5% водорода. Плотность соединения по водороду равна 16. Определите молекулярную формулу соединения.
3. Соединение содержит 40,3% бора, 7,5% водорода и 52,2% азота. 2,3 л этого соединения при температуре 60 °С и давлении 101,3 кПа имеют массу 6,78 г. Определите молекулярную формулу соединения.
4. Масса 0,001 м3 некоторого газа при нормальных условиях равна 0,00152 кг, а масса 0,001 м3 азота составляет 0,00125 кг. Вычислите молекулярную массу газа, исходя а) из его плотности относительно азота; б) из молярного объема.
5. Масса оксида углерода (IV), заполнившего колбу при 19 °С и давлении 102107,8 Па равна 0,38 × 10–3 кг. Масса колбы с воздухом при тех же условиях равна 32,48 × 10–3 кг, а с водой – 235,70 × 10–3 кг. Масса 10–6 м3 воздуха при нормальных условиях равна 129 × 10–8 кг. Вычислите молекулярную массу газа. Рассчитайте абсолютную и относительную ошибки в определении молекулярной массы газа (по сравнению с теоретической величиной).
РАБОТА №7. СПОСОБЫ ОЧИСТКИ ВЕЩЕСТВ ОТ ПРИМЕСЕЙ
Цель работы: ознакомиться со способами очистки веществ от примесей: перекристаллизацией, перегонкой, высаливанием, возгонкой.
Приборы и химическая посуда: электронные весы, электрическая плитка, спиртовая горелка, сухое горючее, термометр, набор ареометров, установка для перегонки жидкостей (штатив с кольцом и лапкой, штатив с лапкой для холодильника, колба Вюрца, коническая колба емкостью 100 мл, аллонж), установка для очистки хлорида натрия высаливанием (колба Вюрца, капельная воронка, резиновая трубка, стеклянная воронка), аппарат Киппа, заряженный для получения оксида углерода (IV), кварцевые чашки для взвешивания, шпатели, мерные цилиндры, химические стаканы, кристаллизатор, колба Бунзена, колба Кляйзена, круглодонная колба, склянки Дрекселя, воронка, чашка Петри, бюкс, часовое стекло, стеклянная палочка, стеклянные капилляры, пипетки, хлоркальциевая трубка, фильтры, фарфоровая ступка с пестиком, воронка Бюхнера, насос Комовского, водоструйный насос.
Реактивы: дихромат калия, сульфат меди (II) (безводный), хлорид натрия, йод, йодид калия.
Растворы: азотнаякислота (2 н.),соляная кислота(конц., 20%), серная кислота (70%), нитрат серебра (0,1 н.), хлорид бария (2 н.), лакмус.
Дата добавления: 2015-07-25; просмотров: 315 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Экспериментальная часть работы | | | Опыт №1. Очистка растворимых солей методом перекристаллизации |