
Читайте также:
|
В данной работе изучается скорость реакции разложения пероксида водорода, которую в первом приближении можно рассматривать как реакцию первого порядка. В обычных условиях скорость разложения пероксида водорода мала, поэтому проводить реакцию следует в присутствии катализатора – оксида марганца (IV).
1. Изучение скорости разложения пероксида водорода проводят в приборе, изображенном на рис. 7. Прибор состоит из воронки (1), реакционной пробирки Оствальда (2) и бюретки (3), закреплённых на штативе. Бюретка и пробирка герметично закрыты пробками и соединены между собой стеклянной газоотводной трубкой. Нижний конец бюретки соединен с воронкой резиновой трубкой.

Рис. 7. Прибор для изучения скорости разложения пероксида водорода: 1 – воронка; 2 – реакционная пробирка Оствальда; 3 – бюретка
2. Перед проведением опыта обязательно проверьте прибор на герметичность. Для этого поднимите воронку над кольцом, служащим креплением ее к бюретке, и наблюдайте изменение уровня воды в бюретке. Если при поднятии воронки уровень воды в бюретке в первый момент немного повысится, но затем останется постоянным, прибор герметичен. Если уровень воды в бюретке непрерывно повышается, то прибор не герметичен. В случае нарушения герметичности прибора обратитесь к преподавателю.
3. Отсоедините реакционную пробирку Оствальда и отметьте уровень воды по делениям бюретки с точностью до 0,1 мл.
4. Отмерьте цилиндром 4 мл 3%-ного раствора пероксида водорода и перелейте в одно из колен реакционной пробирки Оствальда.
5. Возьмите стеклянную палочку диаметром 0,5 – 0,6 см и длиной примерно 2 см. Опустите кончик палочки в раствор клея БФ-6. Дайте стечь его избытку и прикоснитесь к поверхности тонко измельченного порошка оксида марганца (IV) таким образом, чтобы конец стеклянной палочки покрылся тонким слоем катализатора.
6. Поместите стеклянную палочку в свободное колено пробирки Оствальда.
7. Плотно закройте пробирку пробкой, присоединив ее к прибору, снова проверьте прибор на герметичность. Отметьте уровень воды по делениям в бюретке с точностью до 0,1 мл ( ).
).
8. Наклоните реакционную пробирку таким образом, чтобы раствор пероксида водорода перелился в колено пробирки Оствальда, в котором находится катализатор, и одновременно включите секундомер. Наблюдайте выделение кислорода и вытеснение воды из бюретки.
9. Измерение объема кислорода, выделяющегося в процессе реакции разложения пероксида водорода, проводите через 2 минуты каждые 30 с в течение 7 – 8 минут эксперимента. Во время измерений воду в бюретке и воронке приведите к одинаковому уровню. Результаты измерений занесите в табл. 7.
Таблица 7
| Время t, с | Уровень воды в бюретке, мл | Объем выделившегося кислорода, 
| 
| 
|
| … | … | … | … | |

| – | – |
9. Для определения объема кислорода  , выделяющегося при практически полном разложении пероксида водорода, поместите колено реакционной пробирки Оствальда с реакционной смесью в стакан с горячей водой. Повышение температуры повысит скорость реакции разложения пероксида водорода.
, выделяющегося при практически полном разложении пероксида водорода, поместите колено реакционной пробирки Оствальда с реакционной смесью в стакан с горячей водой. Повышение температуры повысит скорость реакции разложения пероксида водорода.
10. После окончания реакции уберите стакан с горячей водой, дождитесь охлаждения реакционной пробирки Оствальда до комнатной температуры. Воду в бюретке и воронке приведите к одинаковому уровню. После этого отметьте уровень воды по делениям в бюретке с точностью до 0,1 мл и занесите значение  в табл. 7.
в табл. 7.
Расчет
1. Напишите уравнение химической реакции разложения пероксида водорода.
2. На основании данных табл. 7 рассчитайте значения константы скорости реакции разложения пероксида водорода по формуле:

или перейдя к десятичным логарифмам: 
Сохранятся ли постоянным значение константы скорости в опыте? Вычислите среднее значение константы скорости  реакции разложения пероксида водорода.
реакции разложения пероксида водорода.
3. Рассчитайте время полураспада для реакции разложения пероксида водорода по формуле:
 .
.
4. На основании экспериментальных данных табл. 7 постройте график зависимости  Используя график, определите период полураспада пероксида водорода и рассчитайте значение константы скорости реакции. Сравните полученное значение со средним значением константы скорости реакции разложения пероксида водорода
Используя график, определите период полураспада пероксида водорода и рассчитайте значение константы скорости реакции. Сравните полученное значение со средним значением константы скорости реакции разложения пероксида водорода  .
.
5. На основании экспериментальных данных табл. 7 постройте график зависимости  . Из графика по тангенсу угла наклона прямой определите значение константы скорости реакции. Сравните полученное значение со средним значение константы скорости реакции разложения пероксида водорода
. Из графика по тангенсу угла наклона прямой определите значение константы скорости реакции. Сравните полученное значение со средним значение константы скорости реакции разложения пероксида водорода  .
.
6. Рассчитайте период полураспада пероксида водорода по формуле:

и сравните его значение с 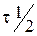 , полученным из графика.
, полученным из графика.
Дата добавления: 2015-07-25; просмотров: 474 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №3. Определение энтальпии реакции гидратации карбоната натрия | | | Опыт №2. Зависимость скорости реакции от концентрации реагирующих веществ. Определение порядка реакции разложения тиосерной кислоты |