
Читайте также:
|
В пробирке к 2 – 3 мл раствора нитрата серебра прибавьте такой же объем раствора хлорида натрия. Что наблюдаете? Напишите молекулярное и ионно-молекулярное уравнения химической реакции.
В эту же пробирку добавьте 1 – 2 мл раствора сульфида натрия. Почему изменился цвет осадка? Напишите молекулярное и ионно-молекулярное уравнения соответствующей химической реакции. Объясните, в каком направлении смещается химическое равновесие.
Контрольные вопросы
1. Какие вещества называются электролитами? В чем отличие между сильными и слабыми электролитами? Укажите, какие из перечисленных веществ являются неэлектролитами, слабыми электролитами, сильными электролитами: уксусная кислота, этанол, ацетат натрия, аммиак, хлорид аммония, хлороводород, глицин, глицерин, глюкоза, хлорид серебра, хлорид бария, гидроксид бария, гидроксид магния, азотная кислота.
2. В чем заключается сущность теории электролитической диссоциации Аррениуса?
3. Что называется степенью диссоциации? От каких факторов она зависит?
4. Что называется константой диссоциации? От каких факторов зависит константа диссоциации?
5. Какая существует взаимосвязь между степенью диссоциации и константой диссоциации? Приведите математическое выражение закона разбавления Оствальда.
6. Что называется произведением растворимости? Приведите примеры. От каких факторов зависит данная величина?
7. Дайте определение реакциям обмена между растворами электролитов. Как выражают сущность протекающих процессов в реакциях обмена? Приведите примеры.
8. Какие реакции обмена в растворах электролитов относятся к обратимым и необратимым реакциям?
Задачи
1. Закончите уравнения химических реакций:
а)  ;
;
б) 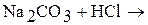 ;
;
в)  ;
;
г)  ;
;
д) 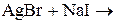 .
.
Напишите молекулярные и ионно-молекулярные уравнения химических реакций. Определите, обратимы или необратимы данные реакции. Для обратимых реакций укажите, в какую сторону смещено химическое равновесие.
2. Составьте по три молекулярных уравнения химических реакций к каждому их ионно-молекулярному уравнению:
а) 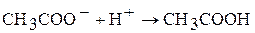 ;
;
б)  ;
;
в) 
3. Произведение растворимости йодида свинца при 20 °С равно 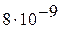 . Вычислите растворимость соли при указанной температуре.
. Вычислите растворимость соли при указанной температуре.
4. Объясните и подтвердите расчетом, почему сульфид цинка взаимодействует с соляной кислотой, а сульфид кадмия не взаимодействует. Напишите молекулярное и ионно-молекулярное уравнения реакций взаимодействия сульфида цинка с соляной кислотой.
5. Произведение растворимости сульфида магния при 25 °С равно  . Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,006 н. раствора сульфида натрия?
. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,006 н. раствора сульфида натрия?
РАБОТА №14. ГИДРОЛИЗ СОЛЕЙ
Цель работы: изучить процесс гидролиза солей и установить факторы, влияющих на гидролиз.
Приборы и химическая посуда: рН-метр, штатив с пробирками, держатель для пробирок, химические стаканы на 50 мл, спиртовая горелка, шпатели, стеклянные палочки.
Реактивы: хлорид калия, нитрат натрия, сульфат алюминия, ацетат натрия, карбонат натрия, нитрат свинца (II), магний (порошок).
Растворы: соляная кислота (2 н., конц.,  г/мл), гидроксид натрия (2 н.), хлорид железа (III) (2 н.), сульфит натрия (1 М), карбонат натрия (1 М), хлорид магния (1 М), хлорид алюминия (1 М), хлорид сурьмы (III) (0,5 н.), ацетат натрия (1 М), хлорид алюминия (2 н.), карбонат натрия (2 н.), лакмус, фенолфталеин, универсальный индикатор.
г/мл), гидроксид натрия (2 н.), хлорид железа (III) (2 н.), сульфит натрия (1 М), карбонат натрия (1 М), хлорид магния (1 М), хлорид алюминия (1 М), хлорид сурьмы (III) (0,5 н.), ацетат натрия (1 М), хлорид алюминия (2 н.), карбонат натрия (2 н.), лакмус, фенолфталеин, универсальный индикатор.
Дата добавления: 2015-07-25; просмотров: 304 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт № 5. Приготовление раствора заданной молярной концентрации эквивалентов. Проверка концентрации приготовленного раствора методом титрования | | | Опыт №1. Определение реакции среды растворов солей при гидролизе |