
Читайте также:
|
Приготовьте 100 мл раствора гидроксида натрия молярной концентрации 0,1 моль/л. Проверьте концентрацию приготовленного раствора методом титрования.
1. Рассчитайте массу гидроксида натрия, необходимую для приготовления раствора заданной концентрации.
2. Взвесьте в бюксе на электронных весах с точностью до 0,01 г рассчитанную массу гидроксида натрия.
3. В мерную колбу емкостью 100 мл налейте дистиллированной воды на  часть от ее объема.
часть от ее объема.
4. Осторожно через воронку перенесите навеску в мерную колбу. Смойте в мерную колбу дистиллированной водой остатки вещества в бюксе и в воронке.
5. При непрерывном перемешивании растворите все кристаллы гидроксида натрия в мерной колбе.
6. После растворения всего вещества и достижения комнатной температуры доведите объем раствора до кольцевой метки.
7. Колбу закройте пробкой и, переворачивая ее вверх дном, тщательно перемешайте раствор.
8. Проверьте молярную концентрацию приготовленногораствора гидроксида натрия методом титрования. Для этого в каждую из трех конических колб налейте по 10 мл исследуемого раствора щелочи, отобранного пипеткой из мерной колбы с помощью резиновой груши. Для этого опустите нижний конец пипетки в раствор, почти до дна мерной колбы. Когда пипетка наполнится раствором выше метки, верхнее отверстие её быстро закройте указательным пальцем и осторожно, ослабляя нажим пальца, спустите раствор, пока нижняя часть мениска не достигнет метки. В этот момент палец вновь плотно прижмите к верхнему отверстию пипетки. При выливании раствора в колбу оттянутым концом пипетки коснитесь внутренней стенки колбы и, открыв верхнее отверстие, дайте жидкости стечь.
9. В каждую коническую колбу прибавьте по 2 капли индикатора – фенолфталеина. Оттитруйте каждую из трех проб в отдельности 0,1 М раствором соляной кислоты.
Титрование раствора проводите следующим образом: под бюреткой на белый лист бумаги поставьте колбу. Правой рукой регулируйте скорость подачи соляной кислоты из бюретки, а левой рукой непрерывно перемешивайте раствор круговым движением колбы в горизонтальной плоскости. Проведите титрование раствором соляной кислоты до устойчивого обесцвечивания раствора щелочи.
Определите по делениям бюретки объём раствора соляной кислоты с точностью до 0,1 мл, который израсходован на титрование гидроксида натрия в каждой колбе.
10. Результаты титрования занесите в табл. 13.
Таблица 13
| Объем титруемого раствора NaOH, мл | Объем стандартного раствора HCl, 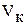 , мл , мл
| Молярная концентрация титруемого раствора NaOH, моль/л | |||
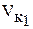
| 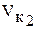
| 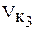
| 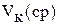
| ||
11. Напишите уравнение химической реакции кислотно-основного титрования.
12. Рассчитайте молярную концентрацию раствора гидроксида натрия и запишите результаты в табл. 13.
13. Рассчитайте относительную ошибку опыта по формуле:
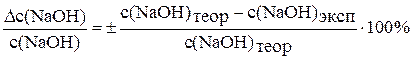 .
.
Дата добавления: 2015-07-25; просмотров: 226 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт проводится в вытяжном шкафу. | | | Опыт № 5. Приготовление раствора заданной молярной концентрации эквивалентов. Проверка концентрации приготовленного раствора методом титрования |