
Читайте также:
|
1. В шесть пробирок поместите небольшое количество кристаллических солей: хлорида калия, нитрата натрия, сульфата алюминия, ацетата натрия, карбоната натрия, нитрата свинца (II).
2. В каждую пробирку налейте по 1 – 2 мл дистиллированной воды, растворите соли и добавьте соответствующий индикатор. Результаты опыта занесите в табл. 16.
3. Напишите ионно-молекулярные и молекулярные уравнения гидролиза солей. В тех случаях, когда гидролиз протекает ступенчато, напишите уравнения гидролиза для каждой ступени.
Таблица 16
| Формула соли | Индикатор | Цвет индикатора в водном растворе соли | Реакция среды (нейтральная, кислая, щелочная) Значение рН в растворе | Тип гидролиза (не гидролизуется, по катиону, по аниону) |

| ||||
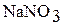
| ||||
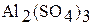
| ||||

| ||||
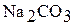
| ||||

|
4. Вычислите константу гидролиза по первой ступени для каждой соли. На основании полученных данных определите, какая из солей гидролизуется в наибольшей степени.
Дата добавления: 2015-07-25; просмотров: 120 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №8. Обратимая реакция обмена, идущая с образованием менее растворимого соединения, чем исходное | | | Образующих ее кислоты и основания |