
Читайте также:
|
ХІМІЧНІ ЗВ’ЯЗКИ
Характер хімічної взаємодії між атомами, а також природа хімічного зв’язку між ними у значній мірі залежать від будови електронних оболонок атомів. Згідно з квантово-механічною теорією, електрон має подвійну природу (дуалістичність): йому притаманні властивості як хвилі так матеріальної частинки.
Електрон рухається навколо ядра зі швидкістю, що наближається до швидкості світла, створюючи так звану електронну хмару. Тому визначити точне положення електрона відносно ядра неможливо. Можна лише визначити ймовірність його знаходження в тій чи іншій точці простору. Та частина простору, де ймовірність знаходження електрону становіть 90 % називається електронною орбіталлю або атомною орбіталлю (АО). Кожна орбіталь характеризується певними розмірами та формою, а кожен електрон — певним запасом енергії, причому, чим далі від ядра знаходиться електрон, тим більша його енергія.
Математично кожна АО описується хвильовою функцією Ψ (псi), яка у фiзичному розумiннi являє собою корінь квадратний вiд ймовiрностi знаходження електрона у певній точці простору з координатами X,Y,Z, (початок координат співпадає з ядром атома).
Електрони в багатоелектронних атомах розташовуються на так званих “ стаціонарних енергетичних рівнях ”, де вони можуть рухатися навколо ядра, як завгодно довго, не витрачаючи своєї енергії. В межах одного рівня електрони розподіляються по підрівнях. Підрівні також характеризуються різною енергією, але ця різниця є значно меншою, ніж різниця енергії між стаціонарними енергетичними рівнями.
Кожен електрон в атомі характеризується чотирма квантовими числами: n, ℓ, m, s (ен, ель, ем, ес).
n - головне квантове число, визначає енергетичний рiвень, на якому знаходиться даний електрон. Характеризує середню вiддаль електрона вiд ядра, а значить - розмiри електронної хмари. Крім того, n визначаєенергiю електрона в атомі. Чим бiльше n, тим бiльша енергія. Головне квантове число може приймати позитивні цiлочисельнi значення. Максимальне значення n відповідає номеру періода, в якому елемент стоїть в періодичній системі.
ℓ - орбітальне квантове число, показує підрівень, на якому знаходиться електрон, визначає форму електронної орбiталi.Орбітальне квантове число може набувати цiлочисельних значень в межах вiд 0 до (n-1). Хiмiки рiдко використовують числовi значення ℓ, а застосовують його умовні позначення (s, p, d, f).
| Значення головного квантового числа (n) | |||
| Значення орбітального квантового числа (ℓ) | 0, 1 | 0, 1, 2 | |
| Умовні позначення орбітального квантового числа | (s) | (s), (p) | (s), (p), (d) |
m -магнітне квантове число, яке показує орієнтацію електронних орбiталей у просторi i може приймати цiлочисельнi значення вiд – ℓ до +l, включаючи 0.
| Значення орбітального квантового числа (ℓ) | (s) | (p) | (d) |
| Значення магнітного квантового числа (m) | –1; 0; +1 | –2; –1; 0; +1; +2 |
s - спінове квантове число, яке характеризує спосiб обертання електрона довкола власної вісi та може приймати два значення: (+1/2) i (–1/2).
Числа n, ℓ, m разом взятi описують певну атомну орбiталь.
Не слiд орбiталям приписувати реальний фiзичний змiст, як геометричних контурiв, на поверхнi яких знаходяться електрони. У дiйсностi рух електронiв в атомі достатньо складний і описується за допомогою методів теорії ймовірностей рiвнянням Е.Шредiнгера. Точне розв`язання цього рiвняння можливе для простих систем, таких як атом та анiон гідрогену, або атом гелію. Для складніших атомів або молекул розв`язати рiвняння Шредiнгера поки що неможливо.
Згідно з “Принципом заборони” Паулі кожен електрон в атомі характери-зується своїм певним значенням чотирьох квантових чисел i в атомi не може бутихоча б двох електронiв, якi б мали однаковi їх значення. Звiдси витiкає, що на однiй орбiталi може знаходитись не бiльше ніж два електрони, спiни яких протилежнi, а кiлькiсть орбiталей на рiвнi залежить вiд можливих значень ℓ та m (табл. 1.3).
Таблиця 1.3.
Розподіл електронiв по атомних орбiталях
| Значення квантових чисел | Максимальне число електронів | ||||
| n(енергетичний рівень) | ℓ (енергетичний підрівень) | m | s | на підрівні | на рівні |
| 0 (s) | +1/2,-1/2 | ||||
| 0 (s) | +1/2,-1/2 | ||||
| 1 (p) | -1 +1 | +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 | |||
| 0 (s) | +1/2,-1/2 | ||||
| 1 (p) | -1 +1 | +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 | |||
| 2 (d) | -2 -1 +1 +2 | +1/2,-1/2 +1/2,-/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 |
Схематично атомну орбіталь позначають так:
або 
| | або 
| ¯ | або 
|
Порожня орбіталь Орбіталь з одним електроном Заповнена орбіталь
На кожному енергетичному рівні існує одна s-орбіталь ((ℓ =0), що має форму сфери, центр якої співпадає з ядром атома.

На другому, третьому i вищих рiвнях iснують три p -орбiталi (ℓ =1), якi мають форму об’ємної вісімки і розташованi у просторi взаємно перпендикулярно, вздовж трьох координатних осей.
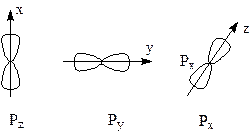
На третьому та бiльш високих рiвнях з`являється п’ять d-орбiталей, форма яких ще складніша.
Отже, на першому рівні може розташуватись на більше, як 2 електрони, на другому - 8, на третьому - 18.
Забудова електронами енергетичних підрівнів відбувається у порядку зростання їх енергії (правило Клечковського). Послідовність забудови - наступна:
1s ® 2s ® 2p ® 3s ® 3p ® 4s ® 3d® 4р®...
В органiчнiй хiмiї розглядаються, в основному, 1s, 2s, 2p, 3s, і 3p - орбiталi.
У відповідності з правилом Гунда в межах одного підрівня електрони розподіляються так, щоб їх сумарний спін був максимальним, тобто на кожнiй орбiталi спочатку розташовується по одному електрону, причому їхні спіни будуть обов’язково паралельними
| | | |
2p
i тiльки пiсля того, як на всіх орбіталях підрівня буде по одному електрону, орбіталі починають доповнюватись другим електроном, спін якого протилежний.
Розподіл електронів по рівнях та підрівнях називається електронною конфігурацією атома і схематично зображається за допомогою електронних формул, наприклад:
| 6С 1s2 2s2 2p2 17Cl1s2 2s2 2p6 3s2 3p5 | 
|
Властивості атомів в значній мірі залежать від будови зовнішнього енергетичного рівня. Електрони цього рівня здатні приймати безпосередню участь в утворенні хімічних зв’язків і тому називаються валентними електронами.
Дата добавления: 2015-10-21; просмотров: 96 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Перестройка сознания | | | ПРИРОДА ХІМІЧНИХ ЗВ’ЯЗКІВ |