
|
Читайте также: |
Чому атоми утворюють один з одним хімічні зв’язки і яка природа цих зв’язків? Справа в тому, що стабільними є тільки ті енергетичні рівні, які повністю забудовані електронами (зовнішній енергетичний рівень буде стабільним, якщо у нього забудовані
s- та p- підрівні). Отже кожний атом намагається набути стабільної електронної конфігурації свого зовнішнього енергетичного рівня. Цього можна досягти трьома шляхами: 1) прийняти недостаючу кількість електронів на зовнішній рівень; 2) віддати всі електрони з зовнішнього рівня; 3) об’єднати електрони свого зовнішнього рівня з електронами іншого атома. При реалізації перших двох шляхів, між атомами утворюються йонні зв’язки, а при реалізації третього шляху - ковалентні.
Йонний зв’язок утворюється за рахунок сил електростатичного притягання між різнойменно зарядженими йонами. Ці йони утворюються, як правило, внаслідок переходу електронів від одного атома до іншого. Розглянемо утворення йоного зв’язку на прикладі взаємодії натрію з флуором. Атом натрію віддає флуору єдиний електрон 3s-підрівня, перетворюючись на катіон Na+ .
11Na - 1 e— ® 11Na+
1s2 1s2
2s2 2p6 2s2 2p6
3s1
Атом флуору, приймаючи цей електрон від атома натрію, перетворюється на аніон F¯, причому, як Na+, так і F¯ мають стабільну електронну конфігурацію своїх енергетичних рівнів.
F + 1 e — ® F —
1s2 1s2
2s2 2p5 2s2 2p6
Катіони натрію притягуються до аніонів флюору, утворюючи йонний зв`язок Na+ F —(йонний зв’язок).
Цей зв`язок, ненапрямлений, що означає неможливість виділити конкретну пару йонів, які взаємодіють між собою, оскільки кожен катіон притягається до всіх аніонів, які його оточують і навпаки. Крім того, цей зв`язок буде ненасиченим (не плутати з ненасичними кратними ковалентними зв’язками), тому що скільки б йонів протилежного знаку не оточили даний йон, він буде взаємодіяти зі всіма ними. Отже, у сполуках з йонним зв`язком, як правило, неможливо виділити конкретні два йони, між якими він утворився.
Ковалентний (неелектровалентний, гомеополярний) зв`язок виникає між двома конкретними атомами в результаті утворення спільної електронної пари, яка належить їм обом. Наприклад, зв`язок у молекулі водню утворюється внаслідок усуспільнення двох електронів, кожен з яких до утворення зв`язку належав окремому атому водню

Ковалентний зв`язок у гідрогенфлуориді (Н—F) також утворюється за рахунок одного електрона атома гідрогену та ще одного електрона атома флуору. В результаті утворення ковалентного зв`язку, зв’язок, що утворився при спарюванні двох електронів з антипаралельними спінами, які належали двом атомам, називається ковалентним зв’язком. Такий зв’язок є двоцентровим, тому що утворюється між двома конкретними атомами та двоелектронним.
В залежностi вiд типу орбiталей, якi перетинаються та способу їх перекриття, розрізняють s- та p- ковалентні зв`язки. Якщо обіталі перекриваються так, що місце їх перетинання знаходиться на відрізку прямої, що з’єднує ядра атомів, то такий зв’язок називається s -зв’язком, наприклад

s - (s-s) зв’язок s - (s-p) зв’язок s - (p-p) зв’язок
Такий спосіб перекриття орбіталей є найбільш вигідним, тому першим зв`язком, який утворюється між атомами, завжди буває саме s -зв”язок.
При боковому (латеральному) перекриванні атомних p - або d -орбіталей утворюється p -зв’язок:

Такий тип зв’язку є менш енергетично вигідний, ніж s -зв’язок, тому p -зв’язок утворюється лише після того, як між атомами вже утворився s -зв’язок. Отже, другий і третій ковалентні зв’язки між двома атомами бувають зв’язками p -типу.
Донорно-акцепторним (координаційним або дативним) називається ковалентний зв’язок, на утворення якого один атом (донор) надає пару електронів, а другий (акцептор) — вільну атомну орбіталь. Схема утворення донорно-акцепторного зв’язку між двома атомами водню виглядає так:
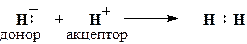
За своїми властивостями донорно-акцепторний зв’язок є звичайним ковалентним зв’язком. Його відмінність від розглянутих вище ковалентних зв’язків полягає лише у способі утворення.
Інші приклади сполук з донорно-акцепторним зв’язком:
1. Утворення йона амонію з аміаку

2. Утворення оксонієвих йонів

Основні характеристики хімічного зв’язку:
довжина — віддаль між ядрами атомів, що утворили зв’язок; вимірюється в нанометрах (1нм = 10-9м);
енергія — робота, яку треба виконати, щоб розірвати зв’язок; вимірються в кДж/моль;
полярність — визначається величиною зарядів на атомах, що утворили зв’язок. Якщо зв’язок утворився між атомами одного елементу, то спільна електронна пара буде в рівній мірі належати обом атомам; заряди на атомах не виникають і такий зв’язок буде неполярним. Якщо зв’язок утворився між атомами різних елементів, то спільна електронна пара буде належати одному атому в більшій мірі, ніж другому. Той атом, що буде сильніше притягати до себе спільну електронну пару набуде часткового негативного заряду (d-), а інший - часткового позитивного (d+). Здатність атому притягати до себе валентні електрони називається електронегативністю. В результаті такого перерозподілу електронної густини утвориться диполь, величина якого буде тим більшою, чим більшою буде різниця електронегативностей атомів. Такий зв’язок називається полярним ковалентним зв’язком. Отже полярність ковалентного зв’язку визначається різницею електронегативностей атомів, що його утворили. В таблиці 1.4 наведені значення електронегативності елементів, які доволі часто зустрічаються в органічних сполуках.
 напрямленість зв’язків у просторі - зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій. Валентні кути (кути між умовними лініями, вздовж яких утворені хімічні зв’язки) дорівнюють 180о .
напрямленість зв’язків у просторі - зумовлює просторову структуру молекули. Наприклад, молекула води має плоску форму з валентним кутом 104,5о. Молекула ацетилену має лінійну будову. Всі чотири атоми розташовані на одній прямій. Валентні кути (кути між умовними лініями, вздовж яких утворені хімічні зв’язки) дорівнюють 180о .
Таблиця 1.4.
Електронегативність деяких елементів (шкала Полінта)
| Елемент | Електронегативність |
| Гідроген (Н) Літій (Li) Бор (В) Карбон (С) Нітроген (N) Оксиген (О) Флуор (F) Сіліцій (Si) Фосфор (Р) Сульфур (S) Хлор (СІ) Вром (Br) Йод (І) | 2,1 1,0 2,0 2,5 3,0 3,5 4,0а 1,8 2,1 2,5 3,0 2,8 2,5 |
а Найвища електронегативність за шкалою Л. Полінга
У структурних формулах ковалентний зв’язок позначається однією рискою С-С. Подвійний зв’язок, тобто комбінація s - та p -зв'язків — подвійною рискою С = С. Потрійний зв’язок, (комбінація s - та двох p -зв'язків) — трьома рисками С º С.
Крім розглянутих типів зв’язків, в органічних сполуках зустрічаються водневі зв'язки.
Водневий зв'язок. При утворенні полярного ковалентного зв'язку між атомом водню та атомом а високою електронегативністю, електронна хмара атома водню сильно зміщується до цього атома. В результаті атом електронегативного елемента набуває значного ефективного негативного заряду, а ядро атома водню (протон) майже втрачає електронну хмару. Кажуть, що атом водню протонізується. Такий протонізований атом водню буде притягатись до будь-якого іншого атома, що має надлишок електронної густини. В результаті між ними виникає електростатична взаємодія, яка зумовлює утворення водневого зв'язку Ще однією складовою водневого зв'язку є донорно-акцепторна взаємодія, оскільки протонізований атом водню має вакантну орбіталь, а атом з надлишком електронної густини — неподілену електронну пару.
У графічних формулах водневий зв'язок позначається трьома крапками. Енергія водневого зв'язку становить 8—40 кДж/мольі за міцністю дещо перевищує енергію вандерваальсівської взаємодії, проте вона набагато менша за енергію ковалентного зв'язку. Водневий зв'язок більш характерний для речовин у рідкому і твердому станах. У газоподібному стані водневий зв'язок проявляється незначною мірою. Водневий зв'язок виявляється у неорганічних і органічних сполуках (спирти, кислоти, вуглеводи тощо).
Розрізняють міжмолекулярний і внутрішньо молекулярний водневий зв'язок.
У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у ланцюги за рахунок утворення міжмолекулярного водневогозв'язку:

Асоціація молекул спричинює аномально високі температури плавлення і кипіння фтороводню порівняно з водневими сполуками елементів головної підгрупи VII групи. Кожна молекула води може брати участь в утворенні двох водневих зв'язків; при цьому атом кисню зв'язується з чотирма атомами водню:

Результатом міжмолекулярного водневого зв'язку є асоціація молекул води з утворенням ажурної просторової структури, в якій кожний атом кисню розміщений у центрі тетраедра, вершини якого займають атоми водню. Це зумовлює аномально високі температури танення льоду і кипіння води, а також високі значення теплоємності і теплоти випаровування, хоча полярний зв'язок О—Н у воді має енергію 457 кДж/моль, а водневий зв'язок між молекулами води - лише 42 кДж/моль.
Взаємодія молекул, що зумовлена утворенням водневих зв'язків, не завжди приводить до утворення полімерних молекулярних агрегатів, як у молекул НF, Н2О тощо. Іноді при асоціації утворюються димерні молекули. Наприклад, мурашина кислота існує лише у вигляді димера, який зберігається навіть у газоподібному стані:

Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше внутрішньомолекулярний водневий зв'язок виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо. Наприклад, він виявляється у о-нітрофенолі.

Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворенні кристалогідратів, електролітичній дисоціації; в хімії полімерів, білків тощо.
Прояв природи хімічного зв’язку у властивостях органічних речовин
Сполуки з йонним зв’язком – як правило кристалічні речовини з високими toтопл. і toкип. Вони – сильні електроліти, добре розчиняються в полярних або йонних розчинниках. Для таких речовин характерні реакції, які супроводжуються гетеролітичним розривом хімічного зв’язку. До них відносяться солі, нітросполуки, деякі елементоорганічні речовини.
Сполуки з неполярним або малополярним ковалентним зв’язком, навпаки, характеризуються невисокими toтопл. і toкип. Це пов’язано зі значно слабшою міжмолекулярною взаємодією, ніж у сполук з йонним зв’язком. Такі речовини погано розчиняються в полярних розчинниках, але добре в неполярних. Для них характерні реакції з гомолітичним розривом хімічних зв’язків (наприклад вуглеводні).
Наявність водневих зв’язків також проявляється у властивостях молекул.
Більшість таких сполук так само добре розчиняються у воді, кислотах за рахунок утворення з її молекулами водневих зв’язків.
Наприклад: ацетон  не утворює міжмолекулярних водневих зв’язків, але в присутності води координується з її молекулами за рахунок водневого зв’язку:
не утворює міжмолекулярних водневих зв’язків, але в присутності води координується з її молекулами за рахунок водневого зв’язку:
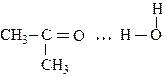
Речовини, що утворюють міжмолекулярні водневі зв’язки характеризуються високими температурами топлення і кипіння.
СН4 т.топл. = -182оС, Т кип. = -161оС (не утворює водневих зв’язків)
Н2О т.топл. = 0 оС, Т кип. = 100оС (не утворює водневих зв’язків)
Дата добавления: 2015-10-21; просмотров: 91 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ОСНОВНІ ВІДОМОСТІ ПРО БУДОВУ ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ | | | Ковалентні зв’язки атома карбону |