
|
Читайте также: |
В предыдущих главах мы рассмотрели свойства неметаллов и лишь нескольких элементов, относящихся к металлам. Прежде чем рассматривать остальные металлы по группам периодической системы, остановимся на их общих свойствах и методах получения из природных соединений.
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников. Металлы обладают рядом общих свойств. К общим физическим свойствам металлов относятся их высокая электрическая проводимость и теплопроводность, пластичность, т. е. способность подвергаться деформации при обычных и при повышенных температурах, не разрушаясь. Пластичность металлов имеет очень большое практическое значение. Благодаря этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку (волочению)", штамповке. Металлам присущи также металлический блеск, обусловленный их способностью хорошо отражать свет, и непрозрачность [121], В табл. 29 приведены значения удельного электрического сопротивления и теплопроводности некоторых металлов. Для сравнения в ней даны сведения для двух неметаллов.
Таблица 29. Удельное электрическое сопротивление р и коэффициент теплопроводности X некоторых простых веществ при 20 '"С
|
В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и, как следствие этого, способностью образовывать положительно заряженные ионы и проявлять в своих соединениях только положительную окисленность. Многие металлы, например железо, хром, марганец, имеют в различных соединениях разную степень окисленности, но она всегда положительна. В связи с этим металлы в свободном состоянии являются восстановителями. Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется положением металла в ряду напряжений и концентрацией (активностью) его ионов в растворе.
Причина общности как физических, так и химических свойств металлов лежит в общности строения их атомов и природы кристаллических решеток металлов.
Общей особенностью атомов металлов являются их большие в сравнении с атомами неметаллов размеры (см. § 33). Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо — атомы металлов характеризуются низкими потенциалами ионизации (см. § 34, табл. 4 и 5) и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей, и, как правило, не способны присоединять электроны — проявлять окислительные свойства.
Рассмотрим особенности строения металлов в кристаллическом состоянии. Как отмечалось, металлы обладают высокой электрической проводимостью, причем переносчиками тока в металлах служат электроны. Это говорит о.том, что в металлах имеются
Рис. 135. Схема ооразозания энергетических уровн.й при увеличении числа взаимодействующих атомов.
«свободные» электроны, способные перемещаться по кристаллу под действием даже слабых электрических ползи. В то же время неметаллы в кристаллическом состоянии обычно представляют собою изоляторы и, следовательно, не содержат свободных электронов. Причины этих различий можно объяснить на основе метода молекулярных орбиталей (метод МО).
В § 45 было показано, что при взаимодействии двух одинаковых атомов вместо двух энергетически равноценных исходных атомных орбиталей образуются две молекулярные орбитали, отвечающие различным уровням энергии (рис. 45). Если взаимодействуют три атома, причем их валентные орбитали заметно перекрываются, то возникают не две, а три молекулярные орбитали, в равной степени принадлежащие всем трем атомам (дел ока- л из о в а иные орбитали) и характеризующиеся тремя различными значениями энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на большее число атомов); общее число энергетических уровней будет при этом равно числу взаимодействующих атомов. Схема подобного процесса представлена на рис. 135.
Как показывает эта схема, с ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояния между соседними энергетическими уровнями уменьшаются. При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. Но при большом числе атомов N (в макроскопическом кристалле N имеет порядок числа Авогадро) соседние уровни настолько мало различаются, что образуется практически непрерывная энергетическая зона, и переход электрона на ближайший более высокий уровень может осуществиться при затрате ничтожно малой энергии. Если такой ближайший уровень не занят электронами, то находящийся на предшествующем уровне электрон ведет себя как «свободный»; вследствие делокализованности орбиталей он может перемещаться по кристаллу при сколь угодно малых энергетических воздействиях.

|
| 2*8. Чис/ш атомов |
Заполнение электронами МО, составляющих энергетическую зону, происходит в порядке последовательного возрастания энергии. При этом, в соответствии с принципом Паули, на каждой МО может размещаться по два электрона.
 Рис. 136. Схема заполнения электронами энергетических уровней в кристалле щелочного металла:
о — занятые уровни (валентная зона); 6 — незанятые уровни (зона проводимости).
Рис. 137. Схема заполнения электронами энергетических уровней в кристалле металла главной подгруппы второй группы:
а — валентная зона, образованная нз исходных внешних s-орбиталей; б — зона проводимости, образованная из исходных внешних р-орбиталей.
Рис. 136. Схема заполнения электронами энергетических уровней в кристалле щелочного металла:
о — занятые уровни (валентная зона); 6 — незанятые уровни (зона проводимости).
Рис. 137. Схема заполнения электронами энергетических уровней в кристалле металла главной подгруппы второй группы:
а — валентная зона, образованная нз исходных внешних s-орбиталей; б — зона проводимости, образованная из исходных внешних р-орбиталей.
|
В кристалле какого-нибудь щелочного металла, например калия, атомные орбитали внутренних электронных слоев практически не перекрываются. Можно считать, что в этом случае непрерывная энергетическая зона создается только за счет орбиталей внешнего электронного слоя и заполняется электронами этого слоя. В кристалле, содержащем N атомов, из исходных атомных s-орбиталей внешнего слоя образуется энергетическая зона, состоящая из N уровней. В этой зоне размещаются N внешних s-электронов атомов щелочного металла, которые занимают N/2 энергетических уровней (по два электрона на каждом уровне). Совокупность этих занятых валентными электронами уровней называется валентной зоной. В рассматриваемом случае валентная зона занимает лишь половину имеющихся энергетических уровней. Остальные уровни остаются незаполненными, образуя зону проводимости (рис. 136). Здесь в непосредственной близости от верхних занятых уровней имеются свободные уровни, на которые могут переходить электроны под действием электрического поля. Это и создает возможность переноса тока электронами — обеспечивает электрическую проводимость металла.
В кристалле металла главной подгруппы второй группы (например, кальция) из исходных атомных s-орбиталей наружного слоя также образуется зона, состоящая из N уровней. Но, поскольку здесь каждый атом обладает двумя внешними s-электро- нами, то в этой зоне должно разместиться 2N электронов, так что все ее уровни окажутся полностью занятыми. Однако при взаимодействии атомов металла перекрываются не только внешние s-op- битали, но и внешние р-орбитали. В результате также образуется непрерывная энергетическая зона, не заполненная электронами. При этом зоны, образованные s- и р-орбиталями, перекрываются (рис. 137), так что и в этом случае зона проводимости, содержащая свободные энергетические уровни, непосредственно примыкает к валентной зоне. Таким образом, рассматриваемый кристалл также должен обладать высокой электрической проводимостью.
На рис. 136 и 137 изображена резкая граница между валентной зоной и зоной проводимости. В действительности эта граница размыта; вследствие теплового движения электроны могут переходить с верхних уровней валентной зоны на нижние уровни зоны проводимости. Способность этих электронов свободно передвигаться по кристаллу и переносить энергию из одной его части (нагретой) в другую (более холодную) служит причиной высокой теплопроводности металлов. Таким образом, и электрическая проводимость и теплопроводность металлов обусловлены возможностью свободного передвижения электронов зоны проводимости. Именно поэтому для большинства металлов наблюдается параллелизм между этими величинами. Например, лучшие проводники электричества — серебро и медь — обладают и наиболее высокой теплопроводностью (см. табл. 29).
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки сме щаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.

|
В отличие от металлов кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, т.е. значительным энегретическим промежутком АЕ (рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлов, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полу проводник). Однако ширина запрещенной зоны АЕ в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением теглпературы или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронами энергетические уровни — электронные вакан*

|
|
| / |
| ■V |
а
| X | ||
| © | ||
| / |
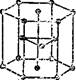
Ркс. 13Э. Основные типы кристаллических решеток металлов:
а — объемноцентрпрозанкая кубическая; О — гракецентрирс-закпая кубическая; в — гексагональная.
Рис. 149. C::v::а различной ориентации кристаллических регпгток в полукристаллическом теле.
спи, или «дырки». В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронами зоны проводимости (n-проводиыость,[122] от латинского «negative» — отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).
191. Кристаллическое строение металлов. Кристаллическое строение металлов изучается различными методами. Их можно разделить на две группы. К первой принадлежат методы изучения внутреннего строения кристаллов, ко второй—методы изучения их внешних форм.
Внутреннее строение кристаллов изучается главным образом с помощью рентгеноструктурного анализа (см. § 50). По его данным для всех металлов установлены типы и параметры кристаллических решеток.
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объе мноцвптрировапн ая кубическая (Li, Na, К, V, Сг, Fe *, РЬ, W и др.), гранецентрированная кубическая (Al, Са, Fe [123], Ni, Cu, Ag, Au и др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.). На рис. 139 показаны элементарные ячейки (см. § 50) решеток этих типов.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении дает микроскопический анализ его шлифа. Из испытуемого металла вырезают образец и его плоскость шлифуют, полируют и протравливают специальным раствором (т р а в и т е л е м). В результате травления выявляется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
Кристаллы металлов обычно имеют небольшие размеры. Поэтому любое металлическое изделие состоит из большого числа
кристаллов. Такая структура называется поликристаллической. При кристаллизации металла из расплавленного состояния растущие кристаллы мешают друг другу принять правильную форму. Поэтому кристаллы поликристаллического тела имеют неправильную форму и в отличие от правильно ограненных кристаллов называются кристаллитами или зернами. Зерна различаются между собой пространственной ориентацией их кристаллических решеток (рис. 140).
При травлении шлифа границы зерен разъедаются сильнее; они становятся углубленными. Свет, падая на них, рассеивается, и в поле зрения микроскопа границы зерен представляются темными, а сами зерна — светлыми (рис. 141).
Специальными способами получают куски металлов, представляющие собой один кристалл — монокристаллы. Монокристаллы металлов, а также неметаллов изготовляют для научных исследований и для специальных отраслей техники (полупроводники, лазеры и др.).
Внутренняя структура зерна металла не является строго правильной. Металлам, как и всем реальным кристаллам (см. § 51), присущи дефекты структуры. При этом многие свойства металлов сильно зависят от характера и от числа имеющихся в металле дефектов. Так, в процессах диффузии важную роль играют вакансии. Эти процессы протекают, например, при насыщении в горячем состоянии поверхностного слоя металлического изделия другими элементами для защиты от коррозии или для придания поверхности изделия твердости. Проникновение атомов постороннего элемента в глубь металла происходит в основном по местам вакансий. С повышением температуры число вакансий возрастает, что служит одной из причин ускорения процесса диффузии.
Некоторые механические свойства металлов зависят от количества дислокаций и от их способности к перемещению по металлу. Так, высокая пластичность металлов объясняется перемещением дислокаций.
Схема пластического сдвига в кристалле металла изображена на рис. 142. Внешняя сила Р первоначально вызывает небольшое смещение атомов вертикальных рядов /, 2, 3 (рис. 142, а). С увеличением силы Р это смещение возрастает и ряд атомов 1 (выше плоскости скольжения А А) проскакивает нейтральное положение между 1' и 2'. При этом ряд 2 превращается в лишнюю плоскость и образует дислокацию (рис. 142, б), знакомую нам по рис. 62 (стр. 156). В результате образования дислокации решетка искажается по обе стороны плоскости скольжения. Поэтому далее уже при небольшой силе Р вертикальные ряды атомов над плоскостью скольжения будут смещаться — дислокация подобно эстафете будет последовательно передаваться рядам 3,4 и далее.

|
Рис. 141. Микроструктура металла (стократное увеличение).

|
| й Р |
в г
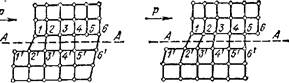 Рис. 142. Дислокационная схема пластического сдвига.
Рис. 142. Дислокационная схема пластического сдвига.
|
В какой-то момент будет иметь место положение, представленное на рис. 142, е. В итоге же дислокация выйдет на поверхность и исчезнет, как показано на рис. 142, г.
Таким образом, пластический сдвиг в реальном металле происходит не путем одновременного сдвига всей атомной плоскости, что потребовало бы затраты гораздо большей энергии, а путем перемещения дислокаций вдоль плоскости скольжения.
Металлические кристаллы, лишенные дислокаций, обладают весьма высокой прочностью. Такими кристаллами являются выращиваемые в особых условиях нитевидные кристаллы или «усы». Их прочность во много раз превышает прочность обычных образцов соответствующего металла и близка к теоретической величине, вычисленной для кристаллической решетки металла, не имеющей дефектов структуры.
С другой стороны, появление в металле очень большого числа различно ориентированных дислокаций также приводит к повышению прочности, так как при этом кристаллическая структура металла сильно искажается и перемещение дислокаций затрудняется. В этом состоит объяснение явления наклепа — упрочнения металла под действием пластической деформации. При нагревании сильно деформированного металла искажения его структуры, вызванные сдвигами, постепенно снимаются — металл возвращается в структурно более устойчивое состояние; его пластичность возрастает, а твердость и прочность снижаются.
192. Добывание металлов из руд. Огромное большинство металлов находится в природе в виде соединений с другими элементами. Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, а серебро и медь — отчасти; иногда попадаются также самородные ртуть и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением из раствора. Все же остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главнейшие руды содержат оксиды, сульфиды и карбонаты металлов. Получение металлов из руд составляет задачу металлургии — одной из наиболее древних отраслей химической промышленности. Металлургические процессы, протекающие при высоких температурах, называются п прометал- л у р г и ч е с к и м и. Пирометаллургическим путем получают, например, чугун и сталь.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем или СО. Если, например, смешать красную медную руду Cu20 с углем и накалить, то уголь, восстанавливая медь, превращается в оксид углерода (II), а медь выделяется в расплавленном состоянии:
Cu20 + С = 2Си + СО|
Выплавка чугуна производится восстановлением железных руд оксидом углерода.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем. Например: 2ZnS + 302 = 2ZnO -f 2SQ2f ZnO + С = Zn + COf
Кроме пирометаллургических методов, при добывании металлов применяются гидрометаллургические методы. Они представляют собою извлечение металлов из руд в виде их соединений водными растворами различных реагентов с последующим выделением металла из раствора. Гидрометаллургическим путем получают, например, золото (см. § 202).
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералами, все остальные — пустой породой. Последняя чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются. Если пустая порода состоит из известняка, то в качестве флюса применяется песок. Для руд, содержащих большие количества песка, флюсом служит известняк. В обоих случаях в качестве шлака образуется силикат кальция, поскольку песок состоит в основном из диоксида кремния.
Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание рудного минерала повышается. Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Флотационный метод основан на различной смачиваемости поверхности минералов водою. Тонкоизмельченную руду обрабатывают водой, к которой добавлено небольшое количество флотационного реагента, усиливающего различие в смачиваемости частиц рудного минерала и пустой породы. Через образующуюся смесь энергично продувают воздух; при этом его пузырьки прилипают к зернам тех минералов, которые хуже смачиваются. Эти минералы выносятся вместе с пузырьками воздуха на поверхность и таким образом отделяются от пустой породы.
Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Не все металлы можно получить восстановлением их оксидов углем или СО. Подсчитаем, например, стандартную энергию Гиббса реакции восстановления хрома:
Сг203 + ЗСО = 2Сг + ЗС02
о
Воспользовавшись табл. 7 (стр. 194), находим AG06p сг2о3 — = —1059 кДж/моль, AGosp со* =—394,4 кДж/моль, AGogpco3 = -137,1 кДж/моль, откуда AG° = 3 (-394,4) - [-1059 + + 3(—137,1)] = +267,1 кДж. Полученная величина положительна. Это показывает, что при 25 °С и стандартных концентрациях реагирующих веществ реакция не протекает в интересующем нас направлении. Положительное и большое по абсолютной величине значение AG° указывает на то, что реакция не протекает в направлении восстановления металла не только при стандартных условиях, но и при температурах и концентрациях, заметно отличающихся от стандартных.
Для металлов, не восстанавливаемых ни углем, ни оксидом углерода (II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии. Такие металлы, как хром, марганец, получают главным образом алюминотермией, а также восстановлением кремнием. Если мы подсчитаем AG° реакции
Сг203 + 2А1 = 2Сг + АЦОз
то получим отрицательную величину (—523 кДж). Это говорит о том, что восстановление хрома алюминием может протекать самопроизвольно.
Наконец, металлы, оксиды которых наиболее прочны (алюминий, магний и другие), получают электролизом (см. § 103).
193. Получение металлов высокой чистоты. На протяжении последних десятилетий в связи с развитей новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежной работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долей процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более одного атома фосфора, мышьяка или сурьмы на десять миллионов атомов металла. В жаропрочных сплавах, широко применяемых, например, в ракетостроении, совершенно недопустима даже ничтожная примесь свинца или серы.
В связи с потребностями промышленности разработаны новые методы очистки веществ. Рассмотрим наиболее важные из них.
Перегонка в вакууме. Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси[124] (если они более летучи, чем основной металл), либо очищенный металл (если примеси менее летучи). Процесс ведется при непрерывной откачке воздуха, так как присутствие даже небольших количеств кислорода приводило бы к окислению поверхности расплавленного металла и тем самым к торможению процесса испарения.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, который находится в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу.
Зонной плавке подвергают металл, прошедший предварительную очистку. Содержание примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит плавление металла у передней границы зоны и кристаллизация его у задней границы. При этом состав образующихся кристаллов, находящихся в равновесии с расплавом, отличается от состава расплава (см. стр. 530). Примеси одних металлов концентрируются в расплавленной зоне и перемещаются вместе с ней к концу бруска; примеси других металлов концентрируются в образующихся кристаллах, остаются за движущейся зоной и при неоднократном повторении процесса перемещаются к началу бруска. В результате средняя часть бруска получается наиболее чистой; ее вырезают и используют.
Зонную плавку применяют для очистки не только металлов, но и других веществ.
Термическое разложение летучих соединений металла. Карбонильный процесс. Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода (II), находящегося под давлением около 20 МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4 (темп. кии. 42 °С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением высокочистого металла.
Дата добавления: 2015-08-21; просмотров: 97 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Все соединения свинца (IV)" —очень сильные окислители. Практическое применение в качестве окислителя э химическои промыщ* ленности имеет РЬ02. | | | XVI СПЛАВЫ 2 страница |