
|
Читайте также: |
При очистке железа аналогичным образом осуществляется процесс синтеза и последующего разложения пентакарбонила железа Fe(CO)5 (темп. кип. 105 DC).
Иодидный способ дает возможность получать титан, цирконий и некоторые другие металлы значительной чистоты. Рассмотрим этот процесс на примере титана. Исходный металл в виде порошка нагревается до 100—200 °С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300'—1500 °С. Титан (но не примеси) образует с иодом летучий нодид Til4, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом новые порции иодида; процесс идет непрерывно до переноса всего металла па титановые нити.
Процесс можно представить схемой:
Незагрязненный) +
100-200 °С 1300-1500 °С + 212(газ) ------------- Til4 (газ) ТКчистый) + 212(газ)
-t__________________________________________!
194. Сплавы. Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы— изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме

|
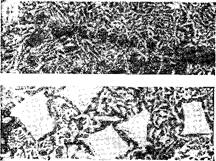
Рис. из. Микроструктура сплава двух металлов, образующих механическую скесь. Рис. 144. Микроструктура сплава двух металлов, образующих твердый раствор.
того, металлические материалы очень многочисленны и разнообразны по своим свойствам.
В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие три.
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов [125], отчетливо выявляемых на микрошлифе (рис. 143).
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 144). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.

|
195. Диаграммы состояния металлических систем. При изучении свойств сплавов очень большое значение имеют д и а г р а м м ы состояния, характеризующие состояние сплавов различного состава при разных температурах. Такие диаграммы показывают термодинамически устойчивые состояния, т. е. состояния, отвечающие минимуму энергии Гиббса системы. Их называют также ф а - зовыми диаграммами, так как они показывают, какие фазы могут сосуществовать при данных условиях.
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и переги
бам на них, вызванным тепловыми эффектами превращений, определяют температуры этих превращении. Для получения кривых охлаждения приготовляют из двух металлов изучаемой системы ряд смесей различного состава. Каждую из приготовленных смесей р аспла вляют. Получающиеся жидкие сплавы (расплавы) медленно охлаждают, отмечая через определенные промежутки вре^ мени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс время, а на оси ординат — температуру (рис. 145).
На рис. 145 слева показано, какой вид имеет кривая охлаждения чистого расплавленного металла. Сначала понижение температуры плавно идет по кривой ak. В точке k происходит перелом кривой, начинается образование твердой фазы (кристаллизация), сопровождающееся выделением теплоты, вследствие чего температура некоторое время остается постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается плавное понижение температуры по кривой св.
Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая на связанные с выделением теплоты процессы, происходящие уже в твердом веществе, например переход из одной кристаллической формы в другую.
Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 145 справа. Точка k, как и на первой кривой, отвечает началу затвердевания — началу выделения из сплава кристаллов одного из входящих в него металлов. При этом состав остающегося жидким сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Однако выделяющаяся при кристаллизации теплота все же замедляет ход охлаждения, вследствие чего в точке к происходит перелом кривой. Выпадение кристаллов и плавное понижение температуры присходят до тех пор, пока не достигается температура, при которой сплав закристаллизовывается без изменения состава. Здесь падение температуры приостанавливается

|
| Гнс. 145. Кривые охлаждения. |
| Ри;. 146. Координаты для построения диаграммы состояния системы, состоящей из дву^ металлов. |
| 40 НО 80 100 Y |
| J—] t. Т '.1 |
| Время |
Рис. 147. Диаграмма состояния сиси-мы РЬ — sb.
(точка ki). Когда кристаллизация закончится, температура падает по кривой св.
Имея достаточный набор сплавов, различающихся содержанием компонентов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. На диаграммах состояния по вертикальной оси откладывают температуру, а по горизонтальной — состав сплава (содержание одного из компонентов). Для сплавов, состоящих из двух компонентов, обозначаемых буквами X и Y, состав характеризуется на отрезке прямой, принятом за 100 %. Крайние точки соответствуют индивидуальным компонентам. Любая же точка отрезка, кроме крайних, характеризует состав двойного сплава. На рис. 146 числа указывают содержание компонента 3'. Например, точка К отвечает сплаву, состоящему из 20 % У и 80 % X.
Рассмотрим четыре простых случая — четыре типа диаграмм, соответствующие упомянутым выше типам сплавов: механической смеси, твердому раствору с неограниченной и с ограниченной растворимостью и химическому соединению.
| J(I ? J^ hs^r | ____ 7Л 111 | |
| - IV | i —... | V „, 1 t_ |
| 4СС- |
| 3SS |
| Ра 13 го w |
| 60 80 100 Sb Sb,% Шс.) |
| К: |
| 0 |
Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов. В качестве примера диаграммы этого типа на рис. 147 приведена диаграмма состояния системы Pb—Sb. Точки А и В на диаграмме—это температуры плавления компонентов системы: свинца (327°С) и сурьмы (631°С). В сплавах рассматриваемого типа добавка одного компонента к другому, согласно закону Рауля, понижает температуру начала его кристаллизации (затвердевания). Кривая АЕ показывает температуру кристаллизации свинца из расплавов, богатых свинцом, а кривая BE — температуру кристаллизации сурьмы из расплавов, богатых сурьмой. Видно, что по мере увеличения содержания второго компонента температуры кристаллизации как свинца, так и сурьмы понижаются. Точка Е принадлежит обеим кривым: из расплава, состав которого отвечает этой точке, кристаллизуются одновременно вба металла. Эта совместная кристаллизация происходит при самой низкой температуре. Отвечающий точке Е состав называется эвтектическим составом, а соответствующий сплав — эвтектическим сплавом или просто эвтектикой (от греческого «эвтектикос» — хорошо плавящийся). Для системы Pb—Sb эвтектика состоит из 13 % Sb и 87 % Pb; она плавится и кристаллизуется при 246 °С.
Рассмотрим подробнее процесс кристаллизации расплава. Пусть это будет расплав, содержащий 40 % Sb и 60 % РЬ (точка k на рис. 147). При охлаждении этого расплава до 395 °С (точка /) из него начнут выпадать кристаллы. Это будут кристаллы избыточного по сравнению с эвтектикой компонента, в данном случае — сурьмы. Теперь сплав стал двухфазным. На диаграмме состояния ему отвечают две точки: точка I (расплав) и точка т (кристаллы сурьмы). Кристаллизация некоторого количества сурьмы изменит состав расплава; он станет беднее сурьмой и, следовательно, богаче свинцом. Точка на диаграмме, отвечающая расплаву, сместится немного влево. Поскольку охлаждение продолжается, эта точка вновь дойдет до кривой — из расплава снова выпадет какое-то количество кристаллов сурьмы. Таким образом, по мере охлаждения и кристаллизации точка, отвечающая расплаву, двигается вниз и влево по кривой кристаллизации сурьмы, а точка, отвечающая кристаллам сурьмы, — вниз по правой вертикальной оси. Когда расплав достигнет эвтектического состава, из него станут выпадать очень мелкие кристаллы обоих компонентов (эвтектика), пока не закристаллизуется все взятое количество вещества. Получившийся сплав будет представлять собою смесь эвтектики с кристаллами сурьмы.
Если исходить из расплава, содержащего небольшое количество сурьмы (меньше эвтектического), то весь процесс будет происхо«дить аналогично рассмотренному, с той разницей, что вначале будут выпадать кристаллы не сурьмы, а свинца. Полученный сплав будет иметь структуру, представляющую собой смесь эвтектики с кристаллами свинца. Наконец, если исходить из расплава эвтектического состава, то весь сплав закристаллизуется при 246 °С и будет представлять собой эвтектику. На рис. 148 показана структура сплавов системы Pb—Sb.
|
Если верхние кривые диаграммы на рис. 147 (АЕ и BE) показывают температуру начала кристаллизации, то нижняя — горизонталь, проходящая через точку Е, — показывает температуру окончания кристаллизации сплава. Как видно, для систем,
тшшшмшштшт
. >., /Л.,., " > 4 - ' < „•/♦:________ -j
Рис. 148. Структура сплавов свинца о сурьмой:
a — сплав, содержащий избыток свинца; б — эвтектический сплав: в — сплав, содержащий избыток сурьмы.
имеющих диаграммы рассматриваемого типа, температура окончания кристаллизации не зависит от состава сплава.
При плавлении твердых сплавов горизонталь, проходящая через точку Е, показывает температуру начала плавления. В рассматриваемом случае эта температура не зависит от состава сплава, потому что плавление начинается с эвтектики, входящей в состав всех сплавов системы (кроме индивидуальных компонентов). При этом температура сплава будет оставаться постоянной, пока вся имеющаяся в нем эвтектика не расплавится. Дальнейшее нагревание приведет к повышению температуры — начнут плавиться кристаллы чистого компонента, которые находились в исходном сплаве в смеси с эвтектикой. Состав расплава будет обогащаться этим компонентом, и точка, отвечающая расплаву, будет двигаться по соответствующей ветви верхней кривой. Когда плавление закончится, т. е. когда твердая фаза исчезнет, тогда состав расплава станет таким же, каким был состав исходного сплава. Таким образом, если исходить из твердого сплава, то горизонталь, проходящая через точку Е, показывает температуру начала, а кривые АЕ и BE — окончания плавления.
Из сказанного ясно, что области I на диаграмме рис. 147 отвечает расплав, областям II и III соответствует сосуществование расплава с кристаллами избыточного компонента, областям IV а V отвечает смесь эвтектики с зернами свинца (область /V) или сурьмы (область V).
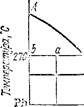
Как уже говорилось, по горизонтальной оси диаграмм состояния откладывается состав взятого сплава. Однако для областей, отвечающих равновесию двух фаз, по этой оси можно также уста» навливать составы этих фаз. Пусть, например, сплав 5 % Sb и 95 % РЬ нагрет до 270 °С. Такому сплаву отвечает точка а на диаграмме состояния (рис. 149). Проведем через эту точку горизонталь до пересечения с ближайшими линиями диаграммы. Мы получим точки b и с. Они показывают, что взятому сплаву при 270 °С отвечает равновесие кристаллов свинца (точка Ь) с расплавом, состав котооого определяется абсциссой точки с (приблизительно 10 % Sb и'90 % РЬ).
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии, На рис. 150 приведена диаграмма состояния системы Ag—Au, представляющая собой простейший пример диаграмм этого типа. Как и в предыдущих случаях, точки А и В показывают температуры плавления компонентов. Вид кривых плавления (нижняя кривая) и затвердевания (верхняя кривая) обусловлен в этом случае тем, что кристаллы, выделяющиеся при охлаждении расплава, всегда содержат оба компонента (кроме, конечно, кристаллизации чистых серебра или золота).
Рассмотрим, как происходит кристаллизация расплавов в этом случае. Пусть исходный жидкий сплав соответствует точке d на
то
О S ю 13
й\
 25 £0 7S 100 Ли,%{',',асс)
25 £0 7S 100 Ли,%{',',асс)
|
|
| .с |
| V/ |

|
| Au |
Sb,%(mcc)
Рис. 143. Часть диаграммы состояния системы Pb — Sh Рис. 153. Диаграмма состояния системы Ag — Au.
диаграмме (рис. 150). При охлаждении его до температуры U (точка е) начинается кристаллизация. Кристаллы представляют собой твердый раствор, более богатый тугоплавким компонентом— золотом (точка р). Поэтому в ходе кристаллизации жидкая фаза обедняется тугоплавким компонентом, и точка диаграммы, отвечающая расплаву, смещается несколько влево. По мере охлаждения эта точка движется вниз, вновь доходит до кривой и процесс кристаллизации продолжается. Таким образом, охлаждение расплава сопровождается выпадением кристаллов твердого раствора, обогащенных тугоплавким компонентом — золотом, и обогащением расплава легкоплавким компонентом — серебром. Соответствующие точки на диаграмме при этом перемещаются: состав жидкой фазы изменяется по верхней линии, а состав' твердого раствора — по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении такой температуры t2, при которой образующиеся кристаллы имеют состав исходного сплава (точка г).
Таким образом, области / на диаграмме состояния рассматриваемой системы (рис. 150) отвечает расплав, области II— сосуществование расплава и кристаллов твердого раствора, области III — твердый раствор. При равновесии точки обеих кривых на диаграмме связаны между собой: каждой температуре отвечает расплав определенного состава и кристаллы тоже определенного состава, но другого, чем состав расплава (например, точке е отвечает точка р).
В ходе процесса кристаллизации температура системы понижается и разновесие между расплавом и кристаллами, образовавшимися ранее, т. е. при более высокой температуре, нарушается. Поэтому кристаллизация сопровождается диффузией, в результате чего при медленном проведении процесса зерна всего сплава получаются однородными и имеют одинаковый состав. При быстром охлаждении процессы диффузии не успевают происходить и сплав получается неоднородным.
Как и в предыдущем случае, по горизонтальной оси диаграммы можно устанавливать составы равновесных фаз, в данном случае— расплава и находящегося в равновесии с ним твердого раствора. Например, система, которой отвечает точка s, состоит из расплава, состав которого отвечает точке е, и кристаллов состава, соответствующего точке р.
Диаграмма состояния для сплавов с ограниченной' взаимной растворимостью в твердом состоянии. В сплавах этого типа, образуемых компонентами X и У, могут существовать жидкая фаза и два твердых раствора: раствор компонента X в У и раствор компонента У в X. В простейшем случае эти два твердых раствора образуют эвтектику; к такому типу принадлежит система РЬ—Sn, диаграмма состояния которой приведена на рис. 151. Отметим прежде всего, что области / здесь отвечает расплав, области II—твердый раствор олова в свинце, области III — твердый раствор свинца в олове.
Для того чтобы понять, существованию каких фаз отвечают другие области на диаграмме и кривые на ней, рассмотрим, как протекает в системе данного типа кристаллизация расплавов.

| 25 50 75 S л, % (мате.) |
| Рис. 151. Диаграмма состояния системы РЬ — Sn. |
| РЬ О |
Сначала будем исходить из жидкого сплава, богатого свинцом (точка d на рис. 151). При охлаждении этого расплава до температуры ti (точка е) начнется выделение кристаллов твердого раствора олова в свинце. Состав этих кристаллов отвечает точке р; они богаче свинцом, чем исходный расплав, так что при кристаллизации расплав обедняется свинцом. Как и в предыдущих случаях, точки на диаграмме, отвечающие расплаву и образующимся кристаллам, перемещаются: состав жидкой фазы изменяется по линии АЕ, а состав кристаллов — по линии AD. По достижении
температуры t2 (точка г) образующиеся кристаллы имеют состав исходного сплава. Если процесс проводится достаточно медленно, то при температуре t2 кристаллизация заканчивается, подобно тому, как это происходит в системах с неограниченной взаимной растворимостью (см. выше).
Кривая ADF показывает растворимость олова в твердом свинце при различных температурах. Видно, что растворимость максимальна при 183,3 °С. Поэтому при охлаждении кристаллов до температуры t3 (точка s) твердый раствор делается насыщенным. В нем начнет протекать превращение в твердом состоянии: кристаллы твердого раствора на основе свинца, состав которых отвечает точке s, будет превращаться в кристаллы твердого раствора на основе олова, состав которых соответствует точке q. При постоянной температуре кристаллы этих двух твердых растворов будут находиться в равновесии. Однако при дальнейшем охлаждении равновесие нарушится и превращение одних кристаллов в другие будет продолжаться. При этом кристаллы твердого раствора на основе свинца будут обедняться оловом — их состав будет изменяться по кривой DF\ одновременно по кривой CG будет изменяться состав кристаллов твердого раствора на основе олова.
Теперь рассмотрим охлаждение жидкого сплава, не столь богатого свинцом (точка /). По охлаждении до температуры ^4 (точка g) из расплава начнут выделяться кристаллы твердого раствора на основе свинца; их состав отвечает точке h. По мере выделения этих кристаллов, расплав обогащается оловом: его состав изменяется по линии АЕ, а состав выделяющихся кристаллов — по линии AD. Когда точка, отвечающая расплаву, достигает точки Е,— из расплава выделяются кристаллы обоих твердых растворов; при этом состав кристаллов твердого раствора на основе свинца отвечает точке D, а состав кристаллов твердого раствора на основе олова — точке С. Ясно, что точка Е представляет собой эвтектическую точку, а выделяющаяся смесь кристаллов — эвтектическую смесь.
В области температур ниже 183,3 °С растворимость свинца в олове и олова в свинце с понижением температуры уменьшается. Поэтому при дальнейшем охлаждении сплава образовавшиеся кристаллы изменяют свой состав. Состав кристаллов твердого раствора олова в свинце изменяется по кривой DF, а кристаллов твердого раствора свинца в олове — по кривой CG.
Аналогично протекает кристаллизация расплавов, богатых оловом. В этом случае кристаллизация начинается с выделения кристаллов твердого раствора на основе олова.
На основании сказанного можно заключить, что областям IV и V на диаграмме отвечает сосуществование жидкого расплава и кристаллов твердого раствора на основе свинца (область IV) или на основе олова (область V), а областям VI и VII — смеси кристаллов эвтектики с кристаллами твердого раствора на основе
Рис. 152. Диаграмма состояния системы Mg — Pb.
свинца (область VI) или твердого раствора на основе олова (область VII).
Диаграмма состояния для сплавов, образующих химические соединения. Металлы образуют друг с другом многочисленные соединения, называемые и н т е р - металлическими. Энтальпии образования подобных соединений обычно невелики; лишь в некоторых случаях (например, при взаимодействии алюминия с расплавленной медью) их образование сопровождается значительным экзотермическим эффектом. Многие металлы образуют по несколько соединений друг с другом, например, AuZn, Au3Zn5, AuZn3; Na4Sn, NaSn, NaSn2.
На рис. 152 приведена диаграмма состояния системы Mg—Pb. Эта система служит простейшим примером систем, в которых образуются химические соединения: свинец образует с магнием только одно соединение Mg2Pb, а в твердом состоянии эти металлы взаимно нерастворимы.
От рассмотренных ранее диаграмм эта диаграмма отличается наличием максимума на кривой начала кристаллизации. Этот максимум (точка С) отвечает температуре плавления соединения Mg2Pb. Абсцисса точки максимума указывает состав соединения. На диаграмме имеются две эвтектики £\ и Е2. Эвтектика Е% представляет собой смесь кристаллов Mg и Mg2Pb, а эвтектика Е2 — кристаллов Pb и Mg2Pb.
Таким образом, диаграмма системы с химическим соединением как бы составлена из двух диаграмм первого типа. Если компоненты системы образуют между собой два или более химических соединения, то диаграмма как бы составлена из трех, четырех и более отдельных диаграмм первого типа.
| . А | 0 | ||||
| • | IT | /ill | |||
| VI | VII | V E 2 Vv | |||
| t | VIIIIIX |
| го |
| 327 250 |
| бо so т fb/AQwcc.) |
| &*500 £460- I I |
| Pb |
| ло |
Кристаллизация сплавов в этом и в подобных случаях происходит аналогично кристаллизации сплавов, образующих диаграммы первого типа. Отличие состоит в том, что, кроме выделения кристаллов индивидуальных компонентов, происходит еще образование кристаллов соединения. По линии AEi из расплавов при охлаждении выделяется магний, по линии Е2В — свинец и по линии EiCE2 — Mg2Pb. Так, если охлаждать жидкий сплав, содержащий 40 % Pb (60 % Mg), то из него сначала будут выделяться кристаллы магния. Когда температура понизится до 460°С, вся оставшаяся еще жидкой часть сплава начнет затвердевать при
этой температуре, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения Mg2Pb.
При охлаждении жидкого сплава, содержащего 75 % РЬ, сначала будут выделяться кристаллы Mg2Pb. Это будет происходить до тех пор, пока температура не снизится до 460 °С — точки образования эвтектики. Аналогичные процессы с выделением эвтектики Е2 (при 250 °С) будут протекать при содержании в сплаве более 80 % РЬ.
Нетрудно понять, что области / на рис. 152 отвечает жидкий сплаз, областям II—V—равновесия жидкого сплава и соответствующих кристаллов (в области II — кристаллы Mg, в областях III и IV — кристаллы Mg2Pb, в области V — кристаллы РЬ), а областям VI—IX — твердые сплавы [Mg -j- эвтектика Е\ {VI), Mg2Pb + эвтектика Е, {VII), Mg2Pb + эвтектика Е2 (VIII), РЬ + + эвтектика Ег (/X)].
Мы рассмотрели наиболее простые, но в то же время важнейшие типы диаграмм состояния. Для многих систем диаграммы состояния носят значительно более сложный характер. Так, ряд металлов и сплавов испытывают превращения в твердом состоянии, переходя из одной модификации в другую. На диаграмме состояния появляются при этом кривые, разграничивающие области устойчивости этих модификаций.
Существуют методы построения диаграмм состояния тройных систем — систем, состоящих из трех компонентов.
Для технически важных систем диаграммы состояния изучены и приводятся в специальной литературе. Они имеют широкое применение в различных областях науки и техники, служат научной основой при подборе сплавов, обладающих заданными свойствами, при изыскании методов термической обработки сплавов, при разработке и создании новых сплавов. Примером системы, имеющей очень большое практическое значение, может служить система Fe — С. Диаграмма состояния этой системы рассмотрена в § 238.
Кроме диаграмм состояния, большое значение имеют диаграммы состав — свойство. На этих диаграммах по оси абсцисс откладывают, как и на диаграммах состояния, состав системы, а по оси ординат — величины, характеризующие различные свойства системы, например, плотность, электрическую проводимость, коррозионную стойкость и др.
В верхней части рис. 153 схематически изображены диаграммы состояния четырех основных типов сплавов, а в нижней его части — отвечающие им типичные диаграммы — «состав — свойство». Видно, что при образовании механической смеси (рис. 153, о) свойства сплавов изменяются линейно и их значения находятся в интервале между значениями этих свойств для индивидуальных компонентов. При образовании твердых растворов (рис. 153,6 и е) наблюдается нелинейная зависимость. При этом некоторые свойства могут значительно отличаться от свойств металлов, составляющих сплав. Наконец, при образовании химического соединения на диаграммах «состав — свойство» появляется максимум или минимум, отвечающий соединению (рис. 153, г).
 Метод построения диаграмм «состав — свойство» был положен II. С. Кургановым * в основу разработанного им метода исследования систем — физико-химического анализа. В настоящее время физико-химический анализ служит одним из основных способов изучения сплавов и вообще систем, состоящих из нескольких компонентов: солей, оксидов и других.
Метод построения диаграмм «состав — свойство» был положен II. С. Кургановым * в основу разработанного им метода исследования систем — физико-химического анализа. В настоящее время физико-химический анализ служит одним из основных способов изучения сплавов и вообще систем, состоящих из нескольких компонентов: солей, оксидов и других.
|
196. Коррозия металлов. Металлические материалы — металлы и сплавы на основе металлов, — приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще
* Николай Семенович Кур паков (1860—1941)—русский ученый, академик, лауреат Государственной премии, автор работ по теории растворов и сплавов, химии комплексных соединений, основоположник физико-химического анализа. Н. С. Курнаков уделял много внимания изучению природных соляных растворов; его работы в этой области способствовали эффективному использованию отечественных соляных ресурсов и привели к открытию месторождений калийных солей вблизи Соликамска.
Дата добавления: 2015-08-21; просмотров: 116 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| XVI СПЛАВЫ 1 страница | | | XVI СПЛАВЫ 3 страница |