
|
Читайте также: |
Другой природный продукт — гуттаперча — также является по* лимером изопрена, но с иной конфигурацией молекул, '
Сырой каучук липок, непрочен, а при небольшом, понижении температуры становится хрупким, Нтобы придать изготовленным
из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации — вводят в него серу и затем нагревают. Вулканизованный каучук называется резиной.
При вулканизации сера присоединяется к двойным связям макромолекул каучука и «сшивает» их, образуя дисульфидные «мостики»,
S S
1 [2 3 4 1 |г 3 4 -СН2—С—СН— СН2-СН2—С—СН—СН2
А н8 i
СНз S
| СНз s b |з 4 ~ СН—СН2— • |
СНз S
1 |2 |з сн2—С— СН—СН2— СН2—С
S I
S-
В результате вулканизации каучук теряет пластичность, становится упругим.
Отсутствие в нашей стране природного каучука вызвало необходимость в разработке метода искусственного получения этого важнейшего для народного хозяйства материала. Советскими химиками был найден и впервые в мире осуществлен (1928—1930)] р промышленном масштабе способ получения синтетического каучука.
По способу, предложенному С. В. Лебедевым (1874—1934), исходным материалом для производства синтетического каучука (СК) служит непредельный углеводород бутадиен, или дивинил, который полимеризуется подобно изопрену;
1 2 3 4 1 2 3 4
«СН2=СН—СН=СН2 —> (-СН2—СН=СН— СН2—)„
бутадиен синтетический каучук
(дивинил) (полибутадиен)
По Лебедеву, исходный бутадиен получают из этилового спирта. Теперь разработано получение его из бутана попутного нефтяного газа.
В настоящее время химическая промышленность производит? много различных видов синтетических каучуков, превосходящих по некоторым свойствам натуральный каучук. Кроме полибута- диенового каучука (СКВ), широко применяются сополимер- йые каучуки — продукты совместной полимеризации (с о п о«А и м е р и з а ци и), бутадиена с другими непредельными соедине-:
ниями, например со стиролом (СКС) или с акрилонитрилом (СКН);
12 3 4
| С |
| ) вН5 /„ fH-) |
—СН2—СН=СН—СН2—СН2—СН—>
бутадиен-стирольный каучук
-сн2—сн=сн—сн2—сн2—сн—'N
бутадизн-нитрильный каучук
В молекулах этих каучуков звенья бутадиена чередуются со звеньями соответственно стирола и акрилонитрила.
В СССР разработано и внедрено в производство получение синтетического полиизопренового каучука (СК.И), близкого по свойствам к натуральному каучуку.
Конденсационные смолы — к ним относят полимеры, получаемые реакцией поликонденсации.
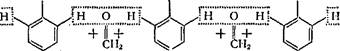
|
| ОН |
| ОН |
| ОН |
| ■ + |
| + • |

|
| + лН20 |
| фенолоформальдегидная смола |
| Процесс сопровождается выделением воды. Фенолоформальдегидные смолы обладают замечательным свойством: при нагревании они вначале размягчаются, а при дальнейшем нагревании (особенно в присутствии соответствующих катализаторов) затвердевают. Из этих смол готовят ценные пластические массы — фенопласты: смолы смешивают с различными наполнителями (древесной мукой, измельченной бумагой, асбестом, графитом и т. п.), с пластификаторами, красителями, и из полученной массы изготовляют методом горячего прессования различные изде-; лия. В последние годы фенолоформальдегидные смолы нашли новые области применения, например производство строительных; |
Фенолоформальдегидные смолы. Эти высокомолекулярные соединения образуются в результате взаимодействия фенола (С6Н5ОНУ с формальдегидом (СН2=0) в присутствии кислот (НС1 и др.) или щелочей (NaOH, NH4OH) в качестве катализаторов. Образование фенолоформальдегидных смол происходит согласно схеме:
деталей из отходов древесины, изготовление оболочковых форм в литейном деле.
Полиэфирные смолы. Примером таких смол может служить продукт поликонденсации двухосновной ароматической терефтале- вой кислоты с двухатомным спиртом этиленгликолем:
О О
| V^I^^J 1 ailivcan 1С» ttixvui»iiiiiw«Ji» / О О \ I—С——С—О—СН2—СН2—О— J • 4 V--/ 'п |
иНО—с—f~\—С—ОН + п НО—СН2—СН2—ОН —>.
терефталевая кислота этнленгликоль
+ тН2 О
полиэтилентерефталат
'Полиэтилентерефталат—полимер, в молекулах которого многократно повторяется группировка сложного эфира. В СССР эту смолу выпускают под названием лоесан (за рубежом — терилен, дакрон). Из нее готовят волокно, напоминающее шерсть, но значительно более прочное, дающее несминаемые ткани. Лавсан обладает высокой термо-, влаго- и светостойкостью, устойчив к действию щелочей, кислот и окислителей.
Полиамидные смолы. Полимеры этого типа являются синтетическими аналогами белков. В их цепях имеются такие же, как в белках, многократно повторяющиеся амидные —СО—NH— группы. В цепях молекул белков они разделены звеном из одного С-атома, в синтетических полиамидах — цепочкой из четырех и более С-атомов. Волокна, полученные из синтетических смол,— капрон, энант и анид — по некоторым свойствам значительно превосходят натуральный шелк. В текстильной промышленности из них вырабатывают красивые прочные ткани и трикотаж. В технике используют изготовленные из капрона или анида веревки, канаты, отличающиеся высокой прочностью; эти полимеры применяют также в качестве основы автомобильных шин, для изготовления сетей, различных технических тканей.
Капрон является поликонденсатом аминокапроновой кислоты, содержащей цепь из шести атомов углеродаг
О О
II II
иШ2—(СН2)6—с' —>--------------------- NH—(СН2)5—С—NH—(СН2)5—С--------- + mH20
\зн
аминокапроновая кислота капрон
Энант — поликонденсат аминоэнантовой кислоты, содержащей цепь из семи атомов углерода.
Анид (найлон илй перлон) получается поликонденсацией двух-, основной адипиновой кислоты НСЮС—(СН2) 4—СООН и гексаме*
тилендиамина NH2—(СН2)6—NH2, Строение цепи анида можно выразить формулой;

|
Натуральные и химические волокна. Все текстильные волокна, применяемые для производства различных видов пряжи, подразделяют на натуральные и химические.
Натуральными — называют волокна, образующиеся в растениях (хлопковое, льняное и другие волокна, состоящие из целлюлозы) или из выделений живых организмов (шерсть, шелковые нити, выделяемые тутовым шелкопрядом, — состоящие из белков),
Химическими — называют все волокна, которые производятся искусственным путем. Их, в свою очередь, подразделяют на искусственные, получаемые при химической переработке природных веществ (главным образом, целлюлозы), и синтетические, — изготовляемые из специально синтезируемых химических материалов (главным образом, синтетических высокополимеров)'.
К искусственным относятся волокна вискозного, ацетатного и медноаммиачного шелка, получаемого переработкой целлюлозы (стр. 480)'. Примерами синтетических волокон служат рассмотренные выше волокна из полимеризационных (хлорин, нитрон) или поликонденсационных (лавсан, капрон, энант, анид) смол. Производство химических волокон имеет огромное народнохозяйственное значение, развитие его способствует повышению материального благосостояния людей. Оно дает возможность обеспечить постоянно растущую потребность в товарах широкого потребления — различных тканях, изделиях из трикотажа, искусственного меха и т. п. В технике наличие разнообразных химических волокон с определенным комплексом свойств позволяет решать многие важные задачи.
В 1985 г. в нашей стране было произведено 1,4 млн. т химических волокон и нитей; к 1990 г, намечено довести их производство до 1,85 млн. т.
КРЕМНИЙ (SJLICIUM)
178. Кремний в природе. Получение и свойства кремния. Крем-1 ний — один из самых распространенных в земной коре элементов. Он составляет 27 % (масс.) доступной нашему исследованию части земной коры, занимая по распространенности второе место после кислорода. В природе кремний встречается только в соединениях? в виде диоксида (двуокиси) кремния Si02, называемого также Кремниевым ангидридом или кремнеземом, и в виде солей крем* ниевых кислот (силикатов). Наиболее широко распространены в природе алюмосиликаты, т. е, силикаты, в состав которых входив алюминий,.К ним относятся полевые шпаты, слюды, каолин и др,
Как углерод, входя в состав всех органических веществ, является важнейшим элементом растительного и животного царства, так кремний — главный элемент в царстве минералов и горных Пород.
В большинстве организмов содержание кремния очень невелико. Однако некоторые морские организмы накапливают большие количества кремния. К богатым им морским растениям относятся диатомовые водоросли, из животных много кремния содержат радиолярии, кремниевые губки.
Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
S Ю2 + 2Mg = 2MgO + S i
При этом образуется бурый порошок аморфного кремния.
Кремний растворим в расплавленных металлах. При медленном охлаждении раствора кремния в цинке или в алюминии кремний выделяется в виде хорошо образованных кристаллов октаэдриче- Ской формы. Кристаллический кремний обладает стальным блеском.
Кристаллы кремния высокой чистоты, имеющие минимальное число дефектов структуры, характеризуются очень низкой электрической проводимостью. Примеси и нарушения правильности строения резко увеличивают их проводимость.
Кремний применяется главным образом в металлургии и в полупроводниковой технике. В металлургии он используется для удаления кислорода из расплавленных металлов и служит составной частью многих сплавов. Важнейшие из них —это сплавы на основе железа, меди и алюминия. В полупроводниковой технике кремний используют для изготовления фотоэлементов, усилителей, выпрямителей. Полупроводниковые приборы на основе кремния выдерживают нагрев до 250 °С, что расширяет область их применения.
В промышленности кремний получают восстановлением диоксида кремния коксом в электрических печах:
SiOj + 2С = Si + 2COf
Полученный по этому способу кремний содержит 2—5 % примесей. Необходимый для изготовления полупроводниковых приборов кремний высокой чистоты получают более сложным путем. Природный кремнезем переводят в такое соединение кремния, которое поддается глубокой очистке. Затем кремний выделяют из полученного чистого вещества термическим разложением или действием восстановителя. Один из таких методов состоит в превращении кремнезема в хлорид кремния S1CU, очистке этого продукФа и восстановлении из него кремния высокочистым цинком, Весьма чй- стый кремний можно получить также термическим разложением иодида кремния SiU или силана SiH4. Получающийся кремний содержит весьма мало примесей и пригоден для изготовления некоторых полупроводниковых приборов. Для получения еще более чистого продукта его подвергают дополнительной очистке, например зонной плавке (см. § 193).
В химическом отношении кремний, особенно кристаллический, малоактивен; при комнатной температуре он непосредственно соединяется только с фтором. При нагревании аморфный кремний легко соединяется с кислородом, галогенами и серой.
Кислоты, кроме смеси фтороводорода и азотной кислоты, не действуют на кремний, но щелочи энергично реагируют с ним, выделяя водород и образуя соли кремниевой кислоты НгЭЮз:
Si + 2 КОН + Н20 = K2Si03 + 2H2f
В присутствии следов щелочи, играющей роль катализатора, кремний вытесняет водород также из воды.
Если накаливать в электрической печи смесь песка и кокса, взятых в определенном соотношении, то получается соединение кремния с углеродом — карбид кремния SiC, называемый карборундом:
Si02 + 3C= SiC + 2COf
Чистый карборунд — бесцветные очень твердые кристаллы (плотность 3,2 г/см3). Технический продукт обычно окрашен примесями в темно-серый цвет.
По внутреннему строению карборунд представляет собой как бы алмаз, в котором половина атомов углерода равномерно заменена атомами кремния. Каждый атом углерода находится в центре тетраэдра, в вершинах которого расположены атомы кремния; в свою очередь каждый атом кремния окружен подобным же образом четырьмя атомами углерода. Ковалентные связи, соединяющие все атомы в этой структуре, как и в алмазе, очень прочны. Этим объясняется большая твердость карборунда.
Карборунд получают в больших количествах; применение его разнообразно и связано с его высокой твердостью и огнеупорностью. Из порошка карборунда изготовляют шлифовальные круги, бруски, шлифовальную бумагу. На его основе производят плиты для сооружения полов, платформ и переходов в метро и на вокзалах. Из него готовят муфели и футеровку для различных печей. Смесь порошков карборунда и кремния служит материалом для изготовления силитовых стержней для электрических печей.
При высокой температуре кремний вступает в соединение со многими металлами, образуя силициды. Например, при нагревании диоксида кремния с избытком металлического магния восстанавливающийся кремний соединяется с магнием, образуя сили->. цид магния Mg2Si;
4Mg + SiOj = Mg2Sl + 2MgO
179. Соединения кремния с водородом и галогенами. При действии соляной кислоты на силицид магния Mg2Si получается крем- неводород (силан) SiH4, подобный метану:
Mg,Si + 4НС1 = 2MgClj + SiH4t
Силан SiH4— бесцветный газ, самовоспламеняющийся на воз-' духе и сгорающий с образованием диоксида кремния и воды:
SiH4 + 202 = S i02 + 2Н20
Кроме SiH4, известно несколько других кремневодородов, которые носят общее название силанов, например дисилан Si2H6, три- силан Si3H8. Силаны аналогичны углеводородам, но отличаются от них малой стойкостью. Очевидно, что связь между атомами кремния гораздо менее прочна, чем связь между атомами углерода, вследствие чего цепи —Si—Si—Si— легко разрушаются. Непрочна также связь кремния с водородом, что указывает на значительное ослабление у кремния неметаллических свойств.
Хлорид кремния SiCU получается нагреванием смеси диоксида кремния с углем в струе хлора:
Si02 + 2С + 2С12 = SiCl4 + 2СО|
или хлорированием технического кремния. Он представляет собой Жидкость, кипящую при 57 °С.
При действии воды хлорид кремния подвергается полному гидролизу с образованием кремниевой и соляной кислот!
SiCl4 + ЗН20 = H2Si03 + 4НС1
Вследствие этой реакции при испарении SiCl4 во влажном воздухе образуется густой дым. Хлорид кремния применяется для Синтеза кремнийорганических соединений.
Фторид кремния SiF4 образуется при взаимодействии фторо- родорода с диоксидом кремния:
S102 + 4HF = SiF4f + 2Н20
Это — бесцветный газ с резким запахом.
Как и хлорид кремния, в водных растворах SiF4 гидролизуетсяг SiF4 + ЗН20 = H2Si03 + 4HF
Образующийся фтороводород взаимодействует с SiF4. При этом получается гексафторокремниевая (или кремнефтористоводород■> ная) кислота H2SiF6;
SiF4 + 2HF =H2SiFe
Суммарный процесс выражается уравнением!
3SiF4 + ЗН20 = 2HsSiFe + H2Si03
По силе гексафторокремниевая кислота близка к серной. Соли ее — кремнефториды, или фторосиликаты, в большинстве своем растворимы в воде; малорастворимы соли натрия, калия, рубидия, цезия, практически нерастворима соль бария. Сама кислота и все фторосиликаты ядовиты.
Фторосиликат натрия Na2SiF6 применяется в качестве инсектицида, а также входит в состав смесей для производства цементов и эмалей. Растворимые фторосиликаты магния, цинка, алюминия применяют в строительстве. Эти вещества делают поверхность строительного камня — известняка, мрамора — водонепроницаемой. Такое их действие объясняется образованием малорастворимых фторидов и кремнезема.
180. Диоксид кремния. Наиболее стойким соединением кремния является диоксид кремния, или кремнезем, 5Юг. Он встречается как в кристаллическом, так и в аморфном виде.
Кристаллический диоксид кремния находится в природе главным образом в виде минерала кварца. Прозрачные, бесцветные кристаллы кварца, имеющие форму шестигранных призм с шестигранными пирамидами на концах, называются горным хрусталем (рис. 134). Горный хрусталь, окрашенный примесями в лиловый цвет, называется аметистом, а в буроватый— дымчатым топазом. Но чаще кварц встречается в виде сплошных полупрозрачных масс, бесцветных или окрашенных в разные цвета. Одной из разновидностей кварца является кремень. К мелкокристаллическим разновидностям кварца относятся агат и яшма. Кварц входит также в состав многих сложных горных пород, например гранита и гнейса.
Из мелких зерен кварца состоит обычный песок. Чистый песок— белого цвета, но чаще он бывает окрашен соединениями железа в желтый или красноватый цвет.
Кристаллический диоксид кремния очень тверд, нерастворим в воде и плавится около 1610 °С, превращаясь в бесцветную жидкость. По охлаждении этой жидкости получается прозрачная стекловидная масса аморфного диоксида кремния, по виду сходного со стеклом.
Аморфный диоксид кремния распространен в природе гораздо меньше, чем кристаллический. На дне морей имеются отложения тонкого пористого аморфного кремнезема, называемого трепелом или кизельгуром. Эти отложения образовались из Si02, входив* шего в состав организмов диатомовых i водорослей и некоторых инфузорий,

Рис, 134. Кристаллы горного хрусталя,
Кислоты, за исключением плавиковой, не действуют на диоксид кремния. Плавиковая же кислота легко вступает с ним в реакцию, образуя фторид кремния и воду (см. стр. 350).
Кремнезем в виде песка широко применяется в строительстве, в производстве стекла (см. § 182), керамики (см. § 183), цемента (см. § 184), абразивов. Особая область применения кварца связана с тем, что он способен деформироваться под действием электрического поля. Это свойство кристаллов кварца используется в звукозаписывающей и звуковоспроизводящей аппаратуре и для генерации ультразвуковых колебаний.
181. Кремниевые кислоты и их соли. Диоксид кремния — кислотный оксид. Ему соответствуют слабые малорастворимые в воде кремниевые кислоты. Их можно представить общей формулой rcSi02-mH20. В свободном состоянии выделены ортокремниевая H-tSiO.4, метакремниевая (или кремниевая) H2Si03 и несколько других кислот. Метакремниевая кислота довольно легко образует пересыщенные растворы, в которых она постепенно полимеризуется и переходит в коллоидное состояние. С помощью стабилизаторов можно получить стойкие золи кремниевой кислоты высокой концентрации. Эти растворы применяются в некоторых производствах, например, при изготовлении бумаги, для обработки воды.
В отсутствие стабилизаторов золь кремниевой кислоты переходит в гель. При его высушивании образуются пористые продукты (с и л и к а г ел ь), применяемые в качестве осушителей и адсорбентов.
Соли кремниевых кислот — силикаты — в большинстве своем нерастворимы в воде; растворимы лишь силикаты натрия и калия. Они получаются при сплавлении диоксида кремния с едкими щелочами или карбонатами калия и натрия, например: Si02 + 2NaOH = Na2Si 03 + Н20 Si02 + K2C03 = K2Si03 + C02f
Благодаря внешнему сходству со стеклом и растворимости в воде силикаты натрия и калия получили название растворимого стекла.
Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяется для изготовления кислотоупорного цемента и бетона (см. § 184), для керосинонепроницаемых штука- турок по бетону, для пропитывания тканей, для приготовления ргнезащитных красок по дереву, для химического укрепления слабых грунтов.
В растворах Na2Si03 и K2Si03 сильно гидролизованы; эти растворы имеют щелочную реакцию.
Силикаты чрезвычайно распространены в природе. Как уже упоминалось, земная кора состоит главным образом из кремнезема и различных силикатов. К природным силикатам принадлежат полевые шпаты, слюда, глины, асбест, тальк и многие другие минералы. Силикаты входят в состав целого ряда горных пород: гранита, гнейса, базальта, различных сланцев и т. д. Многие драгоценные камни, например изумруд, топаз, аквамарин, представляют собой хорошо образованные кристаллы природных силикатов.
Состав природных силикатов выражается в большинстве случаев довольно сложными формулами. Ввиду сложности этих формул, а также недоказанности существования соответствующих поликремниевых кислот, принято писать их несколько иначе, чем обычные формулы солей.
Дело в том, что всякую соль кислородной кислоты можно рассматривать как соединение кислотного оксида с основным (или даже с двумя основными оксидами, если это двойная соль). Например, СаСОз можно рассматривать как соединение СаО и С02, A12(S04)3 — как соединение А1203 и 3S03 и т. д. На этом основании при изображении состава силикатов обычно пишут отдельно формулы диоксида кремния и всех оксидов, образующих силикат, соединяя их точками.
Приведем формулы некоторых природных силикатов:
Каолин A1203-2Si02-2H20 или HiALSi/)» Слюда белая К20 • ЗА1203 • 6Si02 • 2Н20 или H4K2Al6Si3024 Асбест СаО • 3MgO • 4Si02 или CaMg3Si4012
Как уже указывалось ранее, силикаты, содержащие алюминий, называются алюмосиликатами. Самыми важными из них являются полевые шпаты.
В состав полевых шпатов, кроме оксидов кремния и алюминия, входят еще оксиды калия, натрия или кальция. Обычный полевой шпат, или ортоклаз, содержит оксид калия; состав его выражается формулой K20-Al203-6Si02. Преобладающий цвет полевых шпатов — белый или красный. Полевые шпаты встречаются в природе как в виде сплошных залежей, так и в составе сложных горных пород.
К алюмосиликатам относятся также слюды, отличающиеся способностью раскалываться на тонкие, гибкие листочки. Слюды имеют сложный состав и наряду с кремнием и алюминием содержат водород, калий или натрий; в состав некоторых слюд входят также кальций, магний и железо. Обычная белая слюда, большие прозрачные пластинки которой вследствие их тугоплавкости часто применяются для закрывания отверстий в различных печах, представляет собой силикат калия и алюминия. Слюды, содержащие большое количество железа и магния, имеют черный цвет. Отдельно слюды встречаются не часто, но они входят в состав многих горных пород. Из кристалликов кварца, полевого шпата и слюды состоят самые распространенные сложные горные породы — грач ниты и гнейсы.
На поверхности Земли минералы и горные породы, соприкасаясь с атмосферой и подвергаясь механическому и химическому действию воды и воздуха, постепенно изменяются и разрушаются. Это разрушение, обусловленное совместной деятельностью воды и воздуха, называется выветриванием. Например, вода, содержащая диоксид углерода, действует на ортоклаз таким образом, что КгО отщепляется и, соединяясь с С02, дает поташ К2СО3; отщепляется также часть Si02, а остаток соединяется с водой и образует новый силикат — каолин, составляющий основу различных глин.
Разложение ортоклаза можно выразить уравнением: к20 • А12Оэ • 6S Ю2 + С02 + пН20 = = КгСОз + 4S Ю2 • (п - 2)Н20 + А1203 • 2Si02 • 2НгО
каолин
Чистый каолин встречается сравнительно редко. Он имеет белый цвет и содержит лишь незначительную примесь кварцевого песка. Такой каолин используется для приготовления фарфора. Обычная глина представляет собой смесь каолина с другими веществами, окрашивающими ее в желтовато-бурый или синеватый цвет.
Соединения кремния играют важную роль в народном хозяйстве. О применении диоксида кремния говорилось в § 180. Ряд силикатных пород, например граниты, применяются в качестве строительных материалов. Силикаты служат сырьем при производстве стекла, керамики и цемента (см. следующие параграфы). Слюда и асбест используются как электроизоляционные и термоизоляционные материалы. Из силикатов изготовляют наполнители для бумаги, резины, красок.
Некоторые алюмосиликаты обладают рыхлой структурой и способны к ионному обмену. Такие силикаты — природные и особенно искусственные — применяются для водоумягчения (см. §212). Кроме того, благодаря своей сильно развитой поверхности, они используются в качестве носителей катализаторов, т. е. как материалы, пропитываемые катализатором.
182. Стекло. При нагревании смесей многих силикатов с другими силикатами или с диоксидом кремния получаются прозрачные аморфные сплавы, называемые стеклами.
По структуре стекла представляют собой переохлажденные системы. Катионы и анионы вещества стекла расположены друг относительно друга как в жидкости, т. е. с соблюдением лишь ближнего порядка (см. § 53). В то же время тип движения ионов в стеклах — в основном колебания — характерен для твердого состояния. Такое строение находит отражение в том, что в отличие от веществ, находящихся в кристаллическом состоянии, стекла не имеют четких температур плавления и затвердевания. При нагревании стекло размягчается, постепенно переходя в жидкое состояние. При охлаждении расплавленного стекла затвердевание тоже происходит постепенно,
Стекло известно человеку с древних времен. Но на протяжении многих столетий им пользовались только для изготовления оконных стекол и посуды. В настоящее время получают стекла с раз"- нообразными свойствами и используют их в различных целях. Для получения стекол с определенными свойствами пользуются разными исходными материалами. Кроме того, свойства стекол зависят от технологического процесса их изготовления.
Обычное оконное стекло, а также стекло, из которого приготовляется большая часть стеклянной посуды (бутылки, стаканы и т. п.), состоит главным образом из силикатов натрия и кальция, сплавленных с диоксидом кремния. Состав такого стекла приблизительно выражается формулой Na20-Ca0-6Si02. Исходными материалами для его получения служат белый песок, сода и известняк или мел. При сплавлении смеси этих веществ происходят следующие реакции:
СаСОз + Si02 = CaSi03 + C02f Na2C03 + Si02 = Na2Si03 + C02f
Часто соду заменяют сульфатом натрия Na2S04 и углем. Уголь восстанавливает сульфат натрия в сульфит натрия Na2S03, который, вступая в реакцию с песком, образует силикат натрия:
2Na2S04 + 2Si02 + С = 2Na2Si03 + 2S02f + C02f
Если при варке стекла заменить соду поташом, то получается тугоплавкое стекло. Оно применяется для изготовления посуды, способной выдерживать сильное нагревание.
При сплавлении диоксида кремния с поташом и оксидом свинца получается тяжелое стекло, называемое хрусталем и содержащее силикаты калия и свинца. Такое стекло обладает большой лучепреломляющей способностью и при шлифовании приобретает сильный блеск; из него делают оптические стекла и художественную посуду.
Большое влияние на свойства стекла оказывает замена части Si02 борным ангидридом В203. Прибавление борного ангидрида увеличивает твердость стекла, делает его более стойким к химическим воздействиям и менее чувствительным к резким изменениям температуры. Из такого стекла изготовляется высококачественная химическая посуда.
Дата добавления: 2015-08-21; просмотров: 78 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| W С ХН IK с хн 2 страница | | | W С ХН IK с хн 4 страница |