
НС^ /СН НС^: /С^ г^СН НС^ /С\ ^СН
СН СН СН СН СН СН
стирол СаНз нафталин CjoHj антрацен С14Н10
'Ароматические углеводороды содержатся в каменноугольной смоле, получаемой при коксовании каменного угля. Другим важным источником их получения служит нефть некоторых месторождений, например Майкопского. Чтобы удовлетворить огромную Потребность в ароматических углеводородах, их получают также Путем каталитической ароматизации ациклических углеводородов нефти.
Эта проблема была успешно разрешена Н. Д. Зелинским и его учениками Б. А. Казанским и А. Ф. Платэ, осуществившими превращение многих предельных углеводородов в ароматические. Так, Из гептана C7Hi6 при нагревании в присутствии катализатора получается толуол: - v; * '
СН2 СН /СНз
Н2С/ \сн2—СНз р. 300 °с НС^
I —---------------------------------------»- I || + 4Н2
Н2С\ /-СНз НС^ /СН
СН2 сн
гептан толуол
Ароматические углеводороды и их производные широко применяют для получения пластических масс, синтетических красителей, лекарственных и взрывчатых веществ, синтетических каучу- ков, моющих средств.
Бензол и все соединения, содержащие ядро бензола, названы ароматическими (в начале XIX века), поскольку первыми изученными представителями этого ряда были душистые вещества или соединения, выделенные из природных ароматных веществ. Теперь к этому ряду относят и многочисленные соединения, не имеющие приятного запаха, но обладающие комплексом химических свойств, называемых ароматическими свойствами.
| или упрощенно: |
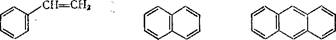 стирол нафталин антрацен
стирол нафталин антрацен
|
Бензол — бесцветная жидкость с характерным запахом; температура кипения 80,1 °С, температура плавления 5,5 °С. Ароматические свойства бензола, определяемые особенностями его структуры, выражаются в относительной устойчивости бензольного ядра, несмотря на непредельность бензола по составу. Так, в отличие от непредельных соединений с этиленовыми двойными связями, бензол устойчив к действию окислителей; например, подобно предельным углеводородам, он не обесцвечивает раствор перманганата калия. Реакции присоединения для бензола не характерны, наоборот, для него, как и для других ароматических соединений, характерны реакции замещения атомов водорода в бензольном, ядре. Ниже приведены важнейшие из таких реакций, -
Реакция галогенирования. При действии брома или хлора (в присутствии катализаторов) образуются галоге и производи ы е:
0+Вг2 QfBr+HBr
бромбензол
Реакция сульфирования. При действии концентрированной серной кислоты (при нагревании) образуются сульфо- кислот ы:
| S020H |
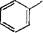
|
| +! но |

|
| + н2о |
-SOjOH
| серная кислота |
бензолсульфо- кислота
Реакция нитрования. При действии концентрированной азотной кислоты (в присутствии концентрированной H2S04) образуются н и т р о с о е д и н е н и я:
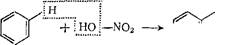 азотная кислота
азотная кислота
|
| мо2 kj +Н2° нитробензол |
Нитрованием толуола получают взрывчатое вещество — три' нитротолуол (тротил, или тол) \
сн,
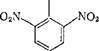
|
no2
Многие другие ароматические полинитросоеди нения (содержащие три и более нитрогрупп — N02) также используются как взрывчатые вещества. Нитросоединения могут быть восстановлены в амины (§ 175).
Из сказанного следует, что формула бензола в виде цикла с чередующимися двойными и простыми связями (формула Ке- куле) неточно выражает природу связей между атомами углерода в бензольном ядре. В соответствии с этой формулой в бензоле должно быть три локализованных я-связи, т. е. три пары я-элек- тронов, каждая из которых фиксирована между двумя атомами
углерода — схема (1); если обозначить эти я-электроны точками, то строение бензола следует представить схемой (2);
н к и
Дата добавления: 2015-08-21; просмотров: 87 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| II II II II | | | It. С н ЗК X*. Л1 |