
149. Мышьяк (Arsenicum). Мышьяк встречается в природе большей частью в соединениях с металлами или серой и лишь изредка в свободном состоянии. Содержание мышьяка в земной коре составляет 0,0005 % (масс.).
Обычно мышьяк получают из мышьяковистого колчедана FeAsS. При его нагревании в атмосфере воздуха образуется оксид мышьяка (III) As203, который далее восстанавливают углем до свободного мышьяка.
Подобно фосфору, мышьяк существует в нескольких аллотропических модификациях. Наиболее устойчив при обычных условиях и при нагревании металлический, или серый, мышьяк. Он образует серо-стальную хрупкую кристаллическую массу с металлическим блеском на свежем изломе. Плотность серого мышьяка равна 5,72 г/см3. При нагревании под нормальным давлением он сублимируется. В отличие от других модификаций, серый мышьяк обладает металлической электрической проводимостью.
В воде мышьяк нерастворим. На воздухе при комнатной температуре он окисляется очень медленно, а при сильном нагревании сгорает, образуя белый оксид As203 и распространяя характерный чесночный запах. При высокой температуре мышьяк непосредственно взаимодействует со многими элементами. Сильные окислители переводят его в мышьяковую кислоту, например:
2As + 5С12 + 8Н 20 = 2 H3A s04 + 10НС1
Как свободный мышьяк, так и все его соединения — сильные яды.
В соединениях мышьяк проявляет степень окисленности -f-5, +3 и —3.
Гидрид мышьяка, или арсин, AsH3 представляет собой бесцветный, очень ядовитый газ с характерным чесночным запахом, мало растворимый в воде. Арсин образуется при восстановлении всех соединений мышьяка водородом в момент выделения. Например:
As203 + 6Zn + 6H2S04 = 2AsH3| + 6ZnS04 + 3H20
Арсин сравнительно нестоек и при нагревании легко разлагается на водород и свободный мышьяк. Это свойство арсина используется для открытия мышьяка в различных веществах. На анализируемое вещество действуют восстановителем и, если в нем содержится какое-либо соединение мышьяка или мышьяк в свободном состоянии, то образуется AsH3. Далее продукты восстановления нагревают, арсин разлагается, а выделяющийся мышьяк образует на холодных частях прибора характерный черный блестящий налет, называемый «мышьяковым зеркалом».
С некоторыми металлами мышьяк образует соединения — ар- сен иды, многие из которых можно рассматривать как продукты замещения водорода в арсине атомами металла — например, Cu3As, Ca3As2.
С кислородом мышьяк образует два оксида: As203 и As205.
Оксид мышьяка (III), или мышьяковистый ангидрид, As203 образуется при сгорании мышьяка на воздухе или при прокаливании мышьяковых руд. Это вещество белого цвета, которое называют белым мышьяком. Оксид мышьяка(III) довольно плохо растворяется в воде: насыщенный при 15°С раствор содержитвсего 1,5%
As203. При растворении в воде оксид мышьяка (III) взаимодействует с нею, и образуется гидроксид мышьяка(III) или мышьяковистая кислота:
As203 + ЗН20 = 2As(OH)3
Гидроксид мышьяка (III) амфотерен, но у него преобладают кислотные свойства.
' Ортомышьяковистая (или мышьяковистая) кислота H3As03 в свободном состоянии не получена и известна лишь в водном растворе, в котором устанавливается равновесие: H3As03 «=>: H20 + HAs02
Это равновесие сильно смещено вправо, т. е. преобладающей формой является метамышьяковистая кислота HAs02. Константа диссоциации этой кислоты К = 6- Ю-10. При действии щелочей на As203 получаются соли мышьяковистой кислоты — арсениты,-— например
As203 + 6КОН = 2K3As03 + зн2о
Соединения мышьяка (III) проявляют восстановительные свойства; при их окислении получаются соединения мышьяка (V).
Мышьяковая кислота H3ASO4 при обычных условиях находится в твердом состоянии; она хорошо растворима в воде. По силе мышьяковая кислота почти равна фосфорной. Соли ее — ар сена ты— очень похожи на соответствующие фосфаты. Известны также мета- и двумышьяковая кислоты. При прокаливании мышьяковой кислоты получается оксид мышьяка (V), или мышьяковый ангидрид, As2Os в виде белой стеклообразной массы.
Кислотные свойства мышьяковой кислоты выражены значительно сильнее, чем у мышьяковистой. В этом проявляется рассмотренная на стр.357 и 358 общая закономерность,согласно которой с повышением степени окисленности элемента кислотные свойства его гидроксидов усиливаются, а основные — ослабевают.
Будучи трехосновной, мышьяковая кислота образует средние (а рее на ты) и кислые (гидро- и дигидроарсенаты) соли, например Na3As04, Na2HAs04, NaH2As04.
В кислой среде мышьяковая кислота и арсенаты проявляют свойства окислителей,
В § 99 отмечалось, что электродные потенциалы процессов, протекающих с участием воды, ионов водорода или гидроксид-ионов, имеют тем большую величину, чем кислее раствор. Иначе говоря, если в электрохимическом процессе принимает участие вода и продукты ее диссоциации, то окислитель сильнее проявляет окислительные свойства в кислой среде, а восстановитель сильнее проявляет восстановительные свойства в щелочной среде. Эта общая закономерность хорошо видна на примере соединений мышьяка. Мышьяковая кислота и ее соли в кислой среде взаимодействуют с восстановителями, переходя в мышьяковистую кислоту или в арсениты. Например:
K3As04 + 2KI + H2S04 = K3As03 + Ij + KjS04 + H20
Здесь процесс восстановления описывается уравнением: As043" + 2Н+ + 2е~ = AsOj" + Н20 а процесс окисления—уравнением:
2Г = 12 + 2е"
Видно, что восстановление протекает с участием воды и ионов Н+, а окисление — без их участия. Следовательно, рН среды влияет только на потенциал процесса восстановления: чем меньше рН, тем выше этот потенциал и тем более сильным окислителем является ион As04".
В то же время в щелочной среде мышьяковистая кислота и ее соли легко окисляются, переходя в арсенаты, например:
K 3As03 + I2 + 2КОН = K3As 04 + 2KI + Н 20
Здесь процесс восстановления описывается уравнением:
12 + 2е~ = 2 Г а процесс окисления—уравнением:
AsO I' + 20Н" = As04" + Н20 + 2е"
В этом случае вода и ионы ОН- принимают участие только в окислении. Следовательно, здесь рН среды влияет лишь на потенциал процесса окисления: чем больше рН, тем ниже этот потенциал и тем более сильным восстановителем служит ион AsOg".
Таким образом, мы видим, что направление протекания окислительно-восстановительных реакций, идущих с участием воды и продуктов ее диссоциации, может изменяться при переходе от кислой среды к щелочной.
Сульфиды мышьяка. Если пропускать сероводород в подкисленный соляной кислотой раствор мышьяковистой кислоты, то образуется желтый осадок сульфида мышьяка(Ш) As2S3, нерастворимый в соляной кислоте. Происходящие реакции можно выразить уравнениями
H3As03 + ЗНС1 AsCl3 + 3H20 2AsCl3 + 3H2S = As2S3| + 6HC1
Аналогично можно получить желтый осадок сульфида мышьяка (V) As2Ss, действуя сероводородом на раствор мышьяковой кислоты в присутствии соляной кислоты:
H3As04 + 5HC1 ASC16 + 4H20
2AsC15 + 5H2S = AS2S5| + 10HC1
При взаимодействии сульфидов мышьяка с сульфидами щелочных металлов Na2S, K2S или с сульфидом аммония (NH4)2S образуются растворимые в воде соли тиомышьяковистой (H3AsS3) и тиомышьяковой (H3AsS4) кислот. Кислоты H3AsS3 и H3AsS4 можно рассматривать как соответствующие кислородсодержащие кислоты мышьяка, в которых весь кислород замещен серой:
As2S3 + 3Na2S = 2Na3AsS3
тиоарсенпт натрия
As2S5 + 3Na2S = 2Na3AsS4
тиоарсенат натрия
Применение свободного мышьяка ограничено. Но соединения мышьяка применяют в медицине, а также в сельском хозяйстве, где они используются в качестве инсектицидов, т. е средств для уничтожения вредных насекомых.
Оксид мышьяка (III) применяется как яд для уничтожения грызунов.
150. Сурьма (Stibium). Сурьма обычно встречается в природе в соединении с серой — в виде сурьмяного блеска, или антимонита, Sb2S3. Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико [0,00005 % (масс.)], сурьма была известна еще в глубокой древности. Это объясняется распространенностью в природе сурьмяного блеска и легкостью получения из него сурьмы. При прокаливании на воздухе сурьмяный блеск превращается в оксид сурьмы Sb203, из которого сурьма получается путем восстановления углем.
В свободном состоянии сурьма образует серебристо-белые кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3. Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит теплоту и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения.
Сурьму вводят в некоторые сплавы для придания им твердости. Сплав, состоящий из сурьмы, свинца и небольшого количества олова, называется типографским металлом или гартом и служит для изготовления типографского шрифта. Из сплава сурьмы со свинцом (от 5 до 15 %Sb) изготовляют пластины свинцовых аккумуляторов, листы и трубы для химической промышленности. Кроме того, сурьму применяют как добавку к германию для придания ему определенных полупроводниковых свойств.
В царской России, несмотря на наличие сырьевой базы, сурьму не получали. Выплавка сурьмы из отечественных руд началась лишь после Октябрьской революции.
В своих соединениях сурьма обнаруживает большое сходство с мышьяком, но отличается от него более сильно выраженными металлическими свойствами.
Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
Сурьма образует соединения с металлами — а и т и м о н и д ы, —• которые можно рассматривать как продукты замещения водорода в стибине атомами металла. В этих соединениях сурьма, как и в SbH3, имеет степень окисленности —3. Некоторые из антимони- дов, в частности AlSb, GaSb и InSb, обладают полупроводниковыми свойствами и используются в электронной промышленности.
Оксид сурьмы(Ш), или сурьмянистый ангидрид, Sb203 — типичный амфотерный оксид с некоторым преобладанием основных свойств. В сильных кислотах, например серной и соляной, оксид
сурьмы(Ш) растворяется с образованием солей сурьмы(Ш): Sb203 + 3H2S04 = Sb2(S04)3 + 3H20
Оксид сурьмы (III) растворяется также в щелочах с образованием солей сурьмянистой НзЭЬОз или метасурьмянистой HSbOa кислоты. Например:
Sb203 + 2NaOH = 2NaSb02 + Н20
Сурьмянистая кислота, или гидроксид сурьмы (III), Sb(OH)3 получается в виде белого осадка при действии щелочей на соли сурьмы (III):
SbCl3 + 3NaOH = Sb(OH)3| + 3NaCl
Осадок легко растворяется как в избытке щелочи, так и в кислотах.
Соли сурьмы (III), как соли слабого основания, в водном растворе подвергаются гидролизу с образованием основных солей: SbCl3 + 2H20 ^ Sb(OH)2Cl +2НС1
Образующаяся основная соль Sb(OH)2Cl неустойчива и разлагается с отщеплением молекулы воды:
Sb(OH)2Cl = SbOCll + Н20
В соли SbOCl группа SbO играет роль одновалентного металла; эту группу называют а и т и м о н и л о м. Полученная основная соль называется или хлоридом антимонила, или хлороксидом сурьмы.
Оксид сурьмы (V), или сурьмяный ангидрид, БЬгОэ обладает главным образом кислотными свойствами; ему соответствует сурьмяная кислота, существующая в водном растворе в нескольких формах. Соли сурьмяной кислоты называются антимонатами.
Сульфиды сурьмы Sb2S3 и Sb2S5 по свойствам аналогичны сульфидам мышьяка. Они представляют собой вещества оранжево-красного цвета, растворяющиеся в сульфидах щелочных металлов и аммония с образованием тиосолей. Сульфиды сурьмы используются при производстве спичек и в резиновой промышленности.
151. Висмут (Bismuthum). Последний член подгруппы — висмут— характеризуется преобладанием металлических свойств над неметаллическими и может рассматриваться как металл.
Висмут — мало распространенный в природе элемент: содержание его в земной коре составляет 0,00002 % (масс.). В природе он встречается как в свободном состоянии, так и в виде соединений —■ висмутовой охры Bi203 и висмутового блеска Bi2S3.
В свободном состоянии висмут представляет собой блестящий розовато-белый хрупкий металл плотностью 9,8 г/см3. Его применяют как в чистом виде, так и в сплавах. Чистый висмут используют главным образом в энергетических ядерных реакторах в качестве теплоносителя. С некоторыми металлами висмут образует легкоплавкие сплавы; например, сплав висмута со свинцом, оловом и кадмием плавится при 70 °С. Эти сплавы применяют, в частности, в автоматических огнетушителях, действие которых основано на расплавлении пробки, изготовленной из такого сплава. Кроме того, они используются как припои.
На воздухе висмут при комнатной температуре не окисляется, но при сильном нагревании сгорает, образуя оксид висмута ЕМ20з. Соляная и разбавленная серная кислоты на висмут не действуют. Он растворяется в азотной кислоте невысокой концентрации и в горячей концентрированной серной:
Bi + 4HN03 = Bi(N03)3 + NOt + 2H20 2Bi + 6H2S04 = Bi2(S04)3 + 3S02t + 6H20
Висмутин, или гидрид висмута, BiH3 очень нестоек и разлагается уже при комнатной температуре.
Оксид висмута(\\\) Bi203 образуется при прокаливании висмута на воздухе, а также при разложении нитрата висмута. Он имеет основной характер и растворяется в кислотах с образованием солей висмута (III).
Гидроксид висмута (III), или гидроокись висмута, Bi(OH)3 получается в виде белого осадка при действии щелочей на растворимые соли висмута:
Bi(N03)3 + 3NaOH = Bi(OH)3j + 3NaN03
Гидроксид висмута (III)—очень слабое основание. Поэтому соли висмута(III) легко подвергаются гидролизу, переходя в основные соли, мало растворимые в воде.
Нитрат висмута, Bi(N03)3-5H20, выкристаллизовывается из раствора, получающегося в результате взаимодействия висмута с азотной кислотой. Он растворяется в небольшом количестве воды, подкисленной азотной кислотой. При разбавлении раствора водой происходит гидролиз и выпадают основные соли, состав которых зависит от условий. Часто образуется соль состава Bi0N03. Радикал BiO — в и с м у т и л — играет роль одновалентного металла:
Bi(N03)3 + Н20 Bi0N03 + 2HN03
Хлорид висмута BiCl3 — гигроскопичные кристаллы, гидроли- зующиеся водой до хлорида висмутила BiOCl.
Сульфид висмута Bi2S3 образуется в виде черно-бурого осадка при действии сероводорода на растворы солей висмута. Осадок не растворяется в сульфидах щелочных металлов и аммония: в отличие от мышьяка и сурьмы, висмут не образует тиосолей.
Соединения висмута (III) применяются в медицине и ветеринарии.
Действием очень сильных окислителей на соединения висмута (III) можно получить соединения висмута (V), Важнейшие из них это висмутаты — соли не выделенной в свободном состоянии висмутовой кислоты, например висмутат калия КВЮ3. Эти соединения представляют собой очень сильные окислители.
Глава ГЛАВНАЯ ПОДГРУППА
XV ЧЕТВЕРТОЙ ГРУППЫ
Главную подгруппу четвертой группы периодической системы образуют пять элементов — углерод, кремний, германий, олово и свинец.
При переходе от углерода к свинцу размеры атомов возрастают. Поэтому следует ожидать, что способность к присоединению электронов, а следовательно, и неметаллические свойства будут при этом ослабевать, легкость же отдачи электронов — возрастать. Действительно, уже у германия проявляются металлические свойства, а у олова и свинца они преобладают над неметаллическими. Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют и к металлам, и к неметаллам, олово и свинец — металлы.
Для элементов рассматриваемой группы характерны степени окисленности +2 и -(-4. Соединения углерода и кремния, в которых
Таблица 28. Некоторые свойства углерода и его аналогов
| Углерод * | Кремний | Германий | Олово | Свинец | |
| Строение внешнего электрон | 2s22p2 | 3s23p2 | 4s24p2 | 5s25p2 | 6s20p3 |
| ного слоя атома | |||||
| Энергия ионизации атома | 11,26 | 8,15 | 7,90 | 7,34 | 7,42 |
| Э —*■ Э+, эВ | |||||
| Относительная электроотрица | 2,5 | 1,8 | 1,8 | 1,8 | 1,9 |
| тельность | |||||
| Радиус атома, нм | 0,077 | 0,134 | 0,139 | 0,155 | 0,175 |
| Стандартная энтальпия атоми | 715,0 | 451,9 | 379,1 | 302,1 | 195,0 |
| зации при 25 °С, кДж на | |||||
| 1 моль атомов | |||||
| Температура плавления, °С | 3750 ** | 14203* | 231,9 | 327,4 | |
| Температура кипения, °С | |||||
| Плотность, г/см® | Алмаз | 2,33 3* | 5,32 | Белое | 11,34 |
| 3,52 Графит 2,26 | 7,29 Серое 5,85 |
| * В стандартном состоянии углерод находится в виде графита. ** При давлении 12 МПа. "* Кристаллический кремний. |
степень окисленности этих элементов равна -{-2, немногочисленны и сравнительно мало стойки.
Некоторые свойства элементов главной подгруппы четвертой группы и образуемых ими простых веществ охарактеризованы в табл. 28.
УГЛЕРОД (CARBONEUM)
152. Углерод в природе. Углерод находится в природе как в свободном состоянии, так и в виде многочисленных соединений. Свободный углерод встречается в виде алмаза и графита. Алмазы образуют отдельные кристаллы или небольшого размера сростки, масса которых обычно колеблется от тысячных до десятых долей грамма. Самый большой из найденных алмазов весил 621,2 г. Кристаллы нередко имеют окраску, обусловленную примесями. Крупнейшие месторождения алмазов имеются в Африке (Заир, ЮАР), в Бразилии, в Индии.
Наиболее крупные месторождения графита образовались в результате воздействия высоких температур и давления на каменные угли. Залежи графита имеются в различных районах СССР.
Уголь, тоже состоящий из углерода, получается искусственным путем. Однако в природе есть вещества, близкие по своему составу к углю. Таковы различные виды ископаемого угля, образующие во многих местах земного шара мощные отложения. Некоторые из ископаемых углей содержат до 99 % углерода.
Соединения углерода очень распространены. Кроме ископаемого угля, в недрах Земли находятся большие скопления нефти, представляющей сложную смесь различных углеродсодержащих соединений, преимущественно углеводородов. В земной коре встречаются в огромных количествах соли угольной кислоты, особенно карбонат кальция. В воздухе всегда имеется диоксид углерода. Наконец, растительные и животные организмы состоят из веществ, в образовании которых главное участие принимает углерод. Таким образом, этот элемент — один из распространенных на Земле, хотя общее его содержание в земной коре составляет всего около 0,1 % (масс.).
По многочисленности и разнообразию своих соединений углерод занимает среди других элементов совершенно особое положение. Число изученных соединений углерода оценивают в настоящее время примерно в два миллиона, тогда как соединения всех остальных элементов, вместе взятые, исчисляются лишь сотнями тысяч.
Многообразие соединений углерода объясняется способностью его атомов связываться между собой с образованием длинных цепей или колец (см. § 162).
153. Аллотропия углерода. В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической системе, и графита, принадлежащего к гексагональной системе. Такие фор-
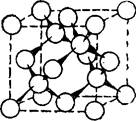
|
Рис. П7. Структура алмаза.
Стрелки показывают связи между атомами в тетраэдрах.
мы его, как древесный уголь, кокс, сажа, имеют неупорядоченную структуру. Синтетически получены карбин и полику- мулен—разновидности углерода, состоящие из линейных цепных полимеров типа
---- С = С—С^С------- или... = С = С =
=С=---. Карбин обладает полупроводниковыми свойствами. При сильном нагревании без доступа воздуха он превращается в графит.
Алмаз — бесцветное, прозрачное вещество, чрезвычайно сильно преломляющее лучи света. Он кристаллизуется в кубической гра- нецентрированной решетке. При этом одна половина атомов располагается в вершинах и центрах граней одного куба, а другая — в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. Атомы углерода в алмазе находятся в состоянии 5,о3-гибридизации и образуют трехмерную тетраэдрическую сетку, в которой они связаны друг с другом ковалентными связями [93]. Расстояние между атомами в тетраэдрах равно 0,154 нм. Структура алмаза показана на рис. 117.
Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема, — атомы углерода «упакованы» в алмазе очень плотно. С этим, а также с большой прочностью связи в углеродных тетраэдрах связано то, что по твердости алмаз превосходит все известные вещества. Поэтому его широко применяют в промышленности; почти 80 % добываемых алмазов используются для технических целей. Его используют для обработки различных твердых материалов, для бурения горных пород. Будучи весьма твердым, алмаз в то же время хрупок. Получающийся при измельчении алмаза порошок служит для шлифовки драгоценных камней и самих алмазов. Должным образом отшлифованные прозрачные алмазы называются бриллиантами.
Ввиду большой ценности алмазов было предпринято много попыток получить их искусственным путем из графита. Однако долгое время эти попытки кончались неудачей. Только в 1955 г., применив очень высокое давление (порядка 1010 Па) и длительный нагрев при температуре около 3000 °С, американским, а одновременно и шведским ученым удалось получить синтетические алмазы. В Советском Союзе также разработан метод получения синтетических алмазов, а в 1961 г. начато их промышленное производство. Кроме того, в 1969 г. в СССР синтезированы нитевидные кристаллы

|
Рис. 118. Структура графитй.
алмаза, причем их получают при обычном давлении. Нитевидные кристаллы, или «усы», имеют структуру, практически лишенную дефектов, и обладают очень высокой прочностью.
При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода. Если сильно нагреть алмаз без доступа воздуха, то он превращается в графит.
Графит представляет собой темно-серые кристаллы со слабым металлическим блеском. Он имеет слоистую решетку. Все атомы углерода находятся здесь в состоянии 5р2-гнбриди- зации: каждый из них образует три ковалентные о-связи с соседними атомами, причем углы между направлениями связей равны 120°. В результате возникает плоская сетка, составленная из правильных шестиугольников, в вершинах которых находятся ядра атомов углерода; расстояние между соседними ядрами составляет 0,1415 нм.
В образовании ст-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешнего слоя занимает 2р-орби- таль, не участвующую в гибридизации. Такие негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя и, перекрываясь друг с другом, образуют делокали- зованные я-связи [94]. Структура графита показана на рис. 118.
Соседние слои атомов углерода в кристалле графита находятся на довольно большом расстоянии друг от друга (0,335 нм); это указывает на малую прочность связи между атомами углерода, расположенными в разных слоях. Соседние слои связаны между собой в основном силами Ван-дер-Ваальса, но частично связь имеет металлический характер, т. е. обусловлена «обобществлением» электронов всеми атомами кристалла [95]. Этим объясняется сравнительно высокая электрическая проводимость и теплопроводность графита не только в направлении слоев, но и в перпендикулярном к ним направлении.
Рассмотренная структура графита обусловливает сильную анизотропию его свойств. Так, теплопроводность графита в направлении плоскости слоев равна 4,0 Дж/(см-с-К), а в перпендикулярном направлении составляет 0,79 Дж/(см-с-К). Электрическое сопротивление графита в направлении слоев в 104 раз меньше, чем в перпендикулярном направлении.
Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга. Этим
объясняется малая механическая прочность графита. Если провести куском графита по бумаге, то мельчайшие кристаллики графита, имеющие вид чешуек, прилипают к бумаге, оставляя на ней серую черту. На этом основано применение графита для изготовления карандашей.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде, превращаясь в диоксид углерода.
Благодаря электрической проводимости графит применяется для изготовления электродов. Из смеси графита с глиной делают огнеупорные тигли для плавления металлов. Смешанный с маслом графит служит прекрасным смазочным средством, так как чешуйки его, заполняя неровности материала, создают гладкую поверхность, облегчающую скольжение. Графит применяют также в качестве замедлителя нейтронов в ядерных реакторах.
Кроме природного, в промышленности находит применение искусственный графит. Его получают главным образом из лучших сортов каменного угля. Превращение происходит при температурах около 3000 °С в электрических печах без доступа воздуха. На основе естественного и, особенно, искусственного графита изготовляют материалы, применяемые в химической промышленности. Благодаря их высокой химической стойкости они используются для футеровки, изготовления труб и др.
Графит термодинамически устойчив в широком интервале температур и давлений, в частности при обычных условиях. В связи с этим при расчетах термодинамических величин в качестве стандартного состояния углерода принимается графит. Алмаз термодинамически устойчив лишь при высоких давлениях (выше 109 Па). Однако скорость превращения алмаза в графит становится заметной лишь при температурах выше 1000 °С; при 1750 °С превращение алмаза в графит происходит быстро.
«Аморфный» углерод (уголь). При нагревании углеродсодержащих соединений без доступа воздуха из них выделяется черная масса, называемая «аморфным» углеродом или просто углем. Такой углерод состоит из мельчайших кристалликов с разупорядо- ченной структурой графита. Уголь растворяется во многих расплавленных металлах, например в железе, никеле, платине. Плотность угля колеблется от 1,8 до 2,1 г/см3.
Угли существенно различаются по своим свойствам в зависимости от вещества, из которого они получены и способа получения. Кроме того, они всегда содержат примеси, сильно влияющие на их свойства. Важнейшие технические сорта угля: кокс, древесный уголь, костяной уголь и сажа.
Кокс получается при сухой перегонке каменного угля. Приме* няется он главным образом в металлургии при выплавке металлов из руд.
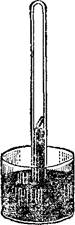
Ркс. 1(9. Прибор для демонстрации поглощения аммиака углем.
Древесный уголь получается при нагревании дерева без доступа воздуха. При этом улавливают ценные продукты сухой перегонки — метиловый спирт, уксусную кислоту и др. Древесный уголь применяется в металлургической промышленности, в кузнечном деле.
Благодаря пористому строению, древесный уголь обладает высокой адсорбционной способностью.
Чтобы наблюдать адсорбцию газов углем, произведем следующий опыт. Наполним аммиаком стеклянный цилиндр и опустим открытый конец его в чашку с ртутью (рис. 119). Затем, прокалив на горелке кусочек древесного угля, погрузим его в ртуть и подведем под отверстие цилиндра с аммиаком. Уголь всплывает на поверхность ртути в цилиндре, и ртуть сейчас же начинает подниматься вверх вследствие поглощения аммиака углем.
Особенно хорошо поглощают газы активные угли (стр. 312). Они применяются для поглощения паров летучих жидкостей из воздуха и газовых смесей, в противогазах, а также в качестве катализатора в некоторых химических производствах.
Уголь обладает способностью адсорбировать-не только газы, но и растворенные вещества. Это его свойство открыл в конце XVIII века русский академик Т. Е. Ловиц.
Костяной уголь получается путем обугливания обезжиренных костей. Он содержит от 7 до 11 % углерода, около 80 % фосфата кальция и другие соли. Костяной уголь отличается очень большой поглотительной способностью, особенно по отношению к органическим красителям, и служит для удаления из растворов различных красящих веществ.
Сажа представляет собой наиболее чистый «аморфный» углерод. В промышленности ее получают термическим разложением метана, а также сжиганием при недостаточном доступе воздуха смолы, скипидара и других богатых углеродом веществ. Сажа применяется в качестве черной краски (тушь, типографская краска), а также в производстве резины как ее составная часть.
|
154. Химические свойства углерода. Карбиды. При низких температурах и уголь, и графит и, в особенности, алмаз инертны. При нагревании их активность увеличивается: уголь легко соединяется с кислородом и служит хорошим восстановителем. Важнейший процесс металлургии — выплавка металлов из руд — осуществляется путем восстановления оксидов металлов углем (или монооксидом углерода).
С кислородом углерод образует диоксид (или двуокись) углерода С02, часто называемый также углекислым газом, и оксид углерода (II), или монооксид углерода, СО.
При очень высоких температурах углерод соединяется с водородом, серой, кремнием, бором и многими металлами; уголь вступает в реакции легче, чем графит и тем более алмаз.
Соединения углерода с металлами и другими элементами, которые по отношению к углероду являются электроположительными, называются карбидами. Их получают прокаливанием металлов или их оксидов с углем.
Карбиды — кристаллические тела. Природа химической связи в них может быть различной. Так, многие карбиды металлов главных подгрупп I, И и III групп периодической системы представляют собой солеобразные соединения с преобладанием ионной связи. К их числу относятся карбиды алюминия АЦСз и кальция СаС2. Первый из них можно рассматривать как продукт замещения водорода на металл в метане СН4, а второй —• в ацетилене С2Н2. Действительно, при взаимодействии карбида алюминия с водой образуется метан
АЦСз + 12Н20 = 4А1(ОН)3 + 3CH4f а при взаимодействии с водой карбида кальция — ацетилен: СаС2 + 2Н20 = Са(ОН)2 + С2Н2|
В карбидах кремния SiC (см. § 178) и бора В4С связь между атомами ковалентная. Эти вещества характеризуются высокой твердостью, тугоплавкостью, химической инертностью.
Большинство металлоз побочных подгрупп IV—VIII групп периодической системы образуют карбиды, связь в которых близка к металлической (см. § 190), вследствие чего эти карбиды в некоторых отношениях сходны с металлами, например обладают значительной электрической проводимостью. Они характеризуются также высокой твердостью и тугоплавкостью; карбиды этой группы применяются в ряде отраслей промышленности.
Большинство ценных свойств чугунов и сталей обусловлены присутствием в них карбида железа FesC (см. § 238).
155. Диоксид углерода. Угольная кислота. Диоксид углерода С02 постоянно образуется в природе при окислении органических веществ (гниение растительных и животных остатков, дыхание, сжигание топлива). В больших количествах он выделяется из вулканических трещин и из вод минеральных источников.
В лабораториях диоксид углерода обычно получают, действуя на мрамор СаС03 соляной кислотой в аппарате Киппа;
СаСОз + 2НС1 = СаС12 + Н20 + C02t
В промышленности большие количества диоксида углерода получают при обжиге известняка:
СаСОз = СаО + С02|
Диоксид углерода при обычных условиях — бесцветный газ, примерно в 1,5 раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Масса 1 л С02 при нормальных условиях составляет 1,98 г. Растворимость диоксида углерода в воде невелика: 1 объем воды при 20 °С растворяет 0,88 объема С02, а при 0 °С — 1,7 объема. Применяется диоксид углерода при получении соды по аммиачно-хлоридному способу (см. стр. 426), для синтеза карбамида (стр. 427), для получения солей угольной кислоты, а также для газирования фруктовых и минеральных вод и других напитков.
Под давлением около 0,6 МПа диоксид углерода при комнатной температуре превращается в жидкость. Жидкий диоксид углерода хранят в стальных баллонах. При быстром выливании его из баллона поглощается вследствие испарения так много теплоты, что С02 превращается в твердую белую снегообразную массу, которая, не плавясь, сублимируется при —78,5 °С. Твердый диоксид углерода под названием «сухой лед» применяется для охлаждения скоропортящихся продуктов, для производства и сохранения мороженого, а также во многих других случаях, когда требуется получение низкой температуры.
Раствор С02 в воде имеет кисловатый вкус и обладает слабокислой реакцией, обусловленной присутствием в растворе небольших количеств угольной кислоты Н2С03, образующейся в результате обратимой реакции:
со2 + н2о н2со3
Таким образом, диоксид углерода является ангидридом угольной кислоты.
Равновесие последней реакции сильно сдвинуто влево-, лишь очень небольшое количество растворенного С02 превращается в угольную кислоту.
Угольная кислота Н2СОз может существовать только в водном растворе. При нагревании раствора диоксид углерода улетучивается, равновесие образования Н2С03 смещается влево, и в конце концов остается чистая вода.
Угольная кислота очень слабая. В растворе она диссоциирует главным образом на ионы Н+ и НСОз" и лишь в ничтожном коли-, честве образует ионы СОз-:
Н2С03 Н+ + НС03 2Н+ + СОз"
Константа диссоциации угольной кислоты по первой ступени, учитывающая равновесие ионов со всем количеством диоксида углерода в растворе (как в форме С02, так и в виде угольной кислоты), выражается соотношением:
К ==_MM2iL==4 5.10-'
[С02 + Н2СОз] '
Константа диссоциации по второй ступени;
[н;псор 10.»
[НСОз]
Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые; средние соли называются карбонатами, кислые — гидрокарбонатами.
Соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
NaOH + С02 = КаНСОз NaHC03 + NaOH = Na2C03 + Н20 ВаС12 + Na2C03 = BaC03j + 2NaCl
Co слабыми основаниями угольная кислота в большинстве случаев дает только основные соли, примером которых может служить карбонат гидроксомеди (Cu0H)2C03. Встречающийся в природе минерал такого состава называется малахитом.
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение С02 легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением С02. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов, например;
MgC03 = MgO + С02|
СаС03 = СаО + C02f
Гидрокарбонаты щелочных металлов при нагревании переходят в карбонаты;
2NaHC03 = Na2C03 + C02f + Н20
Большинство гидрокарбонатов, а также карбонаты калия, натрия, рубидия, цезия и аммония растворимы в воде; карбонаты других металлов в воде нерастворимы.
Растворы карбонатов щелочных металлов вследствие гидролиза имеют сильнощелочную реакцию
Na2C03 + H20 =?=fc NaHC03 -f NaOH
или
COf- + H20 3?=fc НСОз" + OH"
Из солей угольной кислоты в природе чрезвычайно распространен карбонат кальция СаС03. Он встречается в виде известняка, мела, мрамора.
Карбонат кальция нерастворим в воде. Поэтому известковая вода (раствор гидроксида кальция) при пропускании через нее диоксида углерода мутнеет:
Са(ОН)2 + С02 = СаСОз! + Н20
Однако, если пропускать С02 через известковую воду долгое время, то мутная вначале жидкость постепенно светлеет и наконец становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли — гидрокарбоната кальция: СаСОз + Н20 + С02 = Са(НС03)2
Гидрокарбонат кальция — вещество непрочное. При кипячении раствора или продолжительном его стоянии на воздухе гидрокарбонат разлагается с выделением С02 и образованием средней соли.
Растворимостью гидрокарбонатов в воде объясняется постоянное передвижение карбонатов в природе. Почзенные и грунтовые воды, содержащие С02, просачиваясь сквозь почву и особенно сквозь пласты известняка, растворяют карбонат кальция и уносят его с собой в виде гидрокарбоната в ручьи, реки и моря. Оттуда он попадает в организмы морских животных и идет на построение их скелетов или, выделяя диоксид углерода, снова превращается в карбонат кальция и отлагается в виде пластов.
Кроме карбоната кальция, в природе встречается в больших количествах карбонат магния MgC03, известный под названием магнезита. Карбонат магния, как и карбонат кальция, легко растворяется в воде, содержащей С02, переходя в растворимый гидрокарбонат.
Некоторые карбонаты являются ценными рудами и служат для получения металлов (например, шпатовый железняк FeC03, галмей ZnCOa).
Карбонат натрия, или сода, Na2C03. В виде кристаллогидрата сода отвечает формуле Na2C03 • ЮН20. Однако этот кристаллогидрат легко выветривается — теряет часть кристаллизационной воды.
Сода — один из главных продуктов основной химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, а также служит для получения различных солей натрия. Применяется сода и в быту, главным образом как моющее средство.
В настоящее время соду получают в промышленности а м м и - а ч н о - х л о р и д н ы м способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе.
Концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка. При взаимодействии аммиака,
диоксида углерода и воды образуется гидрокарбонат аммония NH3 + С02 + Н20 = NH4HCO3
который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
NH4HCO3 + NaCl = NaHC03| + NH4C1
Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь поступающий в производство:
2NaHC03 = Na2C03 + C02f + Н20
Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак
2!\Н4С1 + Са(ОН)2 = 2NH3| + СаС12 + 2Н20
который также возвращается в производство.
Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение.
Полученный по аммначно-хлоридному способу карбонат натрия не содержит кристаллизационой воды и называется кальцинированной содой.
Часть гидрокарбоната натрия используется без дальнейшей переработки. Например, под названием питьевой, или двууглекислой, соды он применяется в медицине, в хлебопечении, в пищевой промышленности.
Производство кальцинированной соды в СССР непрерывно растет. В 1957 г. оно составило 1,6 млн. т, примерно втрое превысив объем производства 1940 г., а в 1985 г. достигло 5,03 млн. т.
Карбонат калия, или поташ, К2СО3 представляет собой белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде. Применяется он для получения мыла, при изготовлении тугоплавкого стекла, в фотографии. Поташ получают действием диоксида углерода на раствор гидроксида калия, образующийся при электролизе раствора хлорида калия: 2 КОН + С02 = К2С03 + Н20
Важное в практическом отношении соединение — карбамид, или мочевина, СО(МН2)г получается взаимодействием диоксида углерода с аммиаком под давлением:
С02 + 2NH3 = CO(NH2)2 + Н20
Этот способ получения карбамида был открыт в 1870 г, А. И. Базаровым.
Карбамид представляет собой белые кристаллы, хорошо растворимые в воде. Он используется в сельском хозяйстве в качестве высококонцентрированного азотного удобрения и как добавка к корму жвачных животных. На основе карбамида получают дешевые пластические массы, так называемые карбамидные пластики. Он служит также исходным материалом для получения многих органических веществ и лекарственных препаратов. Некоторые производные карбамида обладают гербицидными свойствами — они применяются для борьбы с сорняками.
15*3. Оксид углерода(П). Оксид углерода(П), или. монооксид углерода, СО — бесцветный ядовитый газ, конденсирующийся в жидкость только при —192 °С и затвердевающий при — 205 °С. В воде оксид углерода растворим очень мало и не вступает с ней в химическое взаимодействие.
Электронное строение молекулы СО рассмотрено на стр. 143. Как показано на рис. 53, шесть валентных электронов атомов углерода и кислорода размещаются на трех связывающих МО, образуя тройную связь; эта связь характеризуется высокой прочностью (1076 кДж/моль).

|
| н |
Образование тройной связи в молекуле СО можно объяснить и методом ВС. За счет двух неспаренных электронов, имеющихся в каждом из взаимодействующих атомов

|
возникают две ковалентные связи:
| t | |
| Jill и | |
| * | И! |
Как показывает эта схема, одна из орбиталей внешнего электронного слоя атома углерода остается незанятой электронами, так что этот атом может быть акцептором электронной пары. Атом же кислорода сохраняет на одной из р-орбиталей неподеленную электронную пару и обладает, следовательно, электроно-донорными свойствами. В результате образуется еще одна ковалентная связь — донорно-акцепторная:
| t | ||
| п | ||
| * | И* |
В образовавшейся таким образом молекуле каждый из атомов имеет во внешнем слое восемь электронов. Структуру молекулы СО можно изобразить схемой:
С^О
Здесь стрелкой показана связь, образованная по донорно-акцепторному способу.
Реакция образования оксида углерода(II) из простых веществ описывается уравнением:
С + V2O2 = cot
Стандартная энергия Гиббса этой реакции равна — 137 кДж/моль, однако стандартная энергия Гиббса реакции
С + 02 = co2t
гораздо более отрицательна (—394 кДж/моль). Поэтому при невысоких температурах уголь сгорает до С02, а оксид углерода, даже при недостатке кислорода, почти не образуется. Иначе об* стоит дело при повышении температуры. По достижении 400—«500 °С начинает протекать реакция между углем и образовавшимся диоксидом углерода:
С + С02 = 2COt
Эта реакция эндотермична и при 298 К изменение стандартной энергии Гиббса при ее протекании положительно (+120 кДж/моль). Однако в ходе превращения происходит двукратное увеличение числа молекул газа и энтропия системы сильно возрастает, так что энтропийное слагаемое энергии Гиббса имеет отрицательный знак. С увеличением температуры это слагаемое начинает преобладать (по абсолютной величине) над энтальпийным членом, в результате чего изменении энергии Гиббса при протекании реакции становится отрицательным. Уже при 800 °С степень превращения С02 в СО достигает 80%.
Рассмотренная реакция между углеродом и С02, приводящая к образованию монооксида углерода, осуществляется в очень больших масштабах в доменном процессе (см. § 239), а также в газогенераторах (см. § 159).
В лабораториях оксид углерода(II) обычно получают, прибавляя муравьиную кислоту НСООН к нагретой серной кислоте. Последняя отнимает от муравьиной кислоты воду, выделяя оксид углерода (II);
НСООН = cot + н2о
Эта реакция показывает, что оксид углерода (II) можно рас* сматривать как ангидрид муравьиной кислоты. Хотя муравьиная кислота не может быть получена непосредственно из оксида угле* рода (II) и воды, соли ее образуются при взаимодействии едки4 щелочей с оксидом углерода при 150—200 °С;
NaOH + СО = HCOONa
На воздухе оксид углерода горит голубоватым пламенем с вы> делением большого количества теплоты, превращаясь в С02:
2СО + Оа = 2СОа 4- 566 кДж
На солнечном свету или в присутствии активного угля (катализатор) оксид углерода непосредственно соединяется с хлором, образуя чрезвычайно ядовитый газ — фосген:
СО+ С12= СОС12
Фосген — важный промышленный продукт. Он применяется при производстве ряда органических и неорганических веществ, например красителей.
Химические связи в молекулах карбонилов металлов образованы по до- корно-акцепторному способу за счет неспаренных электронных пар молекулы СО и свободных орбиталей возбужденного атома металла. Например, у возбужденного атома железа имеются пять незанятых валентных орбиталей:
 Поэтому молекула карбоннла железа имеет состав, отвечающий формуле Fc(COb.
Поэтому молекула карбоннла железа имеет состав, отвечающий формуле Fc(COb.
|
| Р |
| При повышенной температуре оксид углерода (II) — хороший восстановитель, играющий важную роль в металлургии при восстановлении металлов из их оксидов (см. §§ 192 и 239). Он используется также в качестве газообразного топлива (см. § 159) и входит в число исходных веществ в производстве ряда органических соединений. Оксид углерода(П) очень ядовит и особенно опасен тем, что не имеет запаха; поэтому отравление им может произойти незаметно. Ядовитое действие оксида углерода, известное под названием угара, объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшееся соединение (карбоксигемоглобин) постепенно разрушается, и гемоглобин восстанавливает способность поглощать кислород. |
Оксид углерода (II) соединяется со многими металлами, образуя карбонилы металлов, например карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4. Последние два вещества представляют собой летучие, весьма ядовитые жидкости. Большинство карбонилов металлов — кристаллические вещества. Наибольшее практическое значение имеют карбонилы никеля, кобальта и железа. Они применяются для получения высокочистых металлов (см. § 193), для нанесения металлических покрытий. Кроме того, они служат катализаторами многих важных химических реакций.
157. Соединения углерода с серой и азотом. Из соединений углерода с серой и азотом большое практическое значение имеют сероуглерод CS2 и синильная кислота HCN.
Сероуглерод CS2 получается пропусканием паров серы сквозь слой раскаленного угля. Это бесцветная, сильно преломляющая свет летучая жидкость, кипящая при 46 °С. При долгом хранении сероуглерод желтеет и приобретает неприятный запах.
Сероуглерод ядовит и легко воспла меняется. В нем хорошо растворяются сера, фосфор, иод, различные жиры и смолистые вещества. Сероуглерод используется для борьбы с вредителями растений и для получения вискозы (стр. 480).
Синильная кислота HCN. При высокой температуре, например в электрической дуге, углерод может непосредственно соединяться с азотом, образуя бесцветный ядовитый газ дициан, молекулярная масса которого соответствует формуле C2N2. По своим химическим свойствам дициан имеет некоторое сходство с галогенами. Подобно им, он образует соединение с водородом HCN, обладающее кислотными свойствами и получившее название циановодорода, или синильной кислоты.
Синильная кислота — бесцветная, очень летучая жидкость, кипящая при 26,7 °С и обладающая характерным запахом горького миндаля.
В водном растворе синильная кислота только в незначительной степени диссоциирует на ионы {К — 8- Ю-10).
Синильная кислота ■— сильный яд, действующий смертельно далее в ничтожных дозах (меньше 0,05 г).
Соли синильной кислоты называются цианидами. Из них наибольшее применение имеет цианид калия.
Цианид калия KCN — бесцветные кристаллы, хорошо растсос римые в воде. Цианид калия так же ядовит, как и синильная кис* лота. На воздухе под действием С02 он довольно быстро разлагается, выделяя синильную кислоту и превращаясь в карбонат:
2K.CN + Н20 + С02 = К2С03 + 2HCN
Как соль очень слабой кислоты, цианид калия в воде в сильной степени подвергается гидролизу:
CN~ + H20 HCN + OH"
Поэтому раствор цианида калия имеет щелочную реакцию й сильно пахнет синильной кислотой. Аналогичными свойствами обладает и цианид натрия.
Цианиды калия и натрия способны растворять в присутствии кислорода воздуха золото и серебро. На этом основано их приранение для извлечения этих металлов из руд (см. § 202). Кроме того, они используются в органическом синтезе, при гальваничеч ском золочении и серебрении.
158. Топливо и его виды. Нефть, природный газ, каменный уголь, а также многие соединения углерода играют важнейшую роль в современной жизни как источники получения энергии. При сгорании угля и углеродсодержащих соединений выделяется теплота, которая используется для производственных процессов, отопления, приготовления пищи. Большая же часть получаемой теплоты превращается в другие виды энергии и затрачивается на совершение механической работы.
К основным видам топлива относятся ископаемый уголь, торф, дрова, нефть и природный газ.
Ископаемый уголь используется как непосредственно для сжигания, так и для переработки в более ценные виды топлива —■ кокс, жидкое горючее, газообразное топливо.
В царской России добыча угля не удовлетворяла потребностей даже слабо развитой промышленности, и каменный уголь дополнительно ввозился из-за границы. Единственным поставщиком угля для всей страны был тогда Донбасс.
После Октябрьской революции в угольной промышленности произошли огромные изменения. Освоены новые угольные бассейны: в Средней Азии, на Кавказе, в Восточной Сибири. Начата разработка каменного угля и в ряде других районов страны. В 1940 г. в Советском Союзе, было добыто угля 166 млн. т, в 1954 г.— 347 млн. т, а в 1985 — 726 млн. т. Однако доля угля в общем производстве топлива все время снижается за счет увеличения доли нефти и природного газа.
Ископаемый уголь представляет собой остатки древнего растительного мира. Чем старше уголь, тем богаче он углеродом.
Различают три главных вида ископаемых углей.
Антрацит — самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит в среднем 95% углерода. В общих запасах углей СССР он составляет около 5,5%.
Каменный уголь содержит 75—90% углерода. Из всех ископаемых углей находит самое широкое применение.
Бурый уголь содержит 65—70% углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей, часто сохраняет следы структуры дерева, из которого он образовался. Бурый уголь отличается большой гигроскопичностью и высокой зольностью (от 7 до 38%), поэтому используется только как местное топливо и как сырье для химической переработки. В частности, путем его гидрогенизации получают ценные виды жидкого топлива — бензин и керосин.
Торф — продукт первой стадии образования ископаемых углей. Он отлагается на дне болот из отмирающих частей болотных Мхов. По разведанным запасам торфа СССР — самая богатая страна в мире. Содержание углерода в торфе составляет 55—60 %.;Главный недостаток торфа для топлива — высокая зольность. Он используется как местное топливо,
При сухой перегонке торфа получают некоторые ценные химические продукты, а также торфяной кокс, содержащий очень мало серы, что позволяет применять его для выплавки высококачественного чугуна.
Дрова занимают второстепенное место в общем балансе топлива. В последние годы их применение в промышленности непрерывно уменьшается.
Нефть как топливо получила широкое применение с тех пор, как в конце XIX века был изобретен двигатель внутреннего сгорания, работающий на продуктах переработки нефти.
Однако нефть — не только удобное и высококалорийное топливо, но и важнейший вид сырья для производства самых разнообразных химических продуктов (синтетических спиртов, моющих средств, каучукоподобных материалов* растворителей и др.). Широко используют в качестве сырья для химической промышленности также попутные газы нефтедобычи и газы нефтепереработки. Добыча нефти в СССР возрастает из года в год:
Годы Млн. т Годы Млн. т
1913 10,3 1954 59,3
1940 31,1 1985 595 (включая газовый конденсат)
Природный газ, состоящий из метана и других предельных углеводородов, — весьма дешевое и удобное топливо. Значение природного газа видно хотя бы из того, что за 25 лет (1937—■ 1962 гг.) его добыча в капиталистических странах увеличилась почти в 6 раз.
В нашей стране использование природного газа началось практически только в послевоенные годы. Мощные месторождения природного газа были открыты в Украинской ССР, Краснодарском крае, Средней Азии и в ряде районов Сибири. В настоящее время построено много магистральных газопроводов большой протяженности. Они связывают источники добычи природного газа с районами его промышленного и бытового потребления.
Газовая промышленность относится к числу наиболее быстро развивающихся отраслей нашей тяжелой индустрии. Темпы ее роста характеризуются размерами добычи природного газа и получения газа путем переработки угля и сланцев. Общее количество полученного в нашей стране газа составило:
Годы Млрд. м3 Годы Млрд. м3
1913 0,02 1955 10,4
1940 3,2 1985 643
Будучи прекрасным топливом, природный газ является в то же время иключительно ценным и экономически выгодным сырьем для промышленности органического синтеза. На базе природного газа в нашей стране построен ряд новых химических заводов;
осуществляется также перевод на этот вид сырья действующих химических предприятий.
Одинаковые количества топлива дают при сжигании различные количества теплоты. Поэтому для оценки качества топлива определяют его теплотворную способность, т. е. количество теплоты, выделяющейся при полном сгорании 1 кг топлива.
Приведем примерные значения теплотворной способности (в кДж/кг) различных видов топлива:
Дерево сухое 19 000 Антрацит 34 000
Торф сухой 23 000 Древесный уголь 34 000
Бурый уголь 28 000 Нефть 44 000
Каменный уголь 35 000 Природный газ 50 000
159. Газообразное топливо. По величине теплотворной способности все виды твердого топлива и нефть уступают природному газу. Высокая калорийность газообразного топлива обусловлена тем, что при его сгорании не затрачивается энергия на разрыв связей между атомами углерода, как в твердом топливе или в больших молекулах углеводородов нефти. Кроме того, газообразное топливо полностью смешивается с воздухом, так что при его сжигании требуется лишь очень небольшой избыток кислорода по сравнению с теоретической величиной. Это снижает потери теплоты на нагрев избытка кислорода (воздуха). Газ можно предварительно нагревать, благодаря чему повышается температура пламени. Его удобно транспортировать на большие расстояния, пользуясь газопроводами.
К важнейшим видам газообразного топлива относятся: природный газ (см. § 158), генераторные газы, коксовый газ.
Генераторные газы получают из твердого топлива путем частичного окисления содержащегося в нем углерода при высокой температуре. Этот процесс называется газификацией твердого топлива. Он осуществляется в специальных устройствах — газогенераторах, представляющих собой вертикальную шахту, в которую сверху загружают топливо, а снизу вдувают воздух, кислород, водяной пар или смеси этих веществ. В зависимости от состава вдуваемых газов различают воздушный, водяной, паровоздушный (смешанный) и другие генераторные газы.
Воздушный газ получают при вдувании воздуха. В нижней части генератора протекает реакция:
С + 02 = С02 + 393,5 кДж
Вследствие большого количества выделяющейся теплоты, температура достигает 1400—1600 °С, вышележащие слои угля раскаляются и уголь взаимодействует с С02:
С + С02 = 2СО - 172 кДж
Получающийся газ в основном состоит из оксида углерода (II) и азота,
Паровоздушный (смешанный) газ получают при вдувании смеси воздуха с водяным паром. В этом случае одновременно с вышеприведенными реакциями происходит взаимодействие углерода с водяным паром:
С + Н20 = СО + Н2
Таким образом, в состав смешанного газа, кроме оксида углерода (II) и азота, входит водород, что повышает его теплотворную способность. Смешанный газ применяется в промышленности в качестве топлива. Он самый распространенный и дешевый из всех искусственных горючих газов.
Водяной газ получают при подаче на раскаленный уголь водяного пара. Газ содержит до 86% СО и Н2 и используется не в качестве горючего, а для синтеза химических продуктов.
Коксовым газом называется газ, получаемый нагреванием каменного угля до 900—1100°С без доступа воздуха. Этот газ в чистом виде или в смеси с природным газом используется в качестве, топлива для нагревания мартеновских печей, печей стекольной я керамической промышленности, а также в коммунальном хозяйстве. Кроме того, коксовый газ служит сырьем при синтезе химических продуктов.
Коксовый газ представляет собой смесь различных горючих газов. Состав его зависит от исходного материала, но в среднем выражается следующими числами [в % (об.)]:
Водород 59 Оксид углерода(II) 6
Метан 25 Бесполезные примеси 7
Другие углеводороды 3 (С02, N2, 02)
Подземная газификация угля. Превращение угля в газообразное топливо может быть осуществлено путем газификации угля непосредственно в местах залегания (под землей). Впервые мысль о возможности такого процесса была высказана Менделеевым в 1888 г.
Дата добавления: 2015-08-21; просмотров: 496 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| СЕРА, СЕЛЕН, ТЕЛЛУР 3 страница | | | OR XOR' \С1 R—С—О—С—R |