
|
Читайте также: |
I I
и н
Поскольку в молекуле бензола три электронные пары являются обшлми для всех шести атомов углерода бензольного кольца, образуемые ими езязн — шесгицептровые (см. § 44),
168. Галогенпроизводкые углеводородов. Галогенпроизводиыми называют соединения, которые можно рассматривать как продукты замещения одного или нескольких атомов водорода в молекуле углеводорода атомами галогенов. Ниже приведены примеры соединений этого класса.
Метилендихлорид СН2С12 (хлористый метилен, дихлорметан) — жидкость (темп, кип, 40,1 "С); применяется как растворитель.
1Хлороформ СНС13 (трихлор метан) — жидкость (темп. кип. 61,2 °С); применяется для наркоза при хирургических операциях и как растворитель.
Четыреххлористый углерод ССЦ (тетрахлорметан)"—тяжелая негорючая жидкость (темп. кип. 76,8 °С); применяется как растворитель при извлечении жиров и масел из растений, для удаления Жировых пятен с тканей, в огнетушителях.
Дифтордихлорметан CF2Cl2 (фреон-12)—жидкость с температурой кипения 29,8 °С, Не ядовит, не реагирует при комнатной Температуре с металлами. При его испарении поглощается большое количество теплоты. Применяется (как и другие фреоны —,Ьолифторхлоруглеводороды) в холодильных устройствах, а также как растворитель для образования аэрозолей.
; Винилхлорид CHj=CH—С1 (хлористый винил) — производное этилена. Бесцветный газ. Получается присоединением хлороводорода к ацетилену. Легко полимеризуется, применяется для получения поливинилхлорида (стр. 486).
Тетрафторэтилен CF2=CF2 — бесцветный газ. Получается пиролизом фреона-22 (CHF2C1). Применяется для получения фторопласта (стр. 486).
Некоторые галогенпроизводные углеводородов входят в состав ядохимикатов[113] — химических средств для борьбы с вредными Насекомыми (инсектициды) и грибками, поражающими растения (фунгициды).
169. Спирты и фенолы. Спирты — производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода заменены гидроксильными группами[114]. Так, метиловый спирт (метанол) СН3—ОН представляет собой гидроксильное производное метана СН4, этиловый спирт (этанол) СН3—СН2—ОН — производное этана СН3—СН3. Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами. Так, фенол СбНб—ОН (или
■у —он^ — производное бензола С6Н6 — простейший представитель класса фенолов.
Подобно молекулам воды (см. § 70), молекулы низших спиртов связываются между собой водородными связями. Поэтому они представляют собой ассоциированные жидкости и имеют более высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие органические вещества с таким же составом и молекулярной массой, но не содержащие гидр- оксильных групп. Фенолы при обычных условиях находятся, как правило, в кристаллическом состоянии.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. Так, при действии на спирт щелочного металла этот водород вытесняется металлом и получаются твердые, растворимые в спирте соединения, называемые а л к о - гол ят а ми, например:
2СН3—СН2—ОН + 2Na —v 2СН3—СН2—ONa + H2f
этиловый сплрт алкоголят
(этилат) натрия
Формально такая реакция напоминает образование солей из кислот, однако алкоголяты подобны солям очень слабых кислот и нацело гидролизуются водой; при этом снова образуются спирт и щелочь:
СН3—СН2—ONa + Н20 —» СН3—СН2—ОН + NaOH
Поэтому при взаимодействии спиртов с водными растворами щелочей алкоголяты не образуются.
В фенолах под влиянием ароматического бензольного ядра подвижность водорода гидроксильной группы выше. Они образуют металлические производные — феноляты — не только при действии щелочных металлов, но, в отличие от спиртов, и при действии щелочей:
{^У------------ ОН-f NaOH —v \ —0Na + H*°
фенол фенолят натрия
Феноляты в отличие от алкоголятов водой не разлагаются, но все же и они в водных растворах, подобно солям слабых кислот и сильных оснований, частично гидролизоваиы и их растворы имеют щелочную реакцию. Фенол вытесняется из фенолята даже угольной кислотой.
Спирты практически не являются электролитами. Константа диссоциации этилового спирта близка к Ю-18, тогда как константа диссоциации воды — к 10~16, т. е. этиловый спирт является более слабой кислотой, чем вода. Константа диссоциации фенола несколько выше (1,3-Ю-10).
Спирты и фенолы взаимодействуют с кислотами, образуя сложные эфиры, например
сн3—о—Н +НО:—N02 СН,—О—N02 + Н20
метиловый азотная метиловый эфир
спирт кислота азотной кислоты
(метилнитрат)
Особый интерес представляют сложные эфнры спиртов и фенолов с органическими кислотами (см. § 173).
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды или кетоны (см. § 171).
Метиловый спирт, или метанол, СН3ОН — бесцветная жидкость (темп. кип. 64,5 °С). Весьма ядовит-, прием небольших доз его внутрь вызывает слепоту, а больших —• смерть. Метиловый спирт получают в больших количествах синтезом из оксида углерода (И) и водорода при высоком давлении (20—30 МПа) и высокой температуре (400°С) в присутствии катализатора (около 90 % ZnO и*Ю%Сг20з):
СО + 2Н2 СНзОН
Метиловый спирт образуется и при сухой перегонке дерева; поэтому его называют также древесным спиртом. Применяется он как растворитель, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, СН3СН2ОН (темп. кип. 78,4 °С)—одно из важнейших исходных веществ в современной промышленности органического синтеза. Для получения его издавна пользуются различными сахаристыми веществами, например виноградным сахаром, или глюкозой, которая путем «брожения», вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт. Реакция протекает согласно схеме:
С6Н12О0 —> 2С2Н5ОН + 2С02|
глюкоза этиловый
спирт
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %.
Исходным продуктом для получения спирта может служить полисахарид крахмал (стр. 478), содержащийся, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. Для этого муку или измельченный картофель заваривают горячей водой и по охлаждении добавляют солод—■ проросшие, а затем подсушенные и растертые с водой зерна ячменя. В солоде содержится диастаз (сложная смесь ферментов), действующий на процесс осахаривания крахмала каталитически. По окончании осахаривания к полученной жидкости прибавляют дрожжи, под действием фермента которых (зимазы) образуется спирт. Его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергают также другой полисахарид — целлюлозу (клетчатку), образующую главную массу древесины, Для этого целлюлозу подвергают гидролизу в присутствии кислот (например, древесные опилки при 150—170 ""С обрабатывают 0,1—5% серной кислотой под давлением 0,7— 1,5 МПа). Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей (гидролизный спирт).
Наконец, этиловый спирт может быть получен синтетическим путем из этилена. Суммарная реакция заключается в присоединении воды к этилену (в присутствии катализаторов);
СН2=СН2 + Н20 —> СНз—сн2—ОН
За последние годы в нашей стране построены заводы по производству синтетического этилового спирта из этилена и увеличилась выработка спирта из древесины. Это дало возможность сэкономить большое количество пищевых продуктов [115].
Кроме спиртов с одной гидроксильной группой в молекуле (одноатомные спирты, или а л кого л и), известны спирты, молекулы которых содержат несколько гкдроксильных групп (многоатомные спирты).
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трехатомный — глицерин:
СН2—СН2 СНа-СН—СН2
! I II!
ОН ОН ОН ОН ОН
этиленгликоль глицерин
Этиленгликоль и глицерин—• высококипящие жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этиленгликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58 %-ный) замерзает только при температуре —50°С. Этиленгликоль применяется и для изготовления синтетического волокна лавсан (см. § 177). При приеме внутрь — сильно ядовит.
Азотнокислые эфиры этиленгликоля и глицерина
СН2—СНз СН2—СН—СН2
0N02 0N02 h ОХ'Ог 0Х02 0N02
неправильно называемые нитроэтиленгликолем и нитроглицерином, обладают сильными взрывчатыми свойствами и применяются для изготовления динамитов.
Фенол С6Н5ОН — бесцветные кристаллы (темп, плавл. 41 °С), Обладает характерным запахом и антисептическими (обеззараживающими— подавляющими развитие вредных микроорганизмов) свойствами. Как уже указывалось, кислотные свойства гидрофильного водорода выражены у фенола значительно сильнее, чем у спиртов; замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей. Поэтому фенол называют также карболовой кислотой.
Фенол содержится в каменноугольной смоле, а также получается синтетически из бензола. В больших количествах он идет на синтез лекарственных веществ, красителей, пластических масс (фенопластов, стр. 489), для очистки нефтяных смазочных масел.
170. Простые эфиры. Простыми эфирами называются органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных атомом кислорода. Они получаются обычно каталитическим отнятием молекулы воды от двух молекул одного или различных спиртов. Например:
CgHs-gOH + HjO-QHs —> С2Н6-0-С2Н6 + Н20
этиловый этиловый диэтпловый эфир
спирт спирт
СНз—; он + н ю—<с2н5 —> сн3—о—с2н5 + Н20
метиловый этиловый метилэтнлОЕЫЙ
спирт спирт эфир
Большинство простых эфиров •— жидкости, почти нерастворимые в воде. Они довольно инертны в химическом отношении: в отличие от спиртов не имеют подвижного водорода, поэтому не реагируют с металлическим натрием; в отличие от сложных эфиров (см. § 173) не подвергаются гидролизу. Наиболее важным из простых эфиров является диэтиловый эфир (С2Н5) 20 — легкоподвижная жидкость с характерным запахом, кипящая при 35,6°С. Он широко применяется как растворитель, а в медицине — для наркоза и как составная часть некоторых лекарств.
171. Альдегиды и кетоны. В молекулах этих соединений содержится двухвалентная к а р б о н и л ь н а я г р у п п а ^С — О. В альдегидах она связана с одним атомом Н и с углеводородным радикалом [116], в кетонах — с двумя углеводородными радикалами:
н-с(снз-с;
N-i mi
муравьиный уксусный
альдегид альдегид
(формальдегид) (ацетальдегид)
СНзч СН,Х
^С=0 ХС=0
сн/ СНз—сн/
диметилкетон метнлэтилкетон (ацетон)
Наличие и в альдегидах, и в кетонах карбонильной группы обусловливает определенное сходство их свойств. Однако имеются и различия, связанные с тем, что в молекулах альдегидов одна из связей карбонильной группы затрачивается на соединение с водородом; поэтому они содержат своеобразную альдегидную
функциональную группу —с. (или —СН = 0). За счет водо-
рода этой группы альдегиды очень легко окисляются, превращаясь в карбоновые кислоты (см. § 172). Так, при окислении уксусного альдегида образуется уксусная кислота, которую широко используют в промышленности и быту:
2СН3—С^ +02 —> 2СН3—<Г ■
ХН Ч)Н
уксусный уксусная
альдегид кислота
Вследствие легкой окисляемости альдегиды являются энергичными восстановителями; этим они существенно отличаются от кетонов, которые окисляются значительно труднее. Например, альдегиды восстанавливают оксид серебра(I) до металлического серебра (реакция серебряного зеркала — серебро осаждается на стенках сосуда, образуя зеркальный налет) и оксид Меди(II) до оксида меди(1) [117]:
СНЭ—с' +Ag20 —* СНз—СГ +2Ag
ХОН
СНз—с; +2СиО —► СНз—С^ +Cu20 ЧН Ч)Н
Кетоны в этих условиях не окисляются, поэтому обе реакции используют как качественные, позволяющие отличить альдегиды от кетонов.
Альдегиды и кетоны можно получать окислением соответствующих спиртов, т. е. имеющих такой же углеродный скелет и гидроксильную группу при том же атоме углерода, который в получаемом альдегиде или кетоне образует карбонильную группу»' Например*
ЗСНз—CH20H + K2Cr207 + 4H2S04 —>
этиловый спирт
—> ЗСНв—с; + Cr2(S04)3 + K2S04 + 7Н20 \Н
уксусный альдегид
5СН3—СН— CH3 + 2KMn04 + 3HoS04 —> I
ОН
изопропиловый спирт
—»■ 5СНз—С—СНз + 2MnS04 + K:S04 + SH20
диметилкетон (ацетон)
Муравьиный альдегид, или формальдегид, СН2=0 — газ с рез^ ким неприятным запахом, хорошо растворим в воде. Обладает антисептическими, а также дубящими свойствами. Водный раствор формальдегида (обычно 40 %) называется формалином-, он широко применяется для дезинфекции, консервирования анатомических препаратов, протравливания семян перед посевом и т. п. Значив тельные количества формальдегида используются для получения фенолоформальдегидных смол (см. § 177). Получают формальдегид из метилового спирта путем каталитического окисления его кислородом воздуха или путем дегидрирования (отщепления водорода);
2СН3—ОН + 02 —V 2СН,=0 + 2Н20 СНз—ОН —СН2=0 + Н2
Эти реакции протекают при пропускании паров метилового спирта (в первом случае — в смеси с воздухом) над нагретыми катализаторами.
Уксусный альдегид, или ацетальдегид, СН3—СН=0. Легко кипящая бесцветная жидкость (темп. кип. 21 °С), с характерным запахом прелых яблок, хорошо растворима в воде. В промышленности получается присоединением воды к ацетилену в присутствии Солей ртути(II) в качестве катализатора:
Hg2+
сн=сн + н2о --------------- СНз—СН=0
ацетилен уксусный
альдегид
Эта реакция, имеющая большое практическое значение, была открыта М, Г. Кучеровым (1850—1911)_, Уксусный альдегид затем может быть окислен в уксусную кислоту; его используют и для многих других синтезов.
Ацетон, или диметилкетон, СН3—СО—СН3. Бесцветная жидкость с характерным запахом (темп. кип. 56,2 °С); смешивается с водой во всех соотношениях. Очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небьющегося органического стекла, кинопленки, бездымного пороха, для растворения ацетилена (в баллонах).
Ацетон используется также как исходное вещество для синтеза ряда органических соединений.
172. Карбоновые кислоты. Эти соединения характеризуются присутствием в молекулах карбоксильной группы (карб-
оксида) —с., или упрощенно —СООН, которая является
функциональной (характеристической) группой этого класса соединений. Примерами кислот могут служить:
н—с; снз-с; снз-снз—(г
Х)Н Х)Н хон
г,:уравышая уксусная Пропионовая
кислота кислота кислота
Из приведенных формул видно, что сложная карбоксильная
-
группа является сочетанием карбонильной—С^ и гидроксильной
—ОН групп. Последняя под влиянием карбонильной группы существенно отличается от гидроксильной группы спиртов, и входящий в нее водород в водных растворах отщепляется в виде катиона; карбоновые кислоты подвергаются электролитической диссоциации, например:
СНз—СООН СНз—СОО~ + Н*
С основаниями эти кислоты образуют соли:
СНз—СООН + NaOH —>■ СН3—COONaН20
ацетат натрия (уксуснокислый натрий)
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимому гидролизу. В зависимости от числа карбоксильных групп в молекуле, карбоновые кислоты подразделяются на одноосновные, двухосновные и т. д.
Карбоновые кислоты, как и неорганические кислоты, со спиртами образуют сложные эфиры (см. § 173), в виде которых часто рстречаются в природных продуктах.
Уксусная кислота СНз—СООН (безводная) — жидкость с острым радражающим запахом (темп. кип. 118,1 °С); при +16,7°С застывает в кристаллическую массу, по виду напоминающую лед (100%-ная, или «ледяная» уксусная кислота). Смешивается с водой в любых соотношениях. Широко применяется как приправа к пище и консервирующее средство. В продажу поступает пище- вая уксусная кислота в виде 80% (уксусная эссенция) и 9% (уксус) водного раствора. Давно известен натуральный, или винный, уксус — продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина (в результате микробиологического окисления содержащегося в вине этилового спирта). Уксусная кислота используется также во многих синтезах и как растворитель. Теперь и пищевую и техническую уксусную кислоту получают преимущественно синтезом из ацетилена — присоединением к нему воды по реакции Кучерова и окислением образующегося уксусного альдегида.
Высшие окирные кислоты. К ним относятся предельные и непредельные карбоновые кислоты с открытой цепыо атомов углерода, содержащие 16, 18 и более С-атомов; такого рода кислоты входят в состав природных жиров (см. § 173). Важнейшими являются предельные кислоты пальмитиновая С15Н31СООН, или СНз(СН2)нСООН, и стеариновая Ci7H35COOH, или СН3(СН2) 16СООН, а также непредельная Ci7H33COOH, или СН3 (СН2) 7СН=СН (СН2) 7СООН — олеиновая кислота. Высшие предельные кислоты — воскообразные вещества, непредельные — Жидкости (напоминающие растительное масло). Натриевые и калиевые соли высших жирных кислот называются мылами (например, Ci7H35COONa — стеарат натрия, С15Н31СООК — паль- митат калия и т. д.). Натриевые мыла — твердые, калиевые—■ жидкие.
Бензойная кислота C6Hs—СООН, или ^ ^—СООН, простейшая одноосновная кислота ароматического ряда. Бесцветные кристаллы (пластинки) (темп, плавл. 121,5 °С). Антисептик. Применяется для консервирования пищевых продуктов, а также во многих органических синтезах.
Щавелевая кислота НООС—СООН — простейшая двухосновная карбоновая кислота. Кристаллическое вещество (безводная — темп, плавл. 189°С; дигидрат С2Н20,г2Н20 — темп, плавл. 101,5°С); растворяется в воде; ядовита. В виде кислой калиевой соли содержится во многих растениях. Применяется при крашении тканей.
Терефталевая кислота НООС—С6Н4—СООН. Двухосновная карбоновая кислота ароматического ряда. Ее структурная формула;
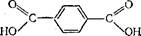
|
Из терефталевой кислоты и этилеигликоля (см. § 169) получают синтетическое волокно лавсан (см. § 177).
Молочная кислота сн3—СН—СООН может служить примером
I
ОН
соединений со смешанными функциями — проявляет свойства кислоты и спирта (спиртокислота). Она образуется при молочнокислом брожении сахаристых веществ, вызываемом особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота НО—СбН4—СООН — аналог молочной кислоты в ароматическом ряду. Имеет строение:
/ОН „
ХОН
Относится к соединениям со смешанными функциями — проявляет свойства кислоты и фенола (фенолокислота). Антисептик. Используется (особенно ее соли и эфиры) как лекарственное вещество, а также во многих синтезах.
173. Сложные эфиры карбоновых кислот. Жиры. Продукты взаимодействия карбоновых кислот со спиртами или фенолами представляют собой сложные эфиры. Например:
о
н—с' + Н20 ХОС2Н6
| н-с; |
| о—с2н5 |
| +1 н |
| он |
| этиловый спирт |
| муравьиная кислота |
этиловый эфир муравьиной кислоты (этилформиат)
V0
| :0 |
| СНз |
| + Н20 |
| 0- |
| +;Н |
| X |
| ОН |
N>
| фениловый эфир уксусной кислоты (фенилацетат) |
| фенол |
| уксусная кислота |
Реакция образования сложного эфира из кислоты и спирта (или фенола) называется реакцией этерификации. Она катализируется ионами водорода и поэтому ускоряется в присутствий минеральных кислот.
Сложные эфиры нерастворимы (или почти нерастворимы) в воде, но растворяются в органических растворителях. Растворы их не проводят электрического тока.
Сложные эфиры, в отличие от простых, с большей или меньшей скоростью расщепляются водой — подвергаются гидролизу с образованием вновь кислоты и спирта. Поэтому, как показанй в схемах приведенных выше реакций, процесс этерификации обратим и доходит до состояния динамического равновесия. Ионы
водорода, как и всякий катализатор (см. § 60), ускоряют протекание не только реакции этерификации, но и обратной ей реакции гидролиза; таким образом в присутствии минеральной кислоты быстрее достигается равновесие в процессе этерификации.
Гидролиз сложных эфиров усиливается гидроксид-ионами. При нагревании со щелочами сложные эфиры расщепляются с образованием спирта и соли кислоты:

|
| СН3-С( ХОС2Н5 |
| ацетат натрия (уксуснокислый натрий) |
| этилозый эфир уксусной кислоты (этилацетат) |
+ с2н5он
Реакция щелочного гидролиза сложных эфиров называется ре- акцией о м ы л е н и я.
Многие сложные эфиры карбоновых кислот и предельных спиртов имеют приятный запах и часто встречаются в растениях, придавая аромат цветам, запах плодам и ягодам. Некоторые из сложных зфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии. Уксусноизоамило- вый эфир СН3СООС5Н11 (грушевая эссенция) применяется как растворитель целлулоида и других пластмасс.
Жиры. Природные животные и растительные жиры (последние обычно называют маслами) представляют собой смеси сложных эфиров, образованных высшими жирными кислотами (см. § 172)' и трехатомным спиртом глицерином. Приведем схему образования эфира глицерина и стеариновой кислоты:
СН2—0!Н..... Hol—СО—С17н35 СН2—О—СО—Ci7H35
I I i 1
СН—OIH + НО:—со— С17Н35 —> СН—О—СО—С17Н35+ зн2о
I [ I I
СН2—Oj H Ш|—СО—С17Н35 СН2—О-СО—Ci7H35
В состав твердых жиров входят главным образом эфиры предельных (пальмитиновой и стеариновой) кислот, а в состав жидких растительных масел — эфиры непредельной (олеиновой) кислоты. При действии водорода (в присутствии никеля. в качестве катализатора) жидкие жиры превращаются в твердые вследствие присоединения водорода по месту двойной связи между атомами углерода в этерифицированных молекулах непредельной кислоты. Такой процесс называют гидрогенизацией, или отверждением жиров и используют, например, для получения из растительных масел пищевого маргарина.
Как и все сложные эфиры, жиры подвергаются гидролизу (омылению), Гидролиз жиров, сам по себе медленный, катализируется сильными кислотами и ферментами, образующимися в живых организмах, Щелочи также способствуют гидролизу жиров.
При гидролизе жира в нейтральной или кислой среде получаются глицерин и указанные выше кислоты, при гидролизе я^е в щелочной среде вместо свободных кислот получаются их соли — мыла (см. § 172),
В состав некоторых масел, например льняного масла, входят эфиры глицерина и непредельных высших кислот, в молекулах которых имеется по две и по три двойных связи («высоконепредельные» или «полиненасыщенные» жирные кислоты). Такие масла обладают свойством окисляться на воздухе и, будучи нанесены на какую-нибудь поверхность, образуют твердые и прочные пленки. Они называются высыхающими маслами. Чтобы ускорить процесс высыхания, масла предварительно варят с добавкой сиккативов— оксидов металлов (кобальта, марганца или свинца)\ являющихся катализаторами в процессе пленкообразования. Таким образом, получают олифу, применяемую для изготовления масляных красок.
Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части пищевого рациона человека и животных, наряду с углеводами (см, § 174) и белками (см. § 176). Прекращение использования пищевых жиров в технике и замена их непищевыми материалами —1 одна из важнейших задач народного хозяйства.
174. Углеводы. К углеводам относятся сахара и вещества, превращающиеся в них при гидролизе. Углеводы — продукты растительного и животного происхождения. Наряду с белками и жирами, они являются важнейшей составной частью пищи человека и животных; многие из них используются как техническое сырье. Углеводы подразделяют на моносахариды, дисахариды и полисахариды.
Моносахариды — простейшие углеводы, они не подвергаются гидролизу — не расщепляются водой на более простые углеводы.
Глюкоза, или виноградный сахар, СеН^Об— важнейший из моносахаридов; белые кристаллы сладкого вкуса, легко растворяющиеся в воде. Содержится в соке винограда, во многих фруктах, а также в крови животных и человека. Мышечная работа совершается главным образом за счет энергии, выделяющейся при окислении глюкозы.
Глюкоза является шестиатомным альдегидоспиртом; строение ее можно представить формулой (а):

|
| НОСНз— |
| глюкозаа |
| фруктоза б |
Глюкоза получается при гидролизе полисахаридов крахмала и целлюлозы (под действием ферментов или минеральных кислот). Применяется как средство усиленного питания или как лекарственное вещество, при отделке тканей, как восстановитель — в производстве зеркал.
Фруктоза, или плодовый сахар, С6Н1206 — моносахарид, спутник глюкозы во многих плодовых и ягодных соках; значительно слаще глюкозы; в смеси с ней входит в состав меда. Представляет собой шестиатомный кетоноспирт; строение фруктозы выражает приведенная выше формула (б).
Дата добавления: 2015-08-21; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| It. С н ЗК X*. Л1 | | | W С ХН IK с хн 2 страница |