
Читайте также:
|
Общий подход – см.обучающую задачу №1.
Реакция гидролиза галогеноводородов как реакция нуклеофильного замещения может протекать по следующим механизмам.
1. Реакция SN1 – мономолекулярная двухстадийная реакция нуклеофильного замещения; характерна для третичных галогеноалканов, бензил– и аллилгалогенидов.
2. Реакция SN2 – согласованная бимолекулярная одностадийная реакция нуклеофильного замещения; характерна для первичных галогеналканов (или вторичных с небольшими по объему заместителями).
3. SNAr (присоединение-отщепление) – двухстадийная бимолекулярная реакция ароматического нуклеофильного замещения; характерна для арилгалогенидов, содержащих активирующие электроноакцепторные заместители (особенно в о- и п-положениях, проявляющих отрицательный мезомерный эффект), идущая через лимитирующую стадию образования карбаниона (стабилизированного ЭА-заместителем) в результате присоединения нуклеофила с последующим отщеплением уходящей группы.
4. Ариновый механизм нуклеофильного замещения (отщепление-присоединение) – реакция нуклеофильного ароматического замещения, идущая под действием сильных оснований в неводной среде через стадию отщепления галогена с образованием арина с последующим присоединением нуклеофила; характерна для дезактивированных галогенаренов.
Этап 1. Запишем структурные формулы анализируемых соединений. Сравним реакционную способность их с позиций статических факторов.

Реакционным центром каждого соединения является атом углерода, связанный с электроноакцепторным атомом хлора, проявляющим отрицательный индуктивный эффект. Однако степень электрофильности атома углерода в этих соединениях различна.
В соединениях (1) и (2) реакционным центром является sp2––гибридизованный атом бензольного кольца, электронная дефицитность которого понижена вследствие делокализации положительного заряда по бензольному кольцу в результате сопряжения р–электронов атома хлора и p–электронов бензольного кольца.
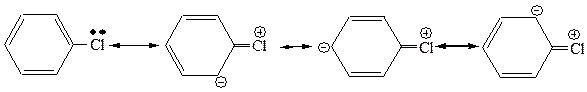
При этом уменьшается полярность связи углерод-галоген, которая имеет характер двоесвязанности, что обуславливает увеличение ее прочности.
Однако в соединении (2) за счет нитрогруппы, проявляющей ЭА–влияние на атом углерода не только по индуктивному, но и мезомерному эффекту, электронная дефицитность реакционного центра повышается.
Таким образом, с позиций статического фактора реакционная способность n-нитробензола должна быть выше, чем хлорбензола.
В соединении (3) реакционным центром является sp3–гибридизованный атом углерода, связанный с sp3–гибридизованным атомом хлора, проявляющим только отрицательный индуктивный эффект, т.е. являющимся более сильным электроноакцептором, чем sp2– гибридизованный атом хлора в соединениях (1) и (2). Кроме того, бензольное кольцо не участвует в делокализации частичного положительного заряда sp3–гибридизованного атома углерода. Поэтому в соединении (3) электрофильность реакционного центра выше, чем в соединениях (1) и (2). Полярность связи Сsp3 –Cl выше.
Таким образом, по реакционной способности с позиций статических факторов анализируемые соединения можно расположить в следующий ряд:
Бензилхлорид>n-нитрохлорбензол>хлорбензол.
Эта закономерность подтверждается экспериментальными данными.

Этап 2. Объяснение реакционной способности с позиций динамического фактора, т.е. с позиций стабильности интермедиата.
Механизм реакции гидролиза n-нитрохлорбензола (SNAr).

Нитрогруппа стабилизирует карбанион по мезомерному механизму.
Механизм реакции гидролиза бензилхлорида (SN1).
Несмотря на то, что бензилхлорид является первичным галогенопроизводным, для него невозможно протекание реакции по механизму SN2, так как бензольное кольцо затрудняет «атаку с тыла». Реакция гидролиза бензилхлорида проходит легко по механизму SN1, так как бензольное кольцо стабилизирует образующийся карбокатион по мезомерному механизму.

Арилгалогениды не реагируют с нуклеофильными реагентами ни по механизму мономолекулярного (SN1), ни по механизму бимолекулярного (SN2) нулеофильного замещения. В первом случае образовался бы гипотетический нестабильный фенилкатион с положительным зарядом на sp2-гибридной орбитали, не участвующей в сопряжении.
 Во втором случае ароматическое кольцо затрудняет «атаку с тыла» и достижение переходного состояния, характерного для реакций SN2.
Во втором случае ароматическое кольцо затрудняет «атаку с тыла» и достижение переходного состояния, характерного для реакций SN2.
Хлорбензол, не имеющий ЭА–заместителей, в реакцию гидролиза вступает в очень жестких условиях. Возможно, в этих условиях реакция проходит по ариновому механизму.

Заключение. С учетом статических и динамических факторов, а также экспериментальных данных рассматриваемые соединения можно расположить в порядке увеличения реакционной способности в реакции гидролиза в следующий ряд: хлорбензол< n-нитрохлобензол<бензилхлорид
Обучающая задача № 4. По какому механизму прошла реакция взаимодействия неопентилового спирта с НBr, если в результате этой реакции получен не неопентилбромид, а 2–метил–2–бромбутан? Как можно получить неопентилбромид, если его нельзя получить из спирта?
Дата добавления: 2015-07-20; просмотров: 1128 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение | | | Решение. |