
|
Читайте также: |
Реакция нуклефильного замещения осуществляется только в том случае, если уходящий анион (нуклеофуг) стабильнее вступающей нуклеофильной частицы.
Сравним нуклеофилы F—, Cl—, Br—. Их стабильность определяется степенью делокализации отрицательного заряда. Чем больше размер аниона, тем более делокализован в нем заряд, тем он стабильнее.
Таким образом, стабильность анионов возрастает в ряду F− <Cl− < Br−. Фторид-ион – нестабильный анион, плохая уходящая группа. Соединения со связью С-F чрезвычайно устойчивы и практически не вступают в реакции нуклефильного замещения.
Наиболее стабильные иодид- и бромид-ионы являются хорошими уходящими группами. Поэтому в качестве субстратов для синтеза чаще всего используются алкилбромиды и алкилиодиды.
Хлор- и бром- анионы стабильнее входящей группы ОН. Поэтому хлор- и бромпроизводные алканов могут вступать в реакцию гидролиза.
Таким образом, в молекуле фторотана гидролитическое расщепление возможно для связей C–Cl и C–Br; связи C–F сохранятся без изменения.
Нуклеофильность реагента.
Нуклеофильность – это способность реагента предоставить свою электронную пару для связи с электрофильным атомом.
Гидролиз галогеналканов проводят кипячением с водой или водным раствором щелочи. Отрицательно заряженные ионы являются более сильными нуклеофилами, чем нейтральные молекулы. Поэтому скорость реакции гидролиза в щелочной среде выше, чем при кипячении с водой.
Электронные эффекты заместителей могут влиять на механизм реакций SN. Реакция гидролиза галогеналканов может проходить по SN1 или SN2- механизмам.
Реакция SN1 – мономолекулярная двухстадийная реакция нуклеофильного замещения, идущая через лимитирующую стадию образования интермедиата –– карбокатиона; характерна для третичных галогеналканов, аллил– и бензилгалогенидов. Наличие ЭД-заместителей, понижающих электрофильность реакционного центра и, следовательно, затрудняющих взаимодействие его с нуклеофильным реагентом, способствует протеканию реакции по SN1 – механизму. Кроме того, наличие трех заместителей у реакционного центра создает пространственное затруднение для атаки реакционного центра, но способствует диссоциации связи и образованию сравнительно стабильного третичного карбокатиона.
Реакция SN2 – согласованная одностадийная бимолекулярная реакция нуклеофильного замещения, идущая через переходное состояние (образование активированного комплекса), скорость которой зависит от концентрации субстрата и реагента; характерна для первичных галогеналканов и вторичных с небольшими по объему заместителями. Наличие ЭА-заместителей, повышающих электрофильность реакционного центра и взаимодействие с нуклеофильным реагентом, способствует протеканию реакции по SN2-механизму.
Этап 1. Химизм реакции гидролиза фторотана.
В молекуле фторотана из двух электронодефицитных атомов углерода наиболее активным реакционным центром является атом углерода во втором положении, электрофильность которого усилена электроноакцепторным влиянием трех атомов фтора.
Фторотан является геминальным дигалогенопроизводным, при гидролизе которых образуются геминальные диолы. Соединения, содержащие у одного атома углерода несколько электроноакцепторных групп неустойчивы и, согласно правилу Эрленмейера, легко отщепляют одну из этих групп при условии, если она будет сформирована в хорошую уходящую группу в результате внутреннего протонирования.
Гидроксильная группа является электроноакцепторной вследствие высокой электроотрицательности атома кислорода. По этой же причине она является кислотой, протонируя вторую гидроксильную группу, которая легко отщепляется с образованием конечного продукта реакции с альдегидной группой. Так как альдегиды чувствительны к щелочам (см «Реакционная способность альдегидов»), для гидролиза геминальных дигалогенидов рекомендуются не щелочи, а CaCO3.
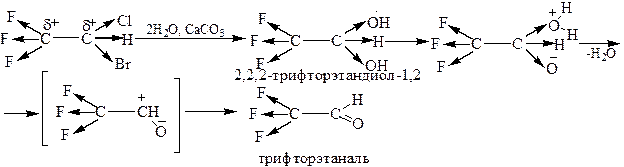
Этап 2. Механизм реакции гидролиза фторотана.
Механизм SN1 маловероятен, так как гипотетический карбокатион дестабилизирован электроноакцепторным влиянием остальных атомов галогена.
Более вероятен SN2 – механизм, которому способствует электроноакцепторное влияние атомов галогена, повышающих электрофильность реакционного центра.
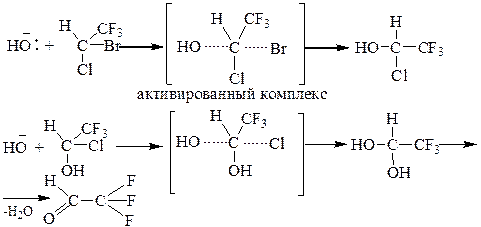
Заключение: 1) при гидролизе фторотана образуется 2,2,2-трифторэтаналь;
2) реакция протекает по SN2 – механизму.
Дата добавления: 2015-07-20; просмотров: 389 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Решение |