
Читайте также:
|
Электрофильной частицей в реакции гидратации является протон  . Так как вода очень слабый донор протона, реакцию следует проводить в присутствии сильной минеральной кислоты, способной предоставить этот протон:
. Так как вода очень слабый донор протона, реакцию следует проводить в присутствии сильной минеральной кислоты, способной предоставить этот протон: 

Карбокатион (2) стабильнее карбокатиона (1), так как его стабилизируют два электродонорных алкильных радикала по индуктивному механизму. Поэтому молекула воды (нуклеофил) преимущественно атакует карбокатион (2) с образованием катиона замещенного оксония (3), который стабилизируется путем депротонирования («выброса» протона).
Таким образом, реакция гидратации осуществляется в присутствии кислотного катализатора, роль которого выполняет серная кислота. Реакция гидробромирования проходит по аналогичному механизму, но без применения кислотного катализатора, так как НВr является сильной кислотой, донором протона.
Этап 3. Получение вещества Е основано на бромировании изобутана при облучении УФ-светом. Реакция бромирования –это введение в молекулу органического соединения атома брома за счет разрыва p-связи (у алкенов, алкинов), t-связи (у циклопропана), либо путем замещения атомов водорода s-углерод-водородной связи (у алкенов и аренов).
Связь С–Н алканов малополярна, так как электроотрицательность атомов водорода и углерода имеют близкие значения. Для таких связей энергетически более выгодным является гомолитический разрыв с образованием высокоактивных частиц с неспаренным электроном – свободных радикалов. Несмотря на то, что энергия связи С–Н (415 кДж) выше энергии связи С–С (347 кДж/моль), она легче подвергается гомолитическому разрыву, чем С–С связь, так как она более доступна для атаки свободным радикалом. Таким образом, бромирование изобутана будет протекать по механизму свободнорадикального замещения (SR). Реакции SR протекают как цепные процессы, включающие три основные стадии: инициирование, рост цепи, обрыв цепи.
На стадии инициирования под воздействием УФ-облучения происходит гомолитический разрыв ковалентной связи. В системе изобутан – бром наименее прочная связь Вr–Br (188 кДж/моль), и именно она разрывается на стадии инициирования с образованием двух свободных радикалов (атомов брома): 
Радикал брома взаимодействует с молекулой алкана, расщепляя связь С–Н с образованием свободного углеводородного радикала Н•, который моментально взаимодействует с радикалом брома, образуя стабильную молекулу бромоводорода. Свободный углеводородный радикал, в свою очередь, взаимодействует с недиссоциированной молекулой брома, образуя бромалкан.
Таким образом, стадия роста цепи характеризуется поочередным появлением неспаренного электрона на реагенте и субстрате.
Параллельно с ростом цепи происходят реакции обрыва цепи, заключающиеся во взаимодействии любых имеющихся в системе радикалов.
Реакция бромирования алканов региоселективна, так как радикал бром обладает высокой избирательностью и атакует преимущественно тот атом углерода, который связан с атомом водорода менее прочной связью (статический фактор) и в результате расщепления которой образуется более стабильный свободный алкильный радикал.
Стабильность свободных алкильных радикалов возрастает в ряду:
первичный<вторичный<третичный.
В молекуле изобутана имеется три равноценных первичных атома углерода в составе метильных групп. Замещение любого из 9-ти равноценных атомов водорода приведет к образованию 1–бром–2–метилпропана с выходом менее 1%. Замещение атома водорода у третичного атома углерода проходит преимущественно с образованием 2–бром––2–метилпропана (выход 99%).
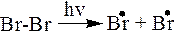

Реакция хлорирования алканов менее региоселективна, так как радикал Сl• более реакционноспособен вследствие меньшей делокализации неспаренного электрона (в меньшем объеме) и поэтому он менее избирателен и может атаковать любой атом углерода с образованием смеси различно замещенных
Обучающая задача №2.
Напишите химизм и механизм реакций, с помощью которых можно получить пентен–2 из пентена–1.
Дата добавления: 2015-07-20; просмотров: 457 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Механизм |