
Читайте также:
|
Этап 1. В молекуле n – нитрофенола имеется сопряженный хромофор, в составе которого имеется бензольное кольцо с ЭД – и ЭА – заместителями в n – положении. Для пара – дизамещенного соединения направление переноса электронной плотности от донора к кольцу и от кольца к акцептору совпадает с общим направлением переноса электронов от донора к акцептору и появляется в виде одной интенсивной полосы, (λмакс= 286 нм и ε = 11700), обусловленной n−π*нсмо электронным переходом с вкладом внутримолекулярного переноса заряда (ВПЗ), (растворитель – изооктан).

Этап 2. При смене неполярного растворителя изооктана на полярный растворитель этанол должен наблюдаться батохромный сдвиг с гиперхромным эффектом, то есть λмакс > 286нм и ε > 11700.
Эти спектральные изменения происходят вследствие сольватации n – нитрофенола, участвующего в межмолекулярном взаимодействии с этанолом, приводящем к образованию водородных связей. Фенольный гидроксил обладает более выраженными кислотными свойствами и менее основными свойствами, чем аналогичные свойства у спиртового гидроксила. Поэтому водородная связь образуется с участием протонизированого атома водорода фенольного гидроксила, вследствие чего увеличивается электронная плотность ЭД – заместителя – гидроксильной группы.
ЭА – нитрогруппа проявляет только основные свойства, поэтому в образовании водородной связи принимает атом кислорода нитрогруппы, несущий часть отрицательного заряда, и атом водорода гидроксильной группы этанола, вследствие чего увеличивается ЭА – влияние нитрогруппы. Увеличение электронодонорного действия гидроксильной группы и электроноакцепторного действия нитрогруппы приводит к батохромному сдвигу с гиперхромным эффектом (λмакс = 314нм, ε =13000).
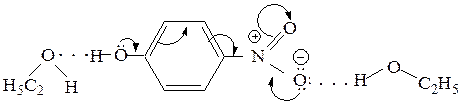
Этап 3. В спиртовом растворе щелочи происходит ионизация фенольного гидроксила вследствие кислотно–основного взаимодействия. Отрицательно заряженный атом кислорода фенолят – аниона является боле сильным электронодонором вследствие увеличения на нем электронной плотности. С этим связано увеличения вклада ВПЗ от электронодонора через бензольное кольцо к электроноакцепторной нитрогруппе, что является причиной существенного батохромного сдвига полосы ВПЗ и увеличения ее интенсивности.

Заключение: при замене неполярного растворителя на этанол и спиртовой раствор щелочи в УФ – спектре n- нитрофенола будет наблюдаться батохромные сдвиги с гиперхромным эффектом.
Обучающая задача №2
Как различить о – и n – изомеры трет. – бутилбензойной кислоты, используя метод электронной спектроскопии? Приведите обоснования ответа с электронных позиций.
Решение.
Общий подход. В сопряженных системах, содержащих объемные заместители, может происходить нарушение сопряжения, сопровождающееся выходом из плоскости сопряженных фрагментов молекулы. При нарушении копланарности молекулы спектры этих соединений становятся похожими на спектры изолированных хромофоров.
Этап 1. В молекуле о–трет.–бутилбензойной кислоты имеются два объемных заместителя, сближенных в пространстве. Поэтому бензольное кольцо и карбоксильная группа не могут расположиться в одной плоскости, они располагаются в разных плоскостях под некоторым углом, что приводит к нарушению сопряжения, р–орбитали атома углерода бензольного кольца и p–орбитали атома углерода карбоксильной группы. Поэтому в УФ–спектре o – трет.–бутилбензойной кислоты будут наблюдаться полосы поглощения, обусловленные электронными переходами бензольного кольца и отдельно карбоксильной группы.


Этап 2. В молекуле n–трет.–бутилбензойной кислоты объемные заместители удалены; трет.–бутильный радикал не создает препятствий для расположения карбоксильной группы в одной плоскости с бензольным кольцом. Следовательно, карбоксильная группа находится в сопряжении с бензольным кольцом. Поэтому максимум полосы поглощения n–изомера, в сравнении с o–изомером, в УФ–спектре будет смещен батохромно.
Заключение: в УФ–спектре о–трет.–бутилбензойной кислоты б удет наблюдаться полоса поглощения с максимумом поглощения в области, характерной для бензола (λмах ~ 255 нм), в УФ–спектре n–трет.–бутилбензойной кислоты будет наблюдаться полоса поглощения с максимумом поглощения в области, характерной для бензойной кислоты (λмах ~ 270 нм).
Дата добавления: 2015-07-20; просмотров: 74 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Решение |