
Читайте также:
|
I Этап (предварительный) – генерирование электрофильной частицы Осуществляется путем взаимодействия реагента с кислотой Бренстеда (в реакции нитрования и сульфирования) или кислотой Льюиса AlCl3, FeCl3 (в реакциях алкилирования, ацилирования, галогенирования).
II Этап – непосредственно реакция SE. Она проходит в три стадии: 1)образование p-комплекса; 2) образование s-комплекса (карбокатиона), 3) стабилизация s-комплекса.
До стадии стабилизации s-комплекса механизм реакции электрофильного замещения аренов в общих чертах сходен с механизмом электрофильного присоединения к алкенам. Различие состоит в том, что стабилизация s-комплекса в реакциях АЕ алкенов происходит за счет присоединения нуклеофила; в случае реакций SE s-комплекс стабилизируется за счет депротонирования. Такой путь стабилизации s-комплекса приводит к восстановлению ароматичности в кольце, поэтому термодинамически он выгоден. Присоединение нуклеофильной частицы приводило бы к термодинамически менее выгодной диеновой системе.

Этап 1. Для получения целевого продукта – п-нитротолуола необходимо провести реакции нитрования и метилирования по Фриделю-Крафтсу.
Запишем две альтернативные схемы синтеза.
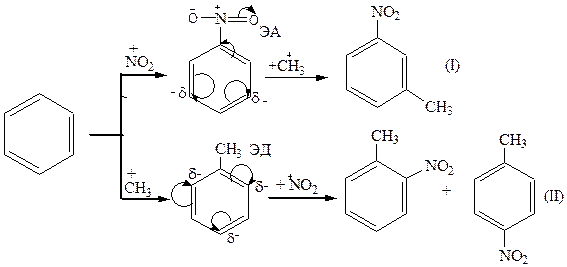
I. Схема (1) с позиций статического фактора т.е. распределения электронной плотности, не может быть принята, так как нитрогруппа является м-ориентантом.
II. Схема (2): метильная группа является ЭД-, активирующей и о- и п-ориентирующей.
Механизм реакции метилирования:
I. Генерирование электрофильной частицы.
II. 

I. Генерирование электрофильной частицы NO2+.
Роль серной кислоты заключается в протонировании молекулы азотной кислоты с целью формирования хорошей уходящей группы Н2О и образования катиона нитрония.



Этап 2. Объяснение активирующего и о-, п-ориентирующего влияния метильной группы в реакции нитрования толуола с позиций динамического фактора, т.е. с позиций стабильности интермедиата – карбокатиона, образующегося на лимитирующей стадии.
Для этого воспользуемся методом резонансных структур. Реальная электронная система –– карбокатион есть результат суперпозиции всех резонансных структур. Каждая в отдельности резонансная структура не есть реальная система; она лишь показывает атом, несущий часть общего положительного заряда реальной системы. Чем больше атомов, несущих этот заряд, т.е. чем более этот заряд делокализован (больше резонансных структур), тем карбокатион более стабилен, скорость его образования выше, концентрация его выше и, следовательно, выше скорость реакции на заключительной стадии. Важно, чтобы в стабилизации принимал участие заместитель. Метильная группа, связанная с sp2 –гибридизованной системой (в данном случае с бензольным кольцом), проявляет электронодонорное стабилизирующее влияние не только по индуктивному механизму, но и за счет s, p-сопряжения (сопряжение электронов s-связи атомов водорода метильной группы и p-электронов соседней p-связи) – см. резонансные структуры (4), (12).
Запишем возможные резонансные структуры для карбокатионов, образующихся при атаке электрофильной частицей о-, м- и п-положений толуола.

Из анализа резонансных структур следует, что наиболее стабильными являются карбокатионы, образующиеся при атаке о- и п-положений и описываемые четырьмя резонансными структурами, причем наибольший вклад в их стабилизацию вносят структуры (3) и (10), в которых положительный заряд соседствует с электродонорной метильной группой.
Карбокатион с мета-ориентацией заместителей менее стабилен: он описывается только тремя резонансными структурами (5), (6), (7). Структура (8) не вносит существенный вклад в резонанс, так как метильная группа, отделенная от положительно заряженного атома двумя простыми связями, не участвует в s, p-сопряжении.
Таким образом, метильная группа во всех случаях стабилизирует карбокатион, но ее стабилизирующее влияние проявляется сильнее в карбокатионах, образующихся при атаке о- и п-положений.
Вывод: метильная группа является активирующим и о-, п-ориентирующим заместителем.
Этап 3. Объяснение дезактитвирующего и м-ориетирующего влияния нитрогруппы с позиций динамического фактора с использованием метода резонансных структур.

Нитрогруппа является электроноакцепторной, следовательно, дестабилизирующей. В стабилизации карбокатионов принимают участие только атомы кольца. Наименьший вклад в стабилизацию карбокатионов вносят резонансные структуры (3) и (7), так как они обладают большой энергией за счет электростатического отталкивания положительных зарядов, противостоящих атомов углерода и азота. Карбокатион с мета-ориетнтацией заместителя более стабилен, так как для него резонансная структура типа структур (3) и (7) невозможна.
Вывод: нитрогруппа является дезактивирующим и м-ориетирующим заместителем в реакциях электрофильного замещения в бензольном кольце.
Заключение: В синтезе пара-нитротолуола из бензола следует вводить в бензольное кольцо сначала электронодонорную метильную группу, то есть активирующий и о- и п-ориетирующий заместитель, а потом нитрогруппу. Так как при нитровании образуются все три изомера, следующим этапом является разделение изомеров и очистка с применением соответствующих методов.
Дата добавления: 2015-07-20; просмотров: 181 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Решение. |