
Читайте также:
|
Корни характеристического уравнения для линейных полиенов, молекулы которых можно описать общей структурной формулой вида:

задаются следующей формулой:

где k — номер МО, n — число атомов в молекуле.
Это общее решение имеет простую графическую интерпретацию. Полуокружность с радиусом, равным 2, следует разделить n радиус-векторами на (n + 1) равных частей. Проекции этих векторов на вертикальную ось и дадут искомые значения величин хi, а следовательно, и вид энергетической диаграммы.

Легко заметить общую закономерность: все энергетические уровни линейных молекул лежат в узком интервале от a + 2b до a – 2b,располагаясь, по мере увеличения числа атомов, все более и более тесно:

В пределе образуются две энергетические зоны, разделенные небольшой щелью. Такое электронное строение, как известно, характерно для полупроводников. Действительно, очень длинные линейные полиены (полиацетилен) обладают полупроводниковыми свойствами.
Можно также заметить следующее: связывающие и разрыхляющие энергетические уровни располагаются симметрично, относительно атомного уровня (a). Для нечетных полиенов (нечетное число атомов) наблюдается, кроме того, один несвязывающий уровень. Все рассмотренные особенности обусловлены топологическим характером метода МОХ.
Общее решение существует и для коэффициентов МО:
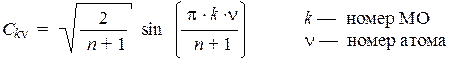
Для этого решения также можно найти графическую интерпретацию. Для каждой МО вычислим набор углов: q k n = (p × k × n)/(n + 1) и построим для каждого такого угла (угол нужно отсчитывать от горизонтальной оси) радиус-вектор в круге радиусом R = [2/(n + 1)]1/2. Проекции этих векторов на вертикальную ось и дадут величины коэффициентов С k n.
 Рассмотрим для примера молекулу бутадиена. Здесь имеется 4 атома и, следовательно, должно быть 4 МО. При k = 1 углы равны: q1n = p/5; 2p/5; 3p/5; 4p/5. Следовательно, диаграмма будет иметь приведенный здесь вид.
Рассмотрим для примера молекулу бутадиена. Здесь имеется 4 атома и, следовательно, должно быть 4 МО. При k = 1 углы равны: q1n = p/5; 2p/5; 3p/5; 4p/5. Следовательно, диаграмма будет иметь приведенный здесь вид.
По величинам проекций радиус-векторов можно найти приближенные значения коэффициентов МО: p1 = {0,372 0,602 0,602 0,372}. Для трех остальных МО (k = 2, 3 и 4) углы оказываются равными:
q2n = 2p/5; 4p/5; 6p/5; 8p/5
q3n = 3p/5; 6p/5; 9p/5; 12p/5
q4n = 4p/5; 8p/5; 12p/5; 16p/5
а соответствующие им приближенные значения коэффициентов:
p2 = {0,602 0,372 – 0,372 – 0,602}
p3 = {0,602 – 0,372 – 0,372 0,602}
p4 = {0,372 – 0,602 0,602 – 0,372}.
Располагая коэффициентами МО, можно построить графические изображения МО, наглядно отражающие их узловую структуру и пространственную симметрию.

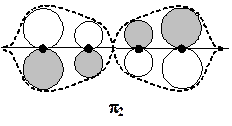


Можно заметить, что огибающие совокупности АО весьма напоминают отрезки синусоид, которые описывают волновые функции в простой модели "частица в потенциальном ящике". Эта аналогия, конечно, не случайна. Действительно, электроны в молекуле бутадиена заперты в одномерном "ящике", стенки которого создаются электрическими полями ядер молекулы. Очевидно, что и в этом случае выполняется общее правило: чем больше узлов — тем выше энергия.
Циклические полиены (аннулены)
Корни характеристического уравнения для молекул аннуленов задаются общей формулой:

где k — номер МО, n — число атомов в молекуле полиена.
Графическая интерпретация решений выглядит так. Построим круг радиуса 2 и разделим его на n равных частей радиус-векторами, первый из которых ориентирован точно вниз. Тогда проекция вектора на вертикальную ось даст величину корня хk.
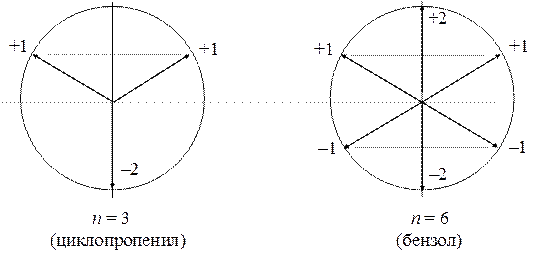
Из этих диаграмм ясно видно основное отличие циклических систем: энергетические уровни являются дважды вырожденными (за исключением самого нижнего у всех циклов и самого верхнего у четных циклов). Эта характерная особенность циклических структур приводит к тому, что число связывающих МО у них всегда нечетное (2 k + 1), а их полная электронная емкость равна 2(2 k + 1) = 4 k + 2, где k — любое целое число. Если число электронов в циклическом полиене равно 4 k + 2, то все его связывающие орбитали полностью заселены, а все разрыхляющие — вакантны. Такая структура должна обладать особенно низкой энергией и быть особенно инертной в химическом отношении. Они называются ароматическими (по Хюккелю) структурами. Соответственно, условие ароматичности (4 k + 2) называется "правилом Хюккеля".
Напротив, если число электронов в аннулене можно выразить как 4 k, то два из этих электронов будут располагаться на паре вырожденных МО, в соответствии с правилом Хунда. В результате, молекула приобретет электронную конфигурацию бирадикала и будет отличаться повышенной химической активностью. Такие структуры называются антиароматическими (по Хюккелю). Приведем несколько примеров.
Дата добавления: 2015-07-20; просмотров: 194 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Молекула циклобутадиена | | | Ароматические молекулы и ионы |