
Читайте также:
|
Для иллюстрации практического применения метода КМО рассмотрим подробно один из его простых вариантов, разработанный Хюккелем. Метод Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО. В его основе лежит несколько приближений, позволяющих практически полностью избавиться от вычислительных трудностей.
Метод Хюккеля имеет дело с каноническими МО и поэтому каждая хюккелевская МО строится в виде ЛКАО:
j i = С i a × y a + С i b × y b +... + С i m × y m +... + i n × y n
где i — номер МО, a, b, … — номера АО, а n — число атомов.
Как указано выше, система уравнений Хартри-Фока-Рутана (ХФР) для нахождения коэффициентов МО (Сi m) имеет вид:
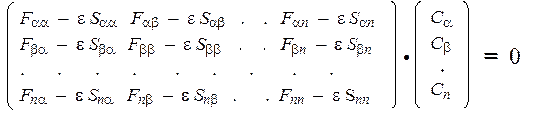
где F mn — матричные элементы оператора Фока (характеризующие энергию взаимодействия пары атомов с номерами m и n), S mn — интегралы перекрывания для данной пары атомов, а e — энергия МО с коэффициентами { С a, С b, …., Сn }.
Основные проблемы метода МО, как известно, связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа F и S. В методе Хюккеля ни один из этих интегралов не вычисляется — они определяются на основании экспериментальных данных (спектральные, калориметрические и т.д.). Таким образом МОХ относится к большой группе полуэмпирических вариантов метода МО.
Еще одно приближение метода Хюккеля заключается в том, что все диагональные интегралы F mm(оба индекса одинаковы), характеризующие некоторый атом (точнее, энергию электрона, локализованного на этом атоме), полагаются одинаковыми и поэтому обозначаются одним и тем же символом: F mm = F nn = a (кулоновский интеграл). Другими словами, предполагается, что все атомы, входящие в состав молекулы, одинаковы по химической природе и все атомные орбитали (y m) из которых строятся хюккелевские МО относятся к одному типу. Именно поэтому простой метод МОХ применяется почти исключительно для описания ненасыщенных углеводородов типа полиенов и аренов. Обычно используют АО pz -типа принадлежащие атомам углерода; построенные из них МО относятся к p‑типу:
p = С a × (pz) a + С b × (pz) b +... + С m × (pz) m +... + Сn × (pz) n
(Отмеченное ограничение несущественно для решения химических задач, так как реакционная способность молекул, содержащих p-электроны, обусловлена электронами именно этого типа. Дополнительно можно отметить, что известны усовершенствованные разновидности метода МОХ, позволяющие описывать электроны и других типов.).
Третье приближение сводится к тому, что недиагональные интегралы F mn разделяются на два типа. Первый тип относится к парам атомов, между которыми имеется химическая связь. Для таких пар атомов принимается следующее условие: F mn = b (резонансный интеграл). Второй тип относится к несвязанным химически парам атомов. Для них F mn = 0. Резонансный интеграл представляет собой поправку к полной энергии, обусловленную делокализацией электрона за счет его перехода от атома m к атому n, и наоборот. Химически связанные атомы располагаются близко друг к другу и амплитуда обмена электронами для такой пары атомов велика. Химически несвязанные атомы практически не могут обмениваться электронами напрямую и соответствующая поправка к энергии настолько мала, что ею можно пренебречь. Следует подчеркнуть, что разделение недиагональных интегралов F mnна два типа осуществляется исключительно на химической основе — по структурной формуле молекулы. Можно сказать, что структура матрицы уравнений ХФР в методе Хюккеля определенным образом "приспособлена" к топологии молекулы. Поэтому метод МОХ относится к классу т.н. топологических вариантов МО.
Четвертое приближение заключается в том, что интегралы перекрывания S mn также разделяются на два типа: диагональные интегралы приравниваются к 1, а недиагональные к 0:

Такой подход называется приближением нулевого дифференциального перекрывания (НДП).
После сделанных приближений, матрица уравнений ХФР существенно упрощается — она уже не содержит интегралов (типа F mn и S mn), которые надо вычислять итерационным методом ССП, а содержит только небольшое число констант a и b, значения которых предполагаются заранее известными, а также параметр e. Поэтому интегро-дифференциальная система уравнений ХФР превращается в методе МОХ в обычную систему уравнений, которую можно легко решить методами линейной алгебры.
Эта система имеет следующий вид: по диагонали матрицы стоят числа (a – e), а недиагональные элементы равны либо числу b, либо или нулю, в зависимости от топологии (структурной формулы) молекулы. С целью упрощения, можно провести дополнительное преобразование: разделим все элементы матрицы на b. Тогда диагональные элементы приобретут вид (a – e)/b = х, а недиагональные будут равны или 0/b = 0, или b/b = 1:

Эта система является однородной (все правые части равны 0). Такие системы совместны только тогда, когда определитель системы равен нулю.
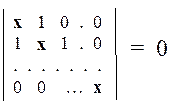
Раскрыв этот определитель, получим характеристическое уравнение, имеющее n корней { x 1, x 2,..., xn }. При поочередной подстановке их в систему, получается n экземпляров системы, причем все они будут заведомо совместны (разрешимы). В качестве решения каждая такая система будет давать набор коэффициентов для одной из МО. Энергии соответствующих МО легко вычислить через значения корней: e i = a – b хi. Этим и исчерпывается общая схема решения хюккелевской задачи.
Для иллюстрации рассмотрим несколько простых примеров.
Дата добавления: 2015-07-20; просмотров: 134 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Поляризуемости | | | Молекула этилена |