
|
Читайте также: |
Электроны p-типа в молекуле этилена описываются двухцентровыми МО, построенными в виде линейной комбинации всего двух атомных орбиталей, причем обе атомные орбитали относятся к р -типу:

В итоге получаются две МО p-типа следующего вида:
p 1 = С 1 а pa + C 1 b pb и p 2 = С 2 а pa + C 2 b pb
Уравнения ХФР имеют простой вид:
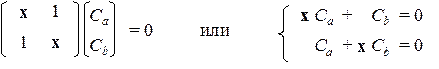
Соответствующее им характеристическое уравнение: х 2 – 1 = 0 имеет два корня: х 1 = +1 и х 2 = –1. При подстановке х = х 1 в систему получим:
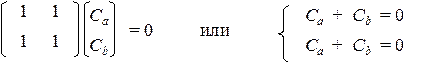
Отсюда следует, что коэффициенты первой МО равны по величине, но противоположны по знаку (Сa = – Cb) и из условия нормировки можно найти их абсолютные величины: С 1 a = (0,5)1/2 и C 1 b = –(0,5)1/2. Аналогично, подстановка в систему второго корня (х 2 = –1) дает значения коэффициентов второй МО: С 2 a = C 2 b = (0,5)1/2.
Таким образом, хюккелевские МО молекулы этилена имеют вид:
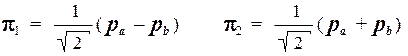
а соответствующие им орбитальные энергии равны:
e1 = a – b х 1 = a – b и e2 = a – b х 2 = a + b
Теперь в математическом отношении задача полностью решена, но следует обсудить некоторые физические выводы из полученного решения.
Во-первых, зная величины энергий МО, можно построить корреляционную энергетическую диаграмму, которая показывает каким образом изменяются энергии стационарных состояний электронов при перекрывании атомных орбиталей. При этом, надо иметь в виду, что оба интеграла (a и b) отрицательны, откуда следует, что энергия e2 = a + b лежит ниже по шкале энергий, чем e1 = a – b.
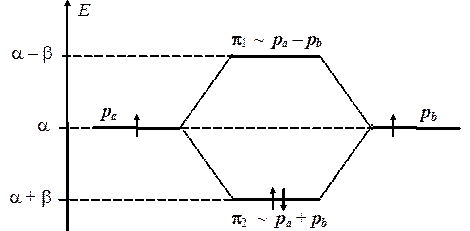
Из диаграммы ясно видно, что энергия одной из МО ниже энергии исходных атомных орбиталей, и ее переселение на нее двух электронов приведет к общему уменьшению энергии на величину D Е = 2b. Следовательно, эта МО будет связывающей. Напротив, энергия другой МО выше энергии АО и ее заселение электронами привело бы к повышению общей энергии. Эта МО, следовательно, будет разрыхляющей. Можно легко определить, что переход одного из электронов со связывающей МО на разрыхляющую будет сопряжен с поглощением порции энергии D Е = 2b, следовательно, такой переход будет происходить при облучении молекулы светом с частотой n = 2b/ h. Частоту перехода легко измерить экспериментально, что позволяет оценить и величину резонансного интеграла b(около 16 ккал/моль или 65 кДж/моль).
Во-вторых, зная коэффициенты МО, мы можем построить графическое изображение МО и соответствующих им электронных облаков

Можно отметить две важные особенности найденных нами МО:
1) МО с более высокой энергией имеет дополнительную узловую поверхность, относительно МО с меньшей энергией;
2) обе МО могут быть охарактеризованы определенной пространственной симметрией, которая совпадает с симметрией всей молекулы этилена, так как полученные нами орбитали относятся к каноническому типу.
Подчеркнем, что, используя менее грубые приближения, можно получить более точную форму МО и их энергии. Тем не менее, узловая структура и симметрия МО, полученных грубым методом МОХ, в точности такая же, как и у самосогласованных МО, получаемых точным методом ХФР. Поэтому многие результаты, получаемые в рамках МОХ, отличаются полной надежностью, что позволяет с успехом использовать простой метод Хюккеля для анализа многих важных задач, таких как, например, установление правил отбора в электронной спектроскопии и в химических реакциях (принцип сохранения орбитальной симметрии).
Дата добавления: 2015-07-20; просмотров: 116 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Метод МО Хюккеля | | | Молекула циклобутадиена |