
Читайте также:
|
| Координационное число | Комплексообразователи |
| Cu+, Ag+, Au+ | |
| Cu+2, Zn+2, Hg+2, Pt+2, Fe+2, Pb+2, Au+3, B+3 | |
| Cu+2, Cо+2, Co+3, Cr+3, Ni+2, Zn+2, Fe+2, Fe+3, Cd+2, Mn+2Al+3, Pt+4, Pb+4, Si+4, Sn+4 |
Важнейшей количественной характеристикой любого лиганда является его дентатность. Она представляет собой число атомов из одной частицы-лиганда, которые непосредственно связаны с комплексообразователем.
Дентатность лигандов-молекул NH3, H2O и CO равна 1. Если лигандами являются анионы, то очень часто их дентатность равна абсолютному значению их заряда (хотя может быть и меньше).
В любой комплексной частице координационное число комплексообразователя равно сумме дентатностей всех лигандов.
Заряд внешней сферы КС всегда равен по абсолютному значению, но противоположен по знаку заряду внутренней сферы, который, в свою очередь, равен алгебраической сумме зарядов центрального атома и лигандов.
Пример 1.10.1. Рассмотрим строение ряда комплексных соединений:
| Структурный элемент КС | Комплексные соединения | |||||
| [Cr(H2O)6]Cl3 | K[Ag(CN)2] | [Pd(NH3)2SO4] | K[Cо(NH3)3PO4] | |||
| Внутренняя сфера | [Cr(H2O)6]3+ | [Ag(CN)2]– | [Pd(NH3)2SO4] | [Cо(NH3)3PO4]ˉ | ||
| Внешняя cфера | Cl– | K+ | — | K+ | ||
| Комплексообразователь и его КЧ | Cr3+ 6 | Ag+ 2 | Pd2+ 4 | Co+2 | ||
| Лиганд и его дентатность | H2O | CN– 1 | NH3 1 | SO42– 2 | NH3 | PO43– |
Классификация комплексных соединений
В зависимости от знака заряда внутренней сферы различают:
1) Анионные КС, например K[Zn(H2O)(CN)3], где внутренняя сфера [Zn(H2O)(CN)3]– – анион.
2) Катионные КС, например [Cu(NH3)4]SO4, в которых внутренняя сфера [Cu(NH3)4]2+ – катион.
3) Катионно-анионные КС, например [Cu(NH3)4][Zn(CN)4], состоят из двух внутренних сфер, одна из которых – катион, а другая – анион.
4) Нейтральные КС, например [Pt(NH3)2Cl2]0 не имеют внешней сферы.
Особую группу составляют хелатные (клешневидные) комплексные соединения, в которых атомы комплексообразователей и атомы лигандов образуют циклические группировки, состоящие чаще всего из 5 или 6 атомов. К таким соединениям относятся, например, внутрикомплексные соединения.
Внутрикомплексные соединения – хелатные соединения, в которых каждый лиганд связан с комплексообразователем двумя ковалентными связями, одна из которых образована по обменному, а другая – по донорно-акцепторному механизму. Такие соединения широко распространены в живой природе. Важнейшими из них являются, например, гем крови и хлорофилл.
В зависимости от природы лигандов комплексные соединения делят на следующие основные типы:
1) Ацидокомплексы (от лат. acidum – кислота), в которых лиганды – кислотные остатки, например K4[Fе(СN)6], Na3[Ag(S2O3)2].
2) Гидроксокомплексы, в которых лиганды – гидроксид-анионы, например K[Au(OH)4], Na3[Al(OH)6].
3) Aквакомплексы (от лат. aqua – вода) или гидраты, в которых лиганды – молекулы воды, например, [Сr(Н2О)6]Сl3, [Cu(H2O)6](ClO4)2.
4) Aмминкомплексы или аммиакаты, в которых лиганды – молекулы аммиака, например [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4.
Номенклатура комплексных соединений
Названия комплексообразователей
В названиях катионных КС применяется русскоязычное наименование комплексообразователя в родительном падеже, например Сu2+ –меди(II), Fe3+ – железа(III).
Наименования анионных КС состоят из корня латинского названия комплексообразователя и русскоязычного суффикса «ат», например Сu2+ – купр ат (II), Fe3+ –ферр ат (III).
В случае нейтральных КС используют русское название комплексообразователя в именительном падеже, например, Сu2+ –медь(II), Fe3+ – железо(III).
Названия лигандов
Названия нейтральных лигандов:Н2О – «аква», NH3 – «аммин», СО – «карбонил», NO – «нитрозил», N2H4 – «гидразин».
Названия лигандов-анионов. Если латинское название аниона заканчивается суффиксом «ид», его заменяют на букву «о»: F– – фтор о, СN– –циан о, S2– – ти о, OH– – гидрокс о и т. д. Исключение: Н– – гидр идо.
Если латинское название аниона заканчивается суффиксом «ат» или «ит», то к нему добавляется буква «о»:  – сульфат о,
– сульфат о,  – сульфит о,
– сульфит о, 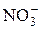 – нитрат о и т. д. Исключение:
– нитрат о и т. д. Исключение:  – нитр о (без суффикса «ит»).
– нитр о (без суффикса «ит»).
Для обозначения числа одинаковых лигандов во внутренней сфере комплекса в качестве приставок перед их названиями используют греческие числительные: ди; три; тетра; пента; гекса и т. д. Приставку моно не употребляют. Название внутренней сферы записывают в одно слово.
Названия комплексных соединений
Порядок названия комплексных соединений аналогичен порядку названий обычных солей, т. е. сначала указывается анион в именительном падеже, а затем катион в родительном падеже. Формулы комплексов читаются строго справа налево с соблюдением указанного в них порядка расположения лигандов.
Пример 1.10.2. Приведите примеры координационных соединений различных типов и назовите их.
Решение.
Катионные КС:
[Co(NH3)6]3+Cl3 – хлорид гексаамминкобальта(III);
[Cr(NH3)5H2O]3+(NO3)3 – нитрат аквапентаамминхрома(III).
Анионные КС:
(NH4)2[PdCl4]2- – тетрахлоропалладат(II) аммония;
K[Pt(NH3)Br5]– – пентабромoамминплатинат(IV) калия;
K4[Fe(CN)6]4– – гексацианоферрат(II) калия.
Нейтральные КС:
[Fe(H2O)3Cl(NCS)2] – дитиоцианохлоротриакважелезо(III);
[Pt(NH3)2Cl2] – дихлородиамминплатина(II);
[Hg(H2O)2(CN)2] – дицианодиаквартуть(II).
Катионно-анионные КС:
[Cu(NH3)4][Zn(H2O)(CN)3]2 – трицианоаквацинкат тетраамминмеди(II);
Диссоциация комплексных соединений в водных растворах
Различают первичную и вторичную диссоциацию КС в растворах. Первичная диссоциация заключается в том, что катионные и анионные КС необратимо распадаются на ионы внешней и внутренней сфер, например:
[Ag(NH3)2]+Cl → [Ag(NH3)2]+ + Cl–;
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4–.
КС катионно-анионного типа при этом также необратимо распадаются на комплексные катионы и комплексные анионы;
[Cu(NH3)4][Zn(H2O)(CN)3]2 → [Cu(NH3)4]2+ + 2[Zn(H2O)(CN)3]–.
Вторичной диссоциации подвергаются комплексные частицы (внутренние сферы). Они обратимо и постадийно диссоциируют на составные части. Например, при вторичной диссоциации комплексный анион [Ag(NH3)2]+ обратимо и по стадиям отщепляет частицы лигандов – молекулы NH3. Поскольку в растворе при этом устанавливаются динамические равновесия, каждой стадии вторичной диссоциации соответствует своя константа равновесия. Она называется константой нестойкости (K нест) комплексного иона по данной стадии:
1-я стадия: [Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3;
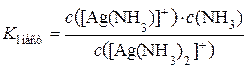 ;
;
2-я стадия: [Ag(NH3)]+ ↔ Ag+ + NH3;
 .
.
При этом всегда K 1 нест > K 2 нест. Но поскольку они отличаются не очень сильно, часто используют общую константу нестойкости комплексного иона K нест. Она является константой равновесия суммарного процесса вторичной диссоциации:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3;
 = K 1 нест · K 2 нест.
= K 1 нест · K 2 нест.
Для каждого комплексного иона при данной температуре K нест – постоянная величина (приложение 4). Чем меньше ее значение, тем устойчивее комплексный ион в растворе, тем слабее протекает его вторичная диссоциация и наоборот.
Величина, обратная общей константе нестойкости комплексного иона, называтся общей константой его устойчивости K уст:

Соответственно чем больше K уст комплексного иона, тем он устойчивее в растворе и наоборот.
Константы нестойкости комплексных ионов слабо зависят от температуры.
Пример 1.10.3. Напишите координационную формулу сульфата гексаамминкобальта(III). Укажите заряд и координационное число комплексообразователя, заряд внутренней сферы. Напишите уравнения первичной и вторичной диссоциации и выражение константы нестойкости комплексного иона.
Решение.
1) Сульфат гексаамминкобальта(III) – катионное КС состава [Co(NН3)6]2(SO4)3. Комплексообразователь – Со3+. Его координационное число в соответствии с правилом Вернера равно удвоенному значению заряда, т. е. 6. Лиганды – однодентатные молекулы аммиака. Заряд внутренней сферы, равный сумме заряда комплексообразователя и общего заряда всех лигандов, составляет 3+.
2) Уравнение первичной диссоциации КС (по типу сильного электролита):
[Co(NН3)6]2(SO4)3 → 2[Co(NН3)6]3+ + 3 SO42–.
3) Общее уравнение вторичной диссоциации комплексного иона (по типу слабого электролита):
[Co(NН3)6]3+ ↔ Со3+ + 6 NН3.
5) Выражение общей константы нестойкости комплексного иона:

Реакции с участием комплексных ионов
Реакции ионного обмена
К таким реакциям относятся, например, многочисленные реакции обмена КС с обычными солями. При этом КС обмениваются с ними своими составными частями – внешней или внутренней сферами, например:
3Cu2+SO4 + 2K3[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 3K2SO4;
3Cu2+ + 3 SO42– + 6K+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 6K+ +3SO42–;
3Cu2+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓.
Такие реакции протекают необратимо, если приводят к образованию малорастворимых продуктов.
Реакции лигандного обмена
В ходе таких реакций лиганды в комплексных ионах замещаются другими лигандами – молекулами или ионами веществ, с которыми реагируют КС. Так, например, при добавлении аммиака в водный раствор сульфата никеля (II), содержащий комплексные акваионы [Ni(H2O)6]2+, молекулы аммиака обратимо вытесняют из них молекулы воды. Это приводит к образованию новых комплексных ионов:
[Ni(H2O)6]2+ + 6NH3 ↔ [Ni(NH3)6]2+ +6H2O.
Равновесия таких процессов всегда смещены в сторону более устойчивых комплексных ионов с меньшими значениями K нест. Например,
K нест([Ni(H2O)6]2+) = 2,2 · 10–2, а K нест([Ni(H2O)6]2+) = 1,86 · 10–9.
Реакции связывания лигандов
Они заключаются в том, что лиганды из комплексного иона связываются с молекулами или ионами добавляемого вещества, в результате чего комплексный ион разрушается. Так, например, при добавлении азотной кислоты к раствору комплексного соединения [Ag(NH3)2]Cl выпадает осадок AgCl. Это происходит потому, что ионы H+ из раствора кислоты соединяются с молекулами NH3 из комплексных ионов [Ag(NH3)2]+ , образуя катионы серебра и катионы аммония:
[Ag(NH3)2]+ + 2H+ → Ag+ + 2NH4+.
Реакции осаждения комплексообразователей
Их суть состоит в том, что при добавлении к раствору КС специальных реагентов, содержащиеся в них ионы соединяются с ионами комплексообразователя, образуя малорастворимые вещества. Так, например, при добавлении раствора KI к раствору хлорида диамминсеребра [Ag(NH3)2]Cl выпадает осадок AgI, вследствие чего комплексные ионы разрушаются:
[Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2 NH3.
Это происходит потому, что ионы I– образуют с ионами Ag+ чрезвычайно мало растворимый иодид серебра.
Пример 1.10.4. К раствору, в котором молярные концентрации [Ag(NH3)2]NO3 и аммиака равны соответственно 0,1 моль/дм3 и 10 моль/ дм3, добавили раствор хлорида калия такого же объема с молярной концентрацией KCl, равной 0,1 моль/дм3. Образовался ли при этом осадок AgCl?
Решение.
1.Рассчитаем молярную концентрацию ионов [Ag(NH3)2]+ и аммиака в растворе после добавления равного объема раствора KCl. Поскольку объем исходного раствора увеличился в 2 раза, то молярная концентрация всех содержавшихся в нем веществ уменьшилась в 2 раза и составляет для [Ag(NH3)2]+ и NH3 соответственно 0,05 моль/дм3 и 5 моль/дм3.
2.Рассчитаем молярную концентрацию ионов Ag+ в полученном растворе. Допустим, что концентрация распавшихся комплексных ионов равна х моль/дм3. Согласно уравнению диссоциации [Ag(NH3)2]+ концентрации образовавшихся Ag+ и NH3 равны соответственно х моль/дм3 и 2 х моль/дм3. Тогда концентрация оставшихся ионов [Ag(NH3)2]+ будет составлять (0,05 – х) моль/дм3, а концентрация аммиака – (5 + 2 х) моль/дм3. Поскольку значение х очень мало, им можно пренебречь и считать, что равновесные концентрации [Ag(NH3)2]+ и NH3 в растворе равны их исходным концентрациям, т. е. соответственно 0,05 моль/дм3 и 5 моль/дм3:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
0,05 моль/дм3 х моль/дм35 моль/дм3
3.Значения концентраций частиц подставим в выражение константы нестойкости комплексного иона:
4. 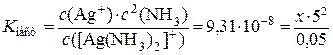 . Отсюда х = 1,86 ·10–10 моль/дм3.
. Отсюда х = 1,86 ·10–10 моль/дм3.
5.Рассчитаем значение ПК ионов Ag+ и Cl– в растворе после смешивания:
Поскольку были смешаны растворы равных объемов, концентрация ионов Cl– после смешивания также уменьшилась в 2 раза и составила 0,05 моль/дм3. Тогда получаем:
ПК = с (Ag+) · c (Cl–) = 1,86 ·10–10 · 0,05 = 9,31·10–12.
6.Поскольку значение ПК меньше значения ПР(AgCl), равного
1,8∙10–10, то осадок AgCl не выпадает и комплекс [Ag(NH3)2]+ в этих условиях ионами Clˉ не разрушается.
Пример 1.10.5. Будет ли разрушаться комплексный ион [Ag(NH3)2]+ в условиях примера 10.4 при замене KCl на KI?
Решение.
Поскольку все расчеты остаются прежними, нужно только сравнить найденное значение ПК ионов Ag+ и I– с справочным значением ПР(AgI), равным 1·10–16.
Так как 9,31 · 10–12 >1·10–16, то осадок AgI выпадает и, следовательно, комплексный ион [Ag(NH3)2]+ в тех же условиях ионами Iˉ разрушается.
Реакции полного восстановления
комплексообразователей
В ходе таких реакций комплексообразователь восстанавливается до простого вещества и выделяется из раствора в виде металлического осадка. Так, например, при добавлении цинка в раствор дицианоаурата(I) калия выделяется чистое золото:
Zn0 + 2K[Au+(CN)2] → Au0↓ + K2[  (CN)4].
(CN)4].
Эта реакция длительное время использовалась для промышленного получения золота по методу Багратиона.
Химическая связь в комплексных соединениях.
Геометрическая форма комплексных частиц
Между ионами внешней и внутренней координационных сфер осуществляется ионная связь. Внутри комплексных частиц центральные атомы связаны с лигандами ковалентными связями, образованными по обменному и по донорно-акцепторному механизмам.
Для наглядного объяснения образования химической связи в комплексных частицах и их геометрической формы удобно использовать метод валентных связей (МВС).
Согласно этому методу химические связи между атомами комплексообразователей и лигандами образуются по донорно-акцепторному механизму, а геометрическая форма комплексных частиц определяется типом гибридизации орбиталей центральных атомов (табл. 4).
Таблица 4
Дата добавления: 2015-07-25; просмотров: 121 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Из всех возможных ОВР наиболее вероятной будет та реакция, которой соответствует максимальное значение разности потенциалов применяемых окислителя и восстановителя. | | | Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц 1 страница |