
Читайте также:
|
Математическое выражение закона:
p (cм.) = p (1) + p (2) +... + p ( n ),
где p (cм.) – общее давление газовой смеси; p (1), p (2), p (n)– парциальные давления каждого из газов смеси.
Парциальное давление газа (от латинского «pars» – часть) – давление, которое оказывал бы данный газ на стенки сосуда, если бы он один занимал весь объем газовой смеси при тех же условиях.
При решении задач с использованием данного закона необходимо помнить, что парциальное давление данного газа прямо пропорционально его объемной (φ) или мольной (χ) доле в газовой смеси:
p (1)= φ(1) · p (смеси) = χ(1) · p (смеси).
Пример 1.1.16. Общее давление смеси, состоящей из азота массой 14 г и кислорода массой 8 г, равно 155 кПа. Вычислите значения парциальных давлений газов в смеси.
Решение.
Поскольку в смеси объемные доли газов численно равны их мольным долям, то в данном случае парциальные давления газов будут пропорциональны их мольным долям.
1) Рассчитаем химическое количество каждого из газов:
 n (N2) =
n (N2) = 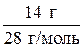 = 0,5 моль;
= 0,5 моль; 
n (O2) = 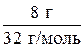 = 0,25 моль.
= 0,25 моль.
2) Рассчитаем значения мольных долей газов в смеси:
 χ(N2) =
χ(N2) = 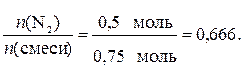
Следовательно, мольная доля кислорода χ(О2) равна:
 χ(O2) = 1 – 0,666 = 0,334.
χ(O2) = 1 – 0,666 = 0,334.
3) Рассчитаем значения парциальных давлений газов:
p (N2) = χ(N2) ∙ р (смеси) = 0,666 · 155 кПа = 103,23 кПа;
p(O2) = χ(O2) ∙ р (смеси) = 0,334 · 155 кПа = 51,77 кПа.
Пример 1.1.17. В сосуде объемом 6 дм3 смешали кислород объемом 3,5 дм3, находившийся под давлением 125 кПа, и азот объемом 5,5 дм3, находившийся под под давлением 105 кПа. Вычислите парциальные давления газов и общее давление полученной смеси.
Решение.
1) По уравнению Бойля – Мариотта рассчитаем новые давления газов в полученной смеси (т. е. их парциальные давления):
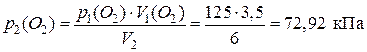 ;
;
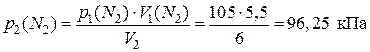 .
.
2) Найдем общее давление смеси:
р (смеси) = p 2(О2) + p 2(N2) = 72,92 кПа + 96,25 кПа = 169,17 кПа.
Пример 1.1.18. В баллоне объемом 44,5 дм3 при температуре 19 oС содержатся кислород массой 27,2 г, углекислый газ массой 55,0 г и азот неизвестной массы. Вычислите массу азота в смеси, если ее давление равно 139,05 кПа.
Решение.
1) Из уравнения Клапейрона – Менделеева выразим давление и рассчитаем его значения для кислорода и углекислого газа:
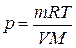 ;
; 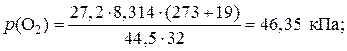

2) Рассчитаем парциальное давление азота в смеси:
p (N2) = р (смеси) – p (CO2) – p (O2) = 139,05 – 68,16 – 46,35 = 24,5 кПа.
3) Рассчитаем значение массы азота в смеси:
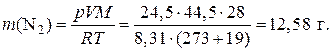
Пример 1.1.19. В газометре над водой при температуре 25 оС содержится кислород объемом 5,2 дм3 под давлением 102,455 кПа. Рассчитайте объем сухого кислорода в газометре при н. у., если давление насыщенного водяного пара при 25 oС равно 3,164 кПа.
Решение.
1) Рассчитаем парциальное давление чистого кислорода в его смеси с водяным паром:
р (O2) = р (cмеси) – p (H2O) = 102,455 – 3,164 = 99,291 кПа.
2) Из уравнения Клапейрона выразим V 0 и рассчитаем его:
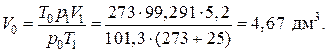
Вопросы для самостоятельной подготовки
1. Сформулируйте определения понятий: атом, химический элемент, молекула, радикал, ион, вещество.
2. Чем атомные частицы отличаются от молекулярных частиц?
3. Cколько химических элементов известно в настоящее время? В чем заключаются различия между химическим элементом и простым веществом? Какие характеристики присущи элементу, а какие – простому веществу?
4. Что такое постоянная атомной массы? Чему она равна и как обозначается?
5. Что характеризуют относительная атомная и относительная молекулярная массы? Почему эти величины являются безразмерными?
6. Почему число простых веществ (~ 550) гораздо больше числа известных химических элементов? Чем обусловлено явление аллотропии?
7. Приведите примеры веществ молекулярного и немолекулярного (атомного, ионного) строения. Какие физические свойства присущи тем и другим веществам?
8. Дайте определение понятия «формульная единица вещества». Приведите примеры ФЕ веществ молекулярного и немолекулярного строения.
9. Чем простейшие (эмпирические) формулы веществ отличаются от молекулярных формул? Как они связаны между собой? Приведите примеры.
10. Чем определяется химическое количество вещества? Сформулируйте определение понятия моль. Каков физический смысл постоянной Авогадро и чему равно ее значение?
11. Что представляет собой молярная масса вещества? Как она связана с массой вещества и его химическим количеством? Какие значения принимает молярная масса и в каких единицах она выражается?
12. Что такое молярный объем газа? Как он связан с объемом газа и его химическим количеством? Почему у разных газов при одинаковых условиях значение молярного объема примерно одинаково?
13. Сформулируйте закон сохранения массы веществ. Как можно интерпретировать этот закон с точки зрения атомно-молекулярного учения?
14. Сформулируйте закон постоянства состава веществ. К каким соединениям он применим и почему? Какие вещества относятся к веществам постоянного, а какие – к веществам переменного состава? Приведите примеры.
15. Что обозначает формула Сr0,87S? Можно ли ее записать в виде СrS1,15? Почему?
16. Сформулируйте закон эквивалентов. Дайте определения понятиям эквивалент, число эквивалентности, фактор эквивалентности, молярная масса эквивалентов, молярный объем эквивалентов.
17. Почему эквивалентами одного и того же вещества могут быть разные частицы? Поясните на конкретных примерах.
18. Почему молярная масса эквивалентов одного и того же вещества может иметь разные значения?
19. Сформулируйте закон Авогадро. К веществам в каком агрегатном состоянии он применим и почему?
20. Сформулируйте важнейшие следствия из закона Авогадро. Какие условия считаются нормальными и чему равен молярный объем газа при этих условиях? В каких единицах он выражается?
21. Что характеризует относительная плотность одного газа по другому газу?
22. Как рассчитывается плотность газа и каков ее физический смысл?
23. Что характеризует средняя молярная масса газовой смеси? Как она рассчитывается? Чему равна средняя молярная масса воздуха?
24. Сформулируйте законы Бойля – Мариотта и Шарля – Гей-Люссака, запишите их математические выражения.
25. Сформулируйте объединенный газовый закон и запишите его математическое выражение. В каких расчетах он используется?
26. Запишите уравнение Клапейрона – Менделеева. Каков физический смысл молярной газовой постоянной? Какие значения она может принимать и от чего зависит ее величина?
27. Какое давление называется парциальным давлением газа? Как оно связано с общим давлением газовой смеси? Сформулируйте закон парциальных давлений газов.
Задачи и упражнения
1. Масса газа АВ2 объемом 9,52 дм3 при н. у. равна 18,7 г. Вычислите:
а) молярную массу данного газа;
б) массу одной его молекулы;
в) число молекул в указанной порции газа;
в) общее химическое количество атомов в ней.
2. Масса одной молекулы вещества составляет 1,628 · 10–22 г. Определите:
а) молярную массу вещества;
а) массу вещества, если его химическое количество равно 0,35 моль.
б) число молекул этого вещества, если его объем равен 10 см3, а плотность – 1,83 г/см3;
в) объем этого вещества, если число его молекул составляет ¼ числа Авогадро.
3. Масса каждого из веществ – СaСО3, H2O2, CH4, NаCl равна 50 г. Определите, в порции какого из них:
а) наименьшее число ФЕ;
б) наибольшее число атомных частиц.
4. Объем (н. у.) каждого из газов – CH4, NH3, HBr, (CH3)2O равен 2,24 дм3. Определите, в каком из них:
а) содержится наибольшее число атомных частиц;
б) масса водорода максимальна;
в) мольная доля атомов водорода максимальна?
5. Чему равна общая масса водорода (элемента), содержащегося в смеси метана и аммиака общим объемом 22, 4 дм3 (н. у.), если в ней числа молекул указанных газов одинаковы?
6. В какой из указанных порций веществ содержится максимальная масса кислорода:
а) оксид углерода (IV) объемом 4,48 дм3 (н. у.);
б) карбонат аммония массой 27,2 г;
в) лед массой 27 г;
г) глюкоза массой 36 г?
7. Какой объем (н. у.) оксида углерода(II) нужно добавить к оксиду серы(IV) массой 3,2 г для того, чтобы в полученной смеси:
а) числа молекул обоих газов оказались одинаковыми;
б) химическое количество атомов кислорода в обоих веществах стали равным;
в)массовые доли компонентов смеси стали равными?
8. Смесь натрия, калия и кальция прореагировала с водой. В результате реакции образовалась смесь гидроксидов общей массой 3,78 г и выделился газ, объем которого при температуре 27 оС и давлении 100,6 кПа составил 0,992 дм3. Найдите массу исходной смеси металлов.
9. Найдите число ФЕ и общее химическое количество атомов в указанных порциях веществ:
а) в бензоле массой 0,78 г;
б) в аммиаке объемом 10,4 дм3 при 22 оС и 110 кПа;
в) в оксиде кремния (IV) массой 2,4 г.
10. Смесь серы и углерода сожгли в кислороде, в результате чего были получены оксид серы(IV) массой 25,6 г и оксид углерода(IV) объемом 17,92 дм3 (н. у.). Найдите массу сгоревшей смеси и объем (н. у.) израсходованного кислорода.
11. Чему равен объем (н. у.) оксида серы(IV), если:
а) масса содержащегося в нем кислорода составляет 12,8 г;
б) общее химическое количество атомов равно 0,24 моль?
12. Найдите массу пентагидрата сульфата меди(II), если число его формульных единиц равно общему числу ионов в карбонате аммония массой 9,6 г.
13. В смеси металлов число атомов магния в 3 раза больше числа атомов алюминия. Во сколько раз масса магния в этой смеси больше массы алюминия? Какой объем (н. у.) кислорода нужен для полного сгорания исходной смеси массой 19,8 г?
14. Чему равна общая масса азота и кислорода в смеси сульфата аммония и гидрофосфата аммония общей массой 26,4 г?
15. Чему равна масса смеси серной и ортофосфорной кислот, если общая масса содержащегося в ней кислорода равна 19, 2 г?
16. Чему равен объем смеси оксида углерода (IV) и оксида азота(I) общей массой 13,2 г при температуре 45 оС и давлении 124,8 кПа?
17. Один из двух одинаковых сосудов с массой, равной 200 г, заполнили оксидом серы(IV), а другой при тех же условиях – неизвестным газом массой 12 г. Масса первого сосуда оказалась в 1,17 раза больше массы второго сосуда. Найдите плотность (н. у.) неизвестного газа и его относительную плотность по воздуху.
18. Найдите число ионов, содержащихся в указанных порциях веществ:
а) в сульфате аммония массой 26,4 г;
б) в гидрокарбонате кальция массой 16,2 г;
в) в нитрате гидроксоцинка массой 7,2 г;
г) в ацетате магния, если его химическое количество равно 0,07 моль?
19. Газ, относительная плотность которого по водороду равна 22, содержится в сосуде объемом 20 дм3 при температуре 20 оС. Вычислите массу газа, если его давление составляет 1,038·105 Па.
20. Определите массу паров толуола, содержащегося в воздухе в помещении объемом 300,0 м3 при температуре 23 оС, если их давление равно 485 Па. Сколько молекул толуола содержится в таком воздухе объемом 1 см3?
21. Вычислите массу карбоната кальция, при прокаливании которого выделится углекислый газ объемом 5,5 дм3 при температуре 15 оС и давлении 104000 Па.
22. Из образца технического хлората калия массой 3,0 г в результате полного разложения этой соли был получен кислород, объем которого при температуре 20 оС и давлении 111,9 кПа равен 0,75 дм3. Вычислите массовую долю примеси в исходном образце хлората калия.
23. После взрыва смеси водорода с кислородом общим объемом 2 дм3 (н. у.) остался кислород объемом 0,32 дм3 (н. у.). Вычислите объемные доли газов в исходной смеси и массу образовавшейся воды.
24. В результате сжигания смеси водорода с кислородом в закрытом сосуде образовалась смесь водяных паров и непрореагировавшего водорода. Ее объем при температуре 180 оС и давлении 199,5 кПа составил 2,45 дм3, а после приведения к н. у. – 1,12 дм3. Найдите плотность исходной газовой смеси (н. у.) и массу образовавшейся воды.
25. Смесь оксида углерода(II) с кислородом общим объемом 250 см3 (н. у.) подожгли. В результате реакции образовалась новая смесь, в которой содержится кислород объемом 25 см3 (н. у.). Вычислите относительную плотность исходной смеси по гелию.
26. При нагревании кристаллогидрата карбоната натрия массой 5,72 г до прекращения реакции дегидратации образовался твердый остаток массой 2,12 г. Определите химическую формулу исходного кристаллогидрата и найдите массовую долю кислорода в нем.
27. Из скольких атомов состоят молекулы ртути, если при некоторых условиях относительная плотность ее паров по воздуху равно 6,92?
28. При некоторой температуре плотность паров серы по азоту равна 9,14. Из скольки атомов состоит молекула серы при указанной температуре?
29. Какой объем при н. у. займет кислород, содержащийся в баллоне вместимостью 120,0 дм3 под давлением 1,52·107 Па и при температуре 19 оС? Чему равна масса данной порции газа?
30. При 17 оС давление азота в стальном объеме баллона составляет 1,2·107 Па. Предельно допустимое давление, которое выдерживает баллон, равно 2,0·107 Па. При нагревании до какой температуры он взорвется?
31. В сосуд объемом 3,0 дм3, из которого был предварительно выкачан воздух, ввели водород объемом 2,5 дм3 и азот объемом 7,5 дм3, находившиеся при н. у. Вычислите давление внутри сосуда, если температура газовой смеси в нем оказалась равной 27 оС.
32. Газообразный углеводород массой 26,2 г смешан с гелием, объемная доля которого в полученной смеси равна 10 %. При температуре 27 оС и давлении 1,21·105 Па данная смесь занимает объем, равный 20 дм3. Определите формулу углеводорода, содержащегося в смеси.
33. В воздухе парциальные давления газов равны: азота – 79034 Па; кислорода – 21279 Па; аргона – 983 Па; углекислого газа – 30 Па.
Вычислите значения объемных долей этих газов в воздухе. Чему равна масса аргона, содержащегося в воздухе объемом 1000 дм3 (н. у.)?
34. Неизвестный газ состава ЭН3 массой 0,856 г при температуре 26 оС и давлении 98,45 кПа занимает объем, равный 0,277 дм3. Вычислите массовую долю элемента Э в газе.
35. Относительная плотность газообразного вещества Х2 по кислороду равна 0,875. Вычислите массу данного вещества, если:
а) его объем при температуре 22 оС и давлении 105,5 кПа составляет 18,2 дм3;
б) его химическое количество равно 0,6 моль;
в) общее число атомов Х составляет 25 % числа Авогадро.
36. Вычислите объем (н. у.) эквимолярной смеси водорода с кислородом, в которой масса водорода равна 1 г. Чему равна относительная плотность данной смеси по воздуху?
37. Вычислите массу атома элемента Х, если газообразное простое вещество Х2 массой 14,2 г при температуре 35 оС и давлении 102,38 кПа занимает объем, равный 5,0 дм3.
38. Какой объем при температуре 27 оС и давлении 1,8 ·105 Па занимает газ массой 11 г, если его плотность (н. у.) равна плотности (н. у.) оксида азота(I)?
39. Объемная доля сероводорода в смеси с неизвестным галогеноводородом равна 0,2, а массовая доля водорода (элемента) в смеси составляет 1,676 %. Определите галогеноводород и вычислите плотность данной смеси при н. у.
40. Смесь метана, угарного газа и этана общим объемом 100 см3 (н. у.) сожгли в кислороде, в результате чего образовались углекислый газ объемом 167,2 см3 (н. у.) и вода массой 0,198 г. Вычислите относительную плотность исходной смеси по воздуху.
41. Смесь пропана, метана и оксида углерода(II) общим объемом 0,5 дм3 (н. у.) сожгли в кислороде, в результате чего образовался углекислый газ объемом 0,65 дм3 (н. у.). Вычислите объемную долю пропана в исходной смеси.
42. Парциальные давления метана и кислорода в их смеси одинаковы. Чему равна плотность данной смеси (н. у.)?
43. В смеси этана и водорода на 1 атом С приходятся 5 атомов Н. Какой объем воздуха (н. у.) необходим для полного сгорания такой смеси объемом 12 дм3?
44. Какой объем воздуха (н. у.), необходим для полного сгорания смеси водорода с ацетиленом общим объемом 120 дм3 (н. у.), если относительная плотность ее по водороду равна 2,09?
45. Смесь метана, этилена и ацетилена сожгли в избытке кислорода, в результате чего образовались углекислый газ объемом 8,96 дм3 (н. у.) и вода массой 9,0 г. Вычислите массу исходной смеси.
46. В результате сжигания в кислороде смеси этана, этена и этина общей массой 11,4 г образовалась вода массой 16,2 г. Найдите объем (н. у.) израсходованного кислорода.
47. Масса колбы емкостью 224 см3, заполненной неизвестным газом при температуре 47 оС и давлении 106,84 кПа, равна 125,576 г. Масса той же колбы, заполненной при тех же условиях воздухом, равна 125,261 г. Вычислите молярную массу неизвестного газа.
48. Масса колбы, заполненной неизвестным газом при температуре
19 оС и давлении 102 кПа, равна 230,381 г. Масса этой же колбы, заполненной при тех же условиях воздухом, равна 226,218 г. Масса колбы, заполненной водой, равна 1225 г. Вычислите молярную массу неизвестного газа.
49. В смеси газов их объемные доли равны: углекислого газа – 20 %; угарного газа – 15 %; водорода – 30 %; водяного пара – 35 %. Вычислите массу данной смеси, если ее объем при температуре 25 оС и давлении 100,1 кПа равен 1 м3.
50. В вакуумированном сосуде объемом 6,0 дм3 смешали водород объемом 2,0 дм3, находившийся под давлением 125 кПа, и метан объемом 8,0 дм3, находившийся под давлением135 кПа. Вычислите давление полученной смеси. Чему равна ее относительная плотность по аргону?
51. В смеси углекислого и угарного газов их парциальные давления равны соответственно 185,5 кПа и 15,5 кПа. Вычислите объем, который будет занимать указанная смесь массой 25,0 г при температуре 100 оС и давлении 105,5 кПа.
52. В закрытом сосуде объемом 0,5 м3 при температуре 20 оС находится смесь, состоящая из углекислого газа массой 198 г, кислорода массой 480 г и метана массой 160 г. Вычислите парциальные давления газов в смеси и ее плотность (н. у.).
53. Давление влажного кислорода объемом 8,0 дм3, находящегося в газометре над водой при температуре 20 оС, равно 98500 Па. Какой объем водорода (н. у.) прореагирует с кислородом из газометра, если давление насыщенного водяного пара при указанной температуре составляет 2335 Па?
54. В сосуде объемом 8,0 дм3 была приготовлена смесь из азота объемом 5 дм3, находившегося под давлением 150 кПа, и кислорода объемом 10 дм3. Под каким давлением находился кислород до приготовления смеси, если ее общее давление равно 125 кПа?
55. Неизвестный металл растворили в соляной кислоте, в результате чего образовалась соль массой 27,2 г и выделился газ, объем которого при температуре 19 оС и давлении 104 кПа составил 4,667 дм3. Определите металл и вычислите его массу.
56. Металл массой 4,8 г вытеснил из раствора серной кислоты водород объемом 3,67 дм3, собранный над водой при температуре 27 оС. Давление влажного водорода составило 104,3 кПа. Вычислите массу образовавшейся при этом соли, если давление насыщенного водяного пара при указанной температуре равно 2,3 кПа.
57. Неизвестный металл массой 10,4 г полностью прореагировал с хлороводородом объемом 11,44 дм3 при температуре 60° С и давлении 96,8 кПа. Определите металл, если в образовавшемся соединении он проявляет степень окисления, равную +2.
58. Металл массой 0,45 г вытеснил из раствора кислоты водород объемом 584 см3, собранный над водой при температуре 18 оС. Давление влажного водорода составило 105,6 кПа. Определите исходный металл, если давление насыщенного водяного пара при указанной температуре равно 2,1 кПа.
59. Рассчитайте молярную массу эквивалентов металла и определите металл, если его массовая доля в оксиде равна 60 %.
60. Неизвестный металл массой 11,20 г образует хлорид массой 25,4 г. Вычислите массу данного металла, при растворении которого в кислоте выделится водород объемом 37,5 дм3 при температуре 22 оС и давлении 98,8 кПа.
61. На восстановление оксида некоторого металла массой 4,21 г затрачен водород, объем которого при температуре 25 оС и давлении 98,77 кПа равен 1982 см3. Вычислите молярную массу эквивалентов металла и определите металл.
62. Оксид неизвестного металла массой 0,80 г превратили в сульфат этого же металла массой 2,68 г. Рассчитайте массу хлорида металла, который можно получить из исходного оксида массой 10,2 г.
63. Определите эквивалент, рассчитайте молярную массу и молярный объем эквивалентов (н. у.) сероводорода в каждой из реакций:
а) 2H2S + (CuOH)2SO4 = 2CuS + H2SO4 + 2H2O;
б) 2H2S + O2 = 2H2O + 2S;
в) 2H2S + 3O2 = 2H2O + 2SO2;
г) H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
64. Определите эквивалент и рассчитать молярную массу эквивалентов сульфата алюминия в каждой из реакций:
а) Al2 (SO4)3 + 12KOH = 2K3[Al (OH)6] + 3K2SO4;
б) Al2 (SO4)3 + 4Al (OH)3 = 3[Al (OH)2]2SO4;
в) Al2 (SO4)3 + 2KOH = 2Al (OH)SO4 + K2SO4.
65. Рассчитайте химическое количество эквивалентов фосфорной кислоты в каждой из реакций, если ее масса в каждом случае равна 19,6 г:
а) 4H3PO4 + Ca3(PO4)2 = 3Ca(H2PO4)2;
б) 2H3PO4 + (CaOH)3PO4 = 3CaHPO4 + 3H2O;
в) 2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 6Н2О.
66. Для осаждения всего хлора, содержавшегося в хлориде металла массой 1,04 г, израсходован нитрат серебра массой 1,70 г. Вычислите молярную массу эквивалентов металла и определите данный металл.
67. Неизвестный металл массой 13,5 г вытесняет из раствора кислоты водород объемом 16,8 дм3 (н. у.). Этот же металл такой же массы полностью реагирует с солью ртути массой 204 г. Определите неизвестный металл и вычислите молярную массу эквивалентов соли ртути в данной реакции.
68. При пропускании сероводорода через раствор, содержащий хлорид неизвестного металла массой 13,5 г, образовался осадок сульфида этого же металла массой 9,6 г. Определите неизвестный металл и вычислите объем (н. у.) прореагировавшего сероводорода.
69. Рассчитайте массу алюминия, необходимого для полного вытеснения ртути из раствора, в котором химическое количество эквивалентов нитрата ртути(I) равно 0,25 моль.
70. При сгорании металла массой 10,0 г образовался оксид этого металла массой 18,89 г. Определите степень окисления металла в полученном оксиде.
71. Неизвестный металл массой 12,0 г соединяется с кислородом массой 4,8 г. Тот же металл массой 5 г соединяется с одним из галогенов массой 20 г. Определите химические формулы образующихся при этом оксида и галогенида.
72. В результате взаимодействия оксида металла с серной кислотой образовались средняя соль массой 3,92 г и вода массой 0,54 г. Определите молярную массу эквивалентов металла и массу его нитрата, который можно получить из исходного оксида массой 5,00 г.
73. Металл, молярная масса эквивалентов которого равна 27,9 г/моль, вытеснил из раствора серной кислоты водород объемом 700 см3
(н. у.). Вычислите массу металла, вступившего в реакцию, и массу образовавшейся соли.
74. Молярная масса эквивалентов некоторого элемента равна 29,75 г/моль. Вычислите:
а) массовую долю кислорода в оксиде этого элемента;
б) объем водорода (н. у.), необходимого для восстановления указанного оксида массой 7,55 г.
75. Массовые доли галогена в галогениде металла и кислорода в оксиде того же металла равны соответственно 64,5 % и 15,4 % (степени окисления атомов металла в обоих соединениях одинаковы). Определите химическую формулу галогенида металла.
76. Хлорид неизвестного металла массой 5,85 г прореагировал полностью с сульфатом серебра, в результате чего образовался сульфат неизвестного металла массой 7,10 г. Чему равна масса образовавшегося при этом хлорида серебра? (Степени окисления атомов в ходе реакции не изменялись).
77. Неизвестный металл А массой 13 г вытеснил из раствора соли металл Б массой 23,74 г, который, в свою очередь, вытеснил из раствора кислоты водород объемом 5,03 дм3 при температуре 28 оС и давлении 99,5 кПа. Определите металлы А и Б.
78. Определить состав оксида металла, если известно, что это соединение массой 12,75 г реагирует полностью с серной кислотой, образуя сульфат металла массой 42,75 г. (степень окисления металла не изменяется). Чему равна масса образующейся при этом воды?
79. Химическое количество вещества, в состав которого входят натрий, сера и кислород, равно 0,5 моль. Чему равна масса кислорода, содержащегося в данной порции вещества, если массовые доли натрия и серы в нем равны соответственно 29,11 % и 40,51 %?
80. Определите химическое количество вещества, при полном разложении которого образовались аммиак массой 3,4 г, вода массой 3,6 г и углекислый газ объемом 4,48 дм3 (н.у).
81. Неизвестное органическое вещество массой 12 г сожгли в кислороде и получили углекислый газ объемом 13,44 дм3 (н. у.) и воду массой 14,4 г. Определите молекулярную формулу исходного вещества, если относительная плотность его паров по водороду равна 30.
82. При полном сгорании неизвестного вещества массой 7,3 г в кислороде были получены углекислый газ массой 17,6 г, вода массой 9,9 г и азот объемом 1,12 дм3 (н. у.). Определите молекулярную формулу вещества, если относительная плотность его паров по воздуху равна 2,517.
83. Одно из водородных соединений азота сожгли в кислороде и получили воду, масса которой в 1,286 раза больше массы образовавшегося при этом азота. Определите простейшую формулу исходного вещества.
84. При термическом разложении одного из оксидов марганца были получены оксид марганца Mn3O4 массой 22,9 г и кислород объемом 2,24 дм3 (н. у.). Определите простейшую формулу исходного оксида.
85. При одинаковых условиях плотность газообразного бороводорода равна плотности азота. Определите химическую формулу этого бороводорода, если массовая доля бора в нем равна 78,6 %.
86. В органическом веществе массовые доли элементов составляют: углерода – 37,21 %; водорода – 7,75 %; хлора – 55,04 %. Пар данного вещества массой 1,29 г при температуре 28 оС и давлении 100,05 кПа занимают объем, равный 0,5 дм3. Определите химическую формулу вещества.
87. Определите простейшую формулу вещества, в котором массовые доли элементов равны: калий – 26,53 %; хром – 35,37 %; кислород – 38,10 %.
88. В соединениях K2ХY3 и K2Х2Y3 массовые доли калия равны соответственно 49,37 % и 41,05 %. Определите элементы X и Y.
89. В неизвестном веществе массовая доля бора равна 40,74 %, водорода – 7,41 % и азота – 51,85 %. Пар этого вещества массой 6,78 г при температуре 60 оС и давлении 101,3 кПа занимает объем, равный 2,28 дм3. Определите молекулярную формулу соединения.
90. В соединении Ва (ХО3)2 массовая доля кислорода равна 25,07 %. Определите элемент X.
91. Кристаллогидрат сульфата натрия массой 32,2 г прокалили до полного обезвоживания, в результате чего был получен твердый остаток массой 14,2 г. Определите:
а) формулу кристаллогидрата;
б) мольную долю воды в кристаллогидрате;
в) массовую долю кислорода в кристаллогидрате.
92. В кристаллогидрате сульфида натрия массовая доля серы равна 13,33 %. Какова химическая формула кристаллогидрата?
93. В кристаллогидрате гидроксида бария массовая доля кислорода равна 50,79 %. Какую массу безводного гидроксида можно получить при полном разложении указанного кристаллогидрата массой 1 кг?
94. Неизвестное соединение водорода с азотом массой 0,24 г сожгли в кислороде, в результате чего образовались вода массой 0,27 г и азот объемом 168 см3 (н. у.). Определите молекулярную формулу исходного вещества, если плотность его паров при н. у. равна 1,429 г/ дм3.
95. Смесь метана с кислородом (взят в избытке) общим объемом 500 см3 (н. у.) подожгли. Полученную в результате реакции смесь газообразных продуктов привели к нормальным условиям, в результате чего ее объем уменьшился до 300 см3. Вычислите объемную долю кислорода в исходной смеси.
96. Неизвестное органическое вещество массой 0,145 г сожгли в кислороде, в результате чего образовались углекислый газ массой 0,330 г и вода массой 0,135 г. Определите молекулярную формулу исходного вещества, если относительная плотность его по водороду равна 29.
97. В результате полного сгорания вещества массой 9,00 г в кислороде образовались углекислый газ объемом 8,96 дм3 (н. у.), вода массой 9,0 г и оксид серы(IV) объемом 2,24 дм3. Определите молекулярную формулу исходного вещества, если относительная плотность его паров по кислороду равна 2,813.
98. Неизвестное бромсодержащее вещество массой 0,752 г сожгли в избытке кислорода, в результате чего образовались углекислый газ массой 0,352 г и вода массой 0,144 г. Бром, содержащийся в том же исходном веществе массой 1,255 г, был полностью переведен в бромид серебра, масса которого оказалась равной 2,510 г. Определите молекулярную формулу вещества, если относительная плотность его паров по кислороду равна 5,875.
99. При термическом разложении оксида марганца(IV) массой 0,435 г выделился кислород и образовался другой оксид марганца массой 0,382 г. Какова формула полученного оксида?
100. Неизвестное серосодержащее вещество массой 0,222 г сожгли в избытке кислорода, в результате чего образовались углекислый газ массой 0,396 г и вода массой 0,162 г. Вся сера, содержащаяся в исходном веществе, массой 0,074 г была переведена полностью в сульфат бария, масса которого оказалась равной 0,1165 г. Определите молекулярную формулу исходного вещества, если относительная плотность его паров по воздуху равна 5,1.
101. Какой объем (н. у.) озонированного кислорода, в котором объемная доля озона равна 10 %, необходим для полного сжигания пропана объемом 42 дм3 (н. у.)?
102. Неизвестное вещество сожгли в кислороде, в результате чего образовались углекислый газ объемом 1,680 дм3 (н. у.), вода массой 2,025 г и азот объемом 0,280 дм3. Определите молекулярную формулу исходного вещества, если известно, что относительная плотность его паров по воздуху равна 2,034, а объем кислорода, израсходованного на сжигание, составляет 2,940 дм3 (н. у.).
103. Какой объем воздуха (н. у.) необходим для полного сгорания смеси серы и угля общей массой 18,4 г, если в ней химическое количество серы в 2,5 раза больше химического количества угля?
104. Хлороводород объемом 13,44 дм3 (н. у.) полностью прореагировал со смесью магния и железа общей массой 10,4 г. Вычислите массовые доли солей в полученной смеси.
105. Хлороводород объемом 20,16 дм3 (н. у.) полностью прореагировал со смесью цинка, железа, магния и алюминия, в результате чего образовалась смесь солей общей массой 49,15 г. Найдите массу исходной смеси металлов.
106. В сплаве металлов на 1 атом цинка приходятся 2 атома алюминия. Найдите массу указанного сплава, при полном взаимодействии которого с хлоридом меди (II) образуется медь массой 12,8 г. Чему равна общая масса смеси образовавшихся солей?
107. В сплаве металлов химическое количество алюминия в 2,5 раза больше химического количества магния. Какая масса этого сплава должна быть растворена в соляной кислоте с целью получения водорода объемом 100 дм3 при температуре 19 oС и давлении 98,4 кПа?
108. Смесь карбонатов кальция и магния поместили в вакуумированный закрытый сосуд объемом 5 дм3 и прокалили до окончания реакций, в результате чего образовался твердый остаток массой 13,6 г. После охлаждения сосуда до 22 оС давление образовавшегося газа в нем составило 147,1 кПа. Рассчитайте массу исходной смеси солей.
1.2. ОСНОВНЫЕ КЛАССЫ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Все вещества делятся на простые и сложные. Простыми (гомоатомными) называются вещества, состоящие из атомов одного элемента, а сложными (гетероатомными) – состоящие из атомов двух или более элементов.
Названия простых веществ, как правило, совпадают с названиями соответствующих химических элементов, например литий, бор, сера. Исключение составляют углерод (простые вещества которого имеют названия – «алмаз», «графит», «карбин», «фуллерены») и кислород, одно из простых веществ которого имеет название озон.
Сложные неорганические вещества по составу подразделяются на двухэлементные (бинарные) и многоэлементные соединения.
Согласно принципам систематической номенклатуры химическая формула сложного вещества разделяется на условно электроположительную и условно электроотрицательную составляющие. Первая из них записывается в химической формуле вещества слева, а вторая – справа.
Название сложного вещества читается справа налево, т. е. вначале называется его электроотрицательная составляющая в именительном падеже, а затем электроположительная в родительном падеже.
Бинарные соединения
Названия бинарных соединений образуются из латинского корня названия более электроотрицательного элемента с суффиксом -ид- и русского названия менее электроотрицательного (т. е. электроположительного) элемента в родительном падеже. Если менее электроотрицательный элемент может находиться в различных степенях окисления, то степень окисления указывается в скобках римскими цифрами.
Галогениды: NaCl – хлорид натрия, HI – иодид водорода, OF2 – фторид кислорода (II), FeBr2 – бромид железа (II).
Оксиды:Al2O3 – оксид алюминия, P4O10 – оксид фосфора (V), СО – оксид углерода (II), Fe2O3 – оксид железа (III). Соединения, содержащие группы атомов 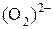 (–О–О–) называются пероксидами: Н2О2 – пероксид водорода, ВаО2 – пероксид бария.
(–О–О–) называются пероксидами: Н2О2 – пероксид водорода, ВаО2 – пероксид бария.
Халькогениды:(сульфиды, селениды, теллуриды): Al2S3 – сульфид алюминия, Cu2Sе – селенид меди (I), Na2Te – теллурид натрия.
Аналогично называются и другие бинарные соединения, например: фосфиды, типа Ca3P2; карбиды – CaC2; гидриды – MgH2 и др.
Исключением из указанных правил являются водородные соединения неметаллов, проявляющие свойства кислот. Их названия образуются по правилам, принятым для кислот (см. ниже).
К условно-бинарным (псевдобинарным) соединениям относят вещества ионного строения, в состав которых входят катионы аммония NH4+ (NH4Cl – хлорид аммония), амид-анионы NH2– (KNH2 – амид калия), имид-анионы NH2– (Na2NH – имид натрия). Сюда же относятся вещества, содержащие устойчивые группировки атомов разных элементов, например цианид-ионы – CN ˉ (KCN – цианид калия), катионы висмутил – BiO+, стибил – SbO+ (BiONO3 – нитрат висмутила, SbOBr – бромид стибила) и некоторые другие.
По функциональным признакам большинство указанных бинарных соединений являются солями или солеподобными соединениями, кроме оксидных и водородных соединений.
Оксиды подразделяются на несолеобразующие (индифферентные, безразличные) и солеобразующие. Несолеобразующие оксиды (CO, NO, N2O, SiO) не вступают при обычных условиях в реакции солеобразования ни с кислотами, ни с основаниями. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Многоэлементные соединения
К этому типу неорганических веществ относится большинство соединений, в состав которых входят электроположительные и электроотрицательные составляющие, содержащие атомы нескольких элементов. Это, например, основания, кислоты, соли.
Основаниями называются сложные вещества, в состав которых входят атомы металлов, связанные с гидроксогруппами.
Они являются твердыми кристаллическими веществами. Важнеейшее химическое свойство оснований – способность взаимодействовать с кислотами и кислотными оксидами с образованием солей. Основания, образованные щелочными (Li, Na, K, Rb, Cs) и щелочноземельными (Ca, Sr, Ba) металлами растворимы в воде и называются щелочами. Систематические названия этого типа соединений состоят из слова «гидроксид» и названия элемента в родительном падеже с указанием степени окисления его атомов (если она бывает переменной):
LiOH – гидроксид лития; Ва (ОН)2 – гидроксид бария;
Fe (OH)3 – гидроксид железа (III); Re (OH)4 – гидроксид рения (IV).
Кислоты – сложные вещества, в молекулах которых кислотные остатки связаны с атомами водорода, способными замещаться на атомы металлов.
Кислоты весьма разнообразны как по агрегатному состоянию (жидкие, твердые), так и по химическим свойствам. Большинство кислот хорошо растворимы в воде. Их важнейшее химическое свойство – способность образовывать соли при взаимодействии с основаниями и основными оксидами.
Число атомов водорода в молекуле кислоты, способных замещаться на металл, называется осно́вностью кислоты: HNO3 – одноосновная, H2SO4 – двухосновная, H3PO4 – трехосновная, H4P2O7 – четырехосновная, H5IO6 – пятиосновная, CH3COO H – одноосновная кислоты.
Неорганические кислоты делятся на кислородсодержащие (оксокислоты) типа H n ЭO m и бескислородные типа Н n X m, где Э – кислотообразующий элемент; Х – атомы галогенов, халькогенов и некоторых других элементов; n и m – числа соответствующих атомов в молекулах.
При замещении в молекулах оксокислот атомов кислорода на группы –О–О– образуются пероксокислоты (H2SO5 – пероксосерная кислота), а при замещении атомов кислорода на атомы серы – тиокислоты (H3PS4 – тиофосфорная кислота).
Традиционное название оксокислоты (табл. 1) состоит из двух слов – прилагательного от корня русского названия кислотообразующего элемента и группового слова «кислота», например сер ная кислота, бор ная кислота. Если элемент образует несколько кислот, то различие между ними регулируется с помощью суффиксов - н-, -ов - или -ев -, присоединяемых к корню русского названия элемента при высшей или единственной степени окисления, и суффиксов новат-, -ист-, -новатист - при промежуточных и низших степенях окисления. Например:
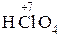 – хлор н ая кислота;
– хлор н ая кислота; 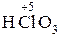 – хлор новат ая кислота;
– хлор новат ая кислота;
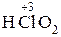 – хлор ист ая кислота;
– хлор ист ая кислота; 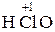 – хлор новатист ая кислота.
– хлор новатист ая кислота.
Соли представляют собой продукты замещения атомов водорода в кислотах на атомы металлов или продукты замещения групп ОН – в основаниях на кислотные остатки.
В зависимости от степени замещения атомов водорода в молекулах кислот или групп ОН– в формульных единицах оснований соли классифицируются на кислые (гидросоли) типа NaHSO3, Mg (HCO3)2; средние (нормальные) типаFe2(SO4)3, Na2CO3; оснóвные (гидроксосоли) типа Fe(OH)Cl, (CuOH)2CO3.
Таблица 1
| Традиционное название кислоты | Формула | Традиционное название средней соли |
| Борная | H3BO3 | Бораты |
| Угольная | H2CO3 | Карбонаты |
| Метакремниевая | H2SiO3 | Метасиликаты |
| Ортокремниевая | H4SiO4 | Ортосиликаты |
| Ортомышьяковая | H3AsO4 | Ортоарсенаты |
| Метамышьяковая | HAsO3 | Метаарсенаты |
| Ортомышьяковистая | H3AsO3 | Ортоарсениты |
| Ортофосфорная | H3PO4 | Ортофосфаты |
| Метафосфорная | HPO3 | Метафосфаты |
| Дифосфорная | H4P2O7 | Дифосфаты |
| Фосфористая | H3PO3 | Фосфиты |
| Фосфорноватистая | H3PO2 | Гипофосфиты |
| Азотная | HNO3 | Нитраты |
| Азотистая | HNO2 | Нитриты |
| Хромовая | H2CrO4 | Хроматы |
| Дихромовая | H2Cr2O7 | Дихроматы |
| Серная | H2SO4 | Сульфаты |
| Сернистая | H2SO3 | Сульфиты |
| Тиосерная | H2S2O3 | Тиосульфаты |
| Сероводородная | H2S | Сульфиды |
| Марганцовая | HMnO4 | Перманганаты |
| Марганцовистая | H2MnO4 | Манганаты |
| Хлорноватистая | HClO | Гипохлориты |
| Хлористая | HClO2 | Хлориты |
| Хлорноватая | HClO3 | Хлораты |
| Хлорная | HClO4 | Перхлораты |
| Хлороводородная (соляная) | HCl | Хлориды |
| Бромоводородная | HBr | Бромиды |
| Иодоводородная | HI | Иодиды |
| Фтороводородная (плавиковая) | HF | Фториды |
| Циановодородная (синильная) | HCN | Цианиды |
| Тиоциановая (родановодородная) | HNCS | Тиоцианаты (роданиды) |
Различают также двойные соли, образованные атомами двух металлов и остатками одной кислоты (KAl(SO4)2, NaCrSiO4); смешанные – образованные атомами одного металла и остатками двух кислот (CaCl(OCl) или CaOCl2, Sr(NO3)Cl); комплексные соли ([Ag(NH3)2]ClO4, K3[Fe(CN)6]).
Большинство неорганических солей представляют собой соединения с ионной кристаллической решеткой и относительно высокими температурами плавления и кипения. Многие соли хорошо растворимы в воде.
Традиционные названия солей (табл. 1) составляются из названий анионов в именительном падеже и названий катионов в родительном падеже. Название аниона включает корень русского или латинского названия кислотообразующего элемента с добавлением суффикса, соответствующего той или иной степени окисления атомов кислотообразующего элемента.
Если кислотообразующий элемент имеет только одну степень окисления, то добавляется суффикс -ат-:
Na2CO3 – карбон ат натрия; K2SiO3 – силик ат калия.
Если кислотообразующий элемент имеет две степени окисления, то при высшей степени окисления добавляется суффикс -ат-, а при низшей -ит-:
CaSO4 – сульф ат кальция, MgSO3 – сульф ит магния.
В случае анионов, соответствующих четырем разным степеням окисления кислотообразующего элемента, их названия образуются таким образом: для обозначения высшей степени окисления используются приставка пер- и суффикс -ат:
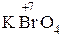 – пер бром ат калия.
– пер бром ат калия.
Затем (в порядке уменьшения степеней окисления) и без приставки используются суффиксы:
-ат: 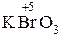 – бром ат калия;
– бром ат калия;
-ит: 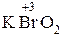 – бром ит калия.
– бром ит калия.
Для наименьшей положительной степени окисления используются приставка гипо- и суффикс -ит:
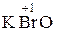 – гипо бром ит калия.
– гипо бром ит калия.
При построении традиционных названий кислых солей к названию аниона средней соли добавляется приставка гидро- и числовая приставка (ди-, три -), если количество атомов водорода в анионе больше
единицы:
KНСО3 – гидро карбонат калия;
Fe(H2PO4)2 – дигидро фосфат железа(II);
NaH3SiO4 – тригидро силикат натрия.
Гидроксосоли традиционно называют, добавляя к названию катиона металла приставку гидроксо- и числовую приставку, если число группп ОН, связанных а атомом металла, больше единицы:
(CuOH)2CO3 – карбонат гидроксо меди (II);
Al(OH)2NO3 – нитрат дигидроксо алюминия.
Названия двойных и смешанных солей строятся обычным образом. Единственная особенность при записи их формул – это постановка дефиса для разделения двух катионов или двух анионов:
двойные соли:KCr(SO4)2– сульфат хрома (III) -калия;
смешанные соли:Ca(ClO)Cl– хлорид-гипохлорит кальция;
Al(NO3)SO4 – сульфат-нитрат алюминия.
Задачи и упражнения
109. Напишите формулы оксидов, соответствующих указанным гидроксидам: H4SiO4, Cu(OH)2, H3AsO3, H6TeO6, Fe(OH)3, H2MnO4.
110. Составьте уравнения реакций, с помощью которых можно осуществить превращения:
а) Ba → BaO → BaCl2 → Ba(NO3)2 → BaSO4;
б) Mg → MgSO4 → Mg(OH)2 → MgO → MgCl2.
111. Какие из указанных газов поглощаются водными растворами щелочей: NO, HCl, H2S, CO, NO2, N2, Cl2, CH4, SO2, NH3? Напишите уравнения соответствующих реакций.
112. Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, K3PO4, BaCl2? Напишите уравнения реакций и назовите полученные соли.
113. С какими из перечисленных ниже веществ реагирует соляная кислота: В2O3, Zn(OH)2, CaO, AgNO3, SiO2, H3PO4? Составьте уравнения соответствующих реакций.
114. Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Zn(OH)2, P4O10? Составьте уравнения соответствующих реакций.
115. Напишите уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3. Назовите полученные вещества.
116. Напишите уравнения реакций, доказывающих кислотный характер SeO2, SO3, Mn2O7, P4O6, CrO3. Назовите полученные вещества.
117. Назовите соли: SbCl2NO3, [Fe(OH)2]2CrO4, (AlOH)SO4, Cd(HS)2, Ca(H2PO4)2, KAl(NO3)4.
118. Напишите уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия:
а) основных и кислотных оксидов;
б) оснований и кислотных оксидов;
в) основных оксидов и кислот;
г) оснований и кислот.
119. Назовите соли: Zn(CH3COO)2, NaH2SbO4, K2H2P2O7, Al(OH)2NO3, Na2Cr2O7, Ba(HSO3)2, (CrOH)SO4, NaHS.
120. Напишите формулы всех солей, которые могут образоваться при взаимодействии ортофосфорной кислоты с гидроксидом бериллия. Назовите эти соли.
121. Приведите примеры оксидов, которые при взаимодействии с водой образуют по две кислоты. Как взаимодействуют с охлажденным раствором гидроксида калия оксиды N2O3; N2O5; NO2?
122. Напишите уравнения реакций следующих двухстадийных превращений: Fe2O3 → Fe(ОН)3; Al(CH3COO)3 → Al2O3; CuSO4 → CuO; MnBr2 → MnO.
123. Как можно из одного оксида данного элемента получить его другой оксид, например: CuO из Cu2O; FeO из Fe2O3; P4O10 из P4O6; MnO2 из Mn2O7; NO2 из NO; СО из СО2; СО2 из СО?
124. На каких различиях в химических свойствах может быть основано выделение одного из оксидов из смесей: BaO и MgO; PbO и FeO; SiO2 и Na2O; MnO и ZnO; FeO и SiO2? Напишите уравнения соответствующих реакций.
125. Чем определяется основность кислот? Приведите примеры кислот разной основности и напишите их графические формулы. Каково строение молекулы фосфористой кислоты, если она является двухосновной?
126. Чем отличаются по составу молекул мета - и орто формы кислот? Покажите это на примерах соответствующих соединений фосфора и кремния. Напишите уравнения реакций взаимопревращений мета- и ортофосфорных кислот. В каких условиях они осуществляются?
127. Какие соединения образуются при дегидратации следующих кислот: HNO2; HClO; H3PO3; H2WO4; H3AsO4; HBO2; H2B4O7; HAsO3; H2S3O10; HClO4?
128. С какими из перечисленных веществ взаимодействует бромоводородная кислота: CaO; N2O3; AgNO3; Р2O5; Pb(NO3)2; CuSO4; FeS; Cu; MgCO3; Zn; NH3; Fe(OН)2?
129. Основные свойства какого гидроксида выражены сильнее и почему: As(OH)3 или Bi(OH)3; Sn(OH)2 или Sn(OH)4; Fe(OH)2 или Fe(OH)3; Ba(OH)2 или Be(OH)2?
130. Определите массу гидроксида натрия, который может быть получен из морской соли массой 1 т, если массовая доля хлорида натрия в ней составляет 95 %.
131. Склянку, в которой находился твердый гидроксид натрия массой 200 г, оставили открытой в сухом воздухе. Через некоторое время масса склянки увеличилась до 232,5 г за счет поглощения CO2 из воздуха. Чему равна массовая доля щелочи, превратившейся в карбонат? Чему равен объем (н. у.) поглотившегося при этом газа?
132. В каком объемном соотношении должны быть смешаны растворы Н3РО4 и NaOH с одинаковыми молярными концентрациями указанных веществ для получения растворов гидро- и дигидрофосфата натрия?
133. Напишите уравнения реакций, которые последовательно протекают при постепенном добавлении:
а) раствора NaOH к раствору гидросульфата цинка;
б) раствора серной кислоты к свежеосажденному гидроксиду алюминия.
134. Напишите уравнения реакций, при помощи которых перечисленные ниже соли могут быть переведены в средние: (CuOH)2SO4; Ca(HCO3)2; [Al(OH)2]2SO4; Cr(HSO4)2; (FeOH)NO3; KHS; (BiOH)SO4.
135. Какие из солей – Ва(NO3)Cl, KNa2PO4, Pb(CH3COO)2, (BiO)2SO4, Fe(OH)2NO3 – взаимодействуют в водном растворе:
а) с серной кислотой;
б) с гидроксидом натрия?
Назовите исходные соли и продукты возможных реакций.
136. Какими способами можно осуществить превращения:
а) Pb(NO3)2→ PbSO4; г) K2CrO4 → BaCrO4,
б) CuCl2 → CuSO4;д) NaAlO2 → Al2(SO4)3,
в) Fe2(SO4)3 → FeCl3; е) BaCO3 → BaCl2?
Напишите уравнения соответствующих реакций.
137. Напишите уравнения реакций, которые протекают в водном растворе между FeS и HCl; (CuOH)2CO3 и H2SO4; Ca(HCO3)2 и NaOH; NaHSO4 и NH3; Al(H2PO4)3 и Ca(OH)2.
138. Приведите примеры солей, при термическим разложении каждой из которых образуются по три оксида в разных агрегатных состояниях. Напишите уравнения соответствующих реакций.
139. Напишите уравнения реакций, которые протекают в водных растворах между следующими веществами: Ca(OH)2 и NO2; NH3 и SO2; CaCl2 и Na2HPO4; H2SO4 и (FeOH)SO4; CaHAsO3 и Ba(OH)2; Mg(HCO3)2 и Ca(OH)2; KAl(SO4)2 и KOH; NH4Cr(SO4)2 и BaCl2.
140. Напишите уравнения реакций следующих одно- и многостадийных превращений:
а) Fe2(SO4)3 → Fe2O3 → FeO → Fe(OH)2 → Fe2(SO4)3;
б) Al2(SO4)3 → AlCl3 → Al2O3 → K[Al(OH)4] → Al(OH)3;
в) Fe → FeCl2 → FeCl3 → (FeOH)SO4 → FeClSO4 → Fe2O3 → Fe;
г) ZnSO4 → ZnS → ZnO → (ZnOH)2SO4 → ZnCl2 → Zn;
д) Mg(NO3)2 → MgCl2 → (MgOH)2SO4 → MgO → Mg(HCO3)2.
1.3. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Термодинамика изучает закономерности обмена энергией между системой и внешней средой а также возможность, направление и пределы самопроизвольного протекания химических процессов.
Термодинамическая система (или простосистема) – объект или группа объектов, мысленно выделяемых в пространстве. Остальная часть пространства за пределами системы называется окружающей средой (или просто средой). Система отделена от среды реальной или воображаемой поверхностью.
Гомогенная система состоит из одной фазы, гетерогенная система – из двух или более фаз.
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам и отделенная от других частей системы поверхностью раздела.
Состояние системы характеризуется всей совокупностью ее физических и химических свойств. Независимые переменные, определяющие состояние системы, называются параметрами состояния. В качестве параметров состояния обычно выбирают температуру Т, давление р, объем V, химическое количество n, концентрацию с и т. д.
Физическая величина, значение которой зависит только от параметров состояния и не зависит от пути перехода к данному состоянию, называется функцией состояния. Функциями состояния являются, в частности:
U – внутренняя энергия;
Н – энтальпия;
S – энтропия;
G – энергия Гиббса (изобарно-изотермический потенциал).
Внутренняя энергия системы – U – это ее полная энергия, состоящая из кинетической и потенциальной энергии всех частиц системы (м
Дата добавления: 2015-07-25; просмотров: 443 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Произведение давления данной порции газа и его объема, отнесенное к абсолютной температуре газа, есть величина постоянная. | | | При различных сочетаниях знаков DrH и DrS 1 страница |