
|
Читайте также: |
В щелочных растворах концентрации ионов водорода ниже концентрации гидроксид-ионов:
с (Н+) < с (ОН–) и с (Н+) < 10–7 моль/дм3 (при 22 оС).
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их отрицательными десятичными логарифмами; эти величины обозначаются символами pH и pOH и называются соответственно водородным и гидроксидным показателями:
pH = – lg c (H+); pOH = – lg c (OH–).
С учетом этого для чистой воды и любого нейтрального раствора при 22 оС:
рН = – lg10–7 = 7; pOH = – lg10–7 = 7.
Таким образом, при 22 оС для чистой воды и нейтральных растворов pH = pOH = 7, а сумма pH + pOH = 14; для кислых растворов рН<7, а для щелочных растворов pH > 7.
Пример 1.6.3. Определите pHи рОН водного раствора серной кислоты, если ее молярная концентрация равна 0,020 моль/дм3.
Решение.
1.Найдем концентрацию ионов H+ в растворе:
Поскольку серная кислота – сильный электролит, то в разбавленном растворе она диссоциирует полностью: H2SO4 ® 2H+ + 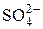 . Из этого уравнения видно, что концентрация ионов водорода в 2 раза больше концентрации кислоты:
. Из этого уравнения видно, что концентрация ионов водорода в 2 раза больше концентрации кислоты:
с (Н+) = 2 с (H2SO4) = 2 · 0,02 = 0,040 моль/дм3.
2.Найдем рН раствора:
pH = – lg с (H+) = – lg 0,04 = 1,4.
3.Из равенства pH + pOH= 14 следует, что:
pOH = 14 – 1,4 = 12,6.
Пример 1.6.4. Рассчитайте молярную концентрацию хлороводорода в растворе, если его водородный показатель равен 1,85.
Решение.
1.Зная рН раствора, найдем концентрацию ионов водорода в нем:
с (Н+) = 10– рН = 10–1,85 = 1,4 ∙ 10–2 моль/дм3.
2.Найдем концентрацию хлороводорода.
Поскольку хлороводород диссоциирует в растворе полностью по схеме:
HCl → H+ + Cl–,
то его концентрация равна концентрации ионов водорода. Поэтому:
с (HCl) = с (Н+) = 1,4 ∙ 10–2 моль/дм3.
Константа растворимости (произведение растворимости)
Если из пересыщенного раствора малорастворимого сильного электролита A х B y некоторая часть его выпала в осадок в виде кристаллов, то раствор над осадком при данных условиях является насыщенным относительно этого вещества. Между веществом в растворе (р) и кристаллическим осадком (к) устанавливается динамическое равновесие:
A х B y (к) ↔ х A y +(р) + y B x –(р).
Поскольку концентрация твердой фазы (осадка) с (K х A y)является величиной постоянной, математическое выражение константы данного равновесия имеет вид:
K = сx (A y +) · сy (B x –).
Такая константа [равновесия] называется константой растворимости (K s) или произведением растворимости (ПР) малорастворимого электролита:
K s (A х B y) = ПР (A х B y) = сx (A y +) · сy (B x –).
Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам в уравнении диссоциации, при данной температуре есть величина постоянная, называемая константой растворимости или произведением растворимости. Ее значения приводятся в справочных таблицах (приложение 3).
Произведение растворимости характеризует сравнительную растворимость однотипных малорастворимых сильных электролитов: чем больше ПР данного вещества, тем больше его растворимость.
Условие образования осадка: Осадок AхBy образуется, если произведение концентраций (ПК) ионов Ay+ и Bx –, каждая из которых возведена в степень соответствующего стехиометрического коэффициента, больше величины ПР (AхBy):
ПK = сx (A y +) · сy (B x –) > ПР (A х B y).
Раствор, в котором создается это условие, – пересыщенный относительно данного электролита, из такого раствора будет выпадать осадок.
Данное условие может достигаться, например, при смешивании растворов, содержащих достаточные количества ионов A y + и B x – или введении их дополнительных количеств в насыщенный раствор A х B y.
Условие растворения осадка: Осадок AхBy растворяется в воде, если в растворе над ним произведение концентраций (ПК) ионов Ay+ и Bx –, каждая из которых возведена в степень соответствующего стехиометрического коэффициента, меньше величины ПР (AхBy):
ПK = сx (A y +) · сy (B x –) < ПР (A х B y).
В данном случае раствор над осадком AхBy является ненасыщенным относительно этого вещества и его кристаллы будут растворяться в таком растворе.
Условия сx (A y +) · сy (B x –) < ПР (A х B y) можно достигнуть, например, при смешивании растворов, содержащих недостаточные количества ионов A y + и B x – или введении в раствор над осадком растворителя (воды). Можно также вводить в раствор над осадком вещества, которые связывают ионы A y + и B x –, образующиеся при переходе осадка в раствор.
По величине ПР может быть найден коэффициент растворимости (растворимость) s (моль/дм3) данного вещества. Для бинарных электролитов АВ их ПР и растворимость s связаны соотношением
ПР(АВ) = s 2(АВ).
Например, между осадком BaSO4 и его насыщенным раствором устанавливается динамическое равновесие:
BaSO4 (к) ↔ Ba2+(р-р) + 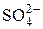 (р-р).
(р-р).
Из этого уравнения видно, что с (Ba2+) = c (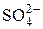 ) = s (BaSO4).
) = s (BaSO4).
Поскольку ПР(BaSO4) = с (Ba2+) · c (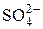 ), то справедливо выражение: ПР(BaSO4) = s 2 (BaSO4). Отсюда следует:
), то справедливо выражение: ПР(BaSO4) = s 2 (BaSO4). Отсюда следует:
s (BaSO4) = 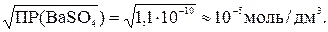
Пример 1.6.5. Произведение растворимости Ag2SO4 равно 1,6 ∙ 10–5 (25 оС). Определите растворимость этой соли в моль/дм3 и в г/дм3.
Решение.
1.Напишем схему равновесия между осадком и раствором и выражение для ПР данной соли:
Ag2SO4 (к) ↔ 2Ag+(р-р) + 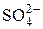 (р-р);
(р-р);
ПР(Ag2SO4) = с 2(Ag+) ∙ с (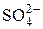 ).
).
2.Выразим концентрации ионов Ag+ и 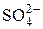 в растворе над осадком через его растворимость s (Ag2SO4).
в растворе над осадком через его растворимость s (Ag2SO4).
Поскольку из 1 моль Ag2SO4 образуются 2 моль ионов Ag+ и 1 моль ионов 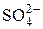 , то с (Ag+) = 2 s (Ag2SO4), а с (
, то с (Ag+) = 2 s (Ag2SO4), а с (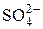 ) = s (Ag2SO4).
) = s (Ag2SO4).
3.Найдем искомую растворимость (моль/дм3) соли, подставив в уравнение для ее ПР концентрации ионов, выраженные через s (Ag2SO4):
ПР(Ag2SO4) = с 2(Ag+) ∙ с (SO42–) =
= [2 s (Ag2SO4)]2 · s (Ag2SO4) = 4 s 3(Ag2SO4).
Отсюда следует:
s (Ag2SO4) =  1,6 · 10–2 моль/дм3.
1,6 · 10–2 моль/дм3.
4.Найдем растворимость Ag2SO4 в г/дм3.
Поскольку молярная масса Ag2SO4 равна 312 г/моль, а химическое количество этой соли в растворе объемом 1 дм3 равно 1,6 · 10-2 моль, ее масса равна:
m (Ag2SO4) = 1,6·10–2 моль ∙ 312 г/моль ≈ 5 г.
Следовательно, растворимость сульфата серебра Ag2SO4 составляет 1,6 · 10-2 моль/дм3 или 5 г/дм3.
Пример 1.6.6. Растворимость PbI2 при 20 оС равна 6,5 · 10–4 моль/дм3. Рассчитайте ПР(PbI2) при указанной температуре.
Решение.
1.Напишем схему равновесия между осадком и раствором и выражение для ПР данной соли:
PbI2 (к) ↔ Pb2+(р-р) + 2I–(р-р); ПР(PbI2) = c (Pb2+) ∙ c 2(I–).
2.Найдем концентрации ионов в насыщенном растворе соли над ее осадком. Из схемы равновесия видно, что молярная концентрация ионов Pb2+ в растворе соли равна ее растворимости, а концентрация ионов I– – в 2 раза больше:
c (Pb2+) = s (PbI2) = 6,5 · 10–4 моль/дм3;
c (I–) = 2· s (PbI2) = 2 · 6,5 · 10–4 моль/дм3 = 1,3 · 10–3 моль/дм3.
3.Найдем величину ПР(PbI2), подставив в его выражение соответствующие концентрации ионов:
ПР(PbI2) = c (Pb2+) ∙ c 2(I–) = 6,5 · 10–4 · (1,3 · 10–3)2 = 1,1 ∙ 10–9.
Пример 1.6.7. Образуется ли осадок Ca3(PO4)2, если к раствору объемом 100 см3 с молярной концентрацией CaCl2, равной 3 · 10–5 моль/дм3 добавить раствор объемом 200 см3 с молярной концентрацией Na3РO4, равной 4,5 · 10–4 моль/дм3? ПР[Ca3(PO4)2] = 2,0 ∙ 10–29.
Решение.
1.Найдем новые молярные концентрации солей в растворе после смешивания исходных растворов. Исходим из простого правила: «Во сколько раз увеличился объем раствора, во столько раз уменьшилась молярная концентрация содержащегося в нем вещества». Математическая зависимость между объемами растворов и концентрациями веществ в них выражается так:
V исх · c исх = V нов · c нов,
где V исх – объем исходного раствора до смешивания; c исх – исходная концентрация вещества в нем; V нов – объем конечного раствора (после смешивания), c нов – новая концентрация того же вещества в конечном растворе.
В соответствии с этим новые концентрации солей после смешивания растворов составят:
c нов(CaCl2) = 
c нов(Na3РO4) = 

2.Найдем концентрации ионов Са2+ и  , образующих осадок, в новом растворе. Из уравнений диссоциации хлорида кальция и фосфата натрия
, образующих осадок, в новом растворе. Из уравнений диссоциации хлорида кальция и фосфата натрия
CaCl2 → Са2+ + 2Cl–; Na3РO4 → 3Na+ + 
следует, что
с нов(Са2+) = с нов(CaCl2) = 1 · 10–5 моль/дм3;
с нов( ) = с нов(Na3РO4) = 3 · 10–4 моль/дм3.
) = с нов(Na3РO4) = 3 · 10–4 моль/дм3.
3.Найдем произведение концентраций (ПК) ионов Са2+ и  , подставив их в выражение для ПР[Ca3(PO4)2]:
, подставив их в выражение для ПР[Ca3(PO4)2]:
Поскольку ПР[Ca3(PO4)2] = с 3нов(Са2+) · с 2нов(РO43–), то
ПК =  = (1 · 10–5)3 · (3 · 10–4)2 = 9 · 10–23.
= (1 · 10–5)3 · (3 · 10–4)2 = 9 · 10–23.
4.Поскольку найденное ПК ионов Са2+ и  в новом растворе оказалось больше справочного значения ПР[Ca3(PO4)2], равного 2,0 ∙ 10–29, осадок данной соли при смешивании исходных растворов образуется.
в новом растворе оказалось больше справочного значения ПР[Ca3(PO4)2], равного 2,0 ∙ 10–29, осадок данной соли при смешивании исходных растворов образуется.
Пример 1.6.8. Сопоставить растворимость (моль/дм3) AgCl при 25 оС в воде и в растворе NaCl, если его молярная концентрация составляет 0,10 моль/дм3, а ПР(AgCl) = 1,8 · 10–10.
Решение.
1.Запишем схему равновесия между осадком AgCl и его насыщенным раствором и выражение для ПР(AgCl):
AgCl(к) ↔ Ag+(р-р) + Cl–(р-р);
ПР(AgCl) = c (Ag+) · c (Cl–).
2.Выразим молярные концентрации ионов Ag+ и Cl– через растворимость s (АgCl) в чистой воде. Из схемы равновесия видно, что:
c (Ag+) = c (Cl–) = s (АgCl).
3.Найдем величину s (АgCl) в чистой воде, подставив в выражение ПР(AgCl) вместо концентраций ионов растворимость s (АgCl):
ПР(AgCl) = c (Ag+) · c (Cl–) = s 2(АgCl) = 1,8 · 10–10.
Отсюда находим:
s (АgCl) = 
4.Выразим концентрациию ионов c 1(Ag+) через растворимость AgCl в растворе NaCl, обозначив ее s 1(AgCl). Из схемы равновесия видно, что
c 1(Ag+) = s 1(AgCl).
5.Выразим концентрациию ионов c 1(Cl–) через растворимость AgCl в растворе NaCl. Ионы Cl– образуются как при диссоциации AgCl, так и при диссоциации NaCl. Поскольку растворимость AgCl очень низка, можно пренебречь концентрацией ионов Cl–, образующихся из него, и считать, что все ионы хлора, содержащиеся в растворе, образовались из NaCl. Тогда:
c 1(Cl–) = c (Cl–)(из AgCl) + c (Cl–)(из NaCl) ≈ c (Cl–)(из NaCl) ≈ 0,1 моль/дм3.
6.Найдем величину s 1(AgCl), подставив в уравнение для ПР(AgCl) концентрации ионов c 1(Ag+) и c 1(Cl–):
ПР(AgCl) = c 1(Ag+) · c 1(Cl–); 1,8 · 10–10 ≈ s 1(AgCl) · 0,1;
Отсюда находим: s 1(AgCl) ≈ 1,8∙10–9.
7.Сравним растворимость AgCl в воде и в растворе NaCl:
 раз.
раз.
Таким образом, растворимость AgCl в чистой воде больше его растворимости в растворе NaCl с указанной его концентрацией примерно в 7400 раз.
Гидролиз солей
Гидролиз соли – реакция обмена между солью и водой, в результате которой образуются слабодиссоциирующие частицы (молекулы или ионы). В результате гидролиза в водных растворах солей могут накапливаться катионы H+ или анионы OH–. По этой причине среда водных растворов солей может быть кислой или щелочной.
Гидролиз осуществляется за счет поляризационного взаимодействия катионов Kat x + или (и) An y - анионов солей с молекулами воды из своих гидратных оболочек:
Kat x + + H+(OH)– «(KatOH)(x – 1)+ + H+;
An y – + H+(OH)– «(HAn)(y –1)– + OH –.
Поляризующее влияние на молекулы воды невелико у катионов сильных оснований (катионы щелочных и щелочноземельных металлов), и у анионов сильных кислот (Cl–, Br–, I–, NO3–, ClO4–, ClO3–, MnO4–, SO42– и др.). Поэтому соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются. Среда растворов таких солей нейтральная, рН = 7.
Чем больше заряд и меньше радиус ионов, тем сильнее их поляризационное взаимодействие с водой, тем слабее диссоциация образующихся частиц (KatOH)( x –1)+ и (HAn)( y –1)–, тем интенсивнее протекает гидролиз и наоборот.
В зависимости от природы солей гидролиз может протекать по катиону, по аниону, по катиону и аниону одновременно.
По катиону гидролизуются соли, образованные слабыми основаниями и сильными кислотами, например CuCl2, NH4Br, Zn(NO3)2, и др.
Суть гидролиза в данном случае заключается в том, что катионы слабых оснований обратимо реагируют с молекулами воды по общей схеме:
Kat x + + H+(OH)– «(KatOH)(x – 1)+ + H+.
При этом в растворе накапливаются катионы H+ и раствор в результате становится кислым (рН < 7).
В качестве примера рассмотрим гидролиз хлорида меди(II) CuCl2. Он образован слабым двухкислотным основанием Cu(OH)2 и сильной кислотой HCl. В растворе эта соль необратимо диссоциирует, образуя ионы Cu2+ и Cl–:
CuCl2 ® Cu2+ + 2Cl–.
Ионы хлора по указанной выше причине с водой практически не взаимодействуют, а ионы Cu2+ обратимо реагируют с молекулами воды H+(OH)– по схеме:
Cu2+ + H+(OH)– ↔ (CuOH)+ + H+.
Это – уравнение гидролиза, записанное в сокращенной ионно-молекулярной форме.
Для написания уравнения в полной ионно-молекулярной форме в обе части вышеприведенного уравнения следует дописать формулы ионов, не реагирующих с водой, т. е. ионов Cl –. Своими отрицательными зарядами они должны уравновешивать положительные заряды катионов в уравнении
Cu2+ + 2 Cl – + H+(OH)– ↔ (CuOH)+ + + 2 Cl – + H+.
Чтобы написать уравнение в молекулярной форме, следует в обеих частях предыдущего уравнения соединить катионы и анионы в электронейтральные формульные единицы:
CuCl2 + HOH ↔ (CuOH)Cl + HCl.
Из этого уравнения видно, что в результате гидролиза хлорида меди (II) образуется основная соль – хлорид гидроксомеди(II) и соляная кислота, вследствие чего среда раствора – кислая.
Обратите внимание! Гидролиз солей, образованных многокислотными основаниями или многоосновными кислотами, может протекать в несколько стадий. Их число обычно равно заряду иона, реагирующего с молекулами воды. Так, например, гидролиз CuCl2 в принципе может протекать в 2 стадии, поскольку заряд катиона меди равен 2+. Однако на практике гидролиз таких солей почти всегда протекает только по первой стадии. Записанные выше 3 уравнения отражают в разных формах суть гидролиза именно по первой стадии.
По аниону гидролизуются соли, образованные сильными основаниями и слабыми кислотами, например K2CO3, Na2S, Na2SO3, K3PO4 и др.
Суть гидролиза в этом случае заключается в том, что анионы слабых кислот обратимо реагируют с молекулами воды по общей схеме:
An y – + H+(OH)– «(HAn)(y –1)– + OH –.
В качестве примера рассмотрим гидролиз карбоната калия K2CO3. Он образован сильным основанием KOH и слабой двухосновной угольной кислотой H2CO3. В растворе эта соль необратимо диссоциирует, образуя ионы K+ и CO32–:
K2CO3 ® 2K+ + CO32–.
Катионы калия по указанной выше причине с водой практически не взаимодействуют в отличие от ионов  , которые обратимо реагируют с молекулами воды H+(OH)– по схеме:
, которые обратимо реагируют с молекулами воды H+(OH)– по схеме:
CO32– + H+(OH)– ↔ (HCO3)– + ОH– .
Это – уравнение гидролиза, записанное в сокращенной ионно-молекулярной форме.
Еще раз обратите внимание! Несмотря на то, что заряд иона, реагирующего с водой, равен 2– и гидролиз поэтому может идти в 2 стадии, на практике он ограничивается только первой стадией!
Для написания уравнения в полной ионно-молекулярной форме в обе части вышеприведенного уравнения следует дописать формулы ионов, не реагирующих с водой, т. е. ионов K+. Своими положительными зарядами они должны уравновешивать отрицательные заряды анионов в уравнении
2K+ + CO32– + H+(OH)– ↔ 2K+ + (HCO3)– + ОH– .
Чтобы написать уравнение в молекулярной форме, следует в обеих частях предыдущего уравнения соединить катионы и анионы в электронейтральные формульные единицы:
K2CO3 + HOH ↔ KНCO3 + KOH.
Из этого уравнения видно, что в результате гидролиза карбоната калия образуется кислая соль – гидрокарбонат калия и щелочь KOH, вследствие чего среда раствора данной соли – щелочная.
По катиону и аниону гидролизуются соли, образованные слабыми основаниями и слабыми кислотами, например NH4NO2, Al2S3 и др.
В данном случае суть гидролиза заключается в том, что входящие в состав солей катионы слабых оснований и анионы слабых кислот одновременно реагируют с молекулами воды по схемам:
Kat x + + H+(OH)– «(KatOH)(x –1)+ + H+;
An y – + H+(OH)– «(HAn)(y –1)– + OH –.
Поскольку образующиеся одновременно ионы H+ и OH – соединяются в слабодиссоциирующие молекулы воды
H+ + OH – → Н2О,
то, согласно принципу Ле Шателье, вышеприведенные равновесия смещаются вправо, что приводит к усилению гидролиза. Поэтому как правило, соли, образованные слабыми основаниями и слабыми кислотами, гидролизуются намного интенсивнее, чем соли рассмотренных до этого двух типов. Среда растворов таких солей определяется силой образующихся слабых кислот и оснований и может быть слабокислой, если K дис (кисл.) > K дис (осн.); слабощелочной, если K дис (осн.) > K дис (кисл.); практически нейтральной, когда K дис (кисл.) ≈ K дис (осн.).
Гидролиз солей, образованных слабыми основаниями и слабыми кислотами, может протекать как обратимо, так и необратимо.
Гидролиз соли протекает обратимо, если образующиеся слабое основание и слабая кислота растворимы в воде и не уходят из раствора в виде осадка и (или) газа. В качестве примера рассмотрим гидролиз нитрита аммония NH4NO2. В водном растворе эта соль как сильный электролит практически полностью диссоциирует на катионы слабого основания и анионы слабой кислоты:
NH4NO2 → NH4+ + NO2–.
Эти ионы одновременно обратимо реагируют с молекулами воды, образуя слабое основание NH3 · H2O – гидрат аммиака («NH4OH») и слабую азотистую кислоту:
NH4+ + H+(OH)– ↔ NH3 · H2O + Н+;
NO2– + H+(OH)– ↔ HNO2 + OH–.
Приведенные уравнения отражают суть процессов в сокращенной ионно-молекулярной форме.
Равновесия этих обратимых процессов достаточно сильно смещены вправо из-за связывания ионов Н+ и OH –, однако полного смещения не происходит: при достижении определенных концентраций накапливающиеся в растворе продукты – кислота и основание – начинают реагировать между собой и смещение равновесий вправо прекращается.
Поскольку в данном случае и катионы и анионы реагируют с водой, для написания уравнения в полной ионно-молекулярной форме нужно сложить 2 вышеприведенных сокращенных уравнения, помня, что ионы Н+ и OH – образуют молекулу воды HOH:
NH4+ + HOH + NO2– + HOH ↔ NH3 · H2O + HNO2 + HOH.
Сократив обе части уравнения на 1 молекулу воды, получим искомое уравнение:
NH4+ + HOH + NO2– ↔ NH3 · H2O + HNO2.
Соответствующее уравнение гидролиза в молекулярной форме имеет вид:
NH4NO2 + HOH ↔ NH3 · H2O + HNO2.
Поскольку продукты гидролиза – «NH3 · H2O» и HNO2 хорошо растворимы в воде и, оставаясь в растворе, реагируют между собой, соль гидролизуется обратимо и не полностью.
Вследствие того, что константа диссоциации азотистой кислоты (4 · 10–4) больше, чем у гидрата аммиака (1,8 · 10–5), кислота диссоциирует несколько интенсивнее, чем основание, и среда раствора нитрита аммония является слабокислой.
Гидролиз соли протекает необратимо, если один или оба продукта реакции удаляются из раствора в виде осадка (малорастворимые слабые основания) или газа (летучие и неустойчивые слабые кислоты).
Дата добавления: 2015-07-25; просмотров: 85 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При различных сочетаниях знаков DrH и DrS 3 страница | | | При различных сочетаниях знаков DrH и DrS 5 страница |