
|
Читайте также: |
В качестве примера рассмотрим гидролиз сульфида алюминия Al2S3. В момент контакта с водой эта соль, как сильный электролит, необратимо диссоциирует, образуя катионы алюминия и сульфид-анионы:
Al2S3 → 2Al3+ + 3S2–.
Вследствие малых радиусов и больших зарядов эти ионы сильно поляризуют молекулы воды и одновременно реагируют с ними по схемам:
Al3+ + H+(OH)– ↔ (AlOH)2+ + H+;
S2– + H+(OH)– ↔ (HS)– + OH–.
Образующиеся ионы H+ и OH – сразу же соединяются в малодиссоциирующие молекулы воды. Однако, в отличие от предыдущего случая, указанные равновесия практически сразу же полностью смещаются вправо. Это происходит потому, что ионы (AlOH)2+ и (HS)– не успевают накапливаться в растворе, т. к. мгновенно реагируют далее с водой. При этом катионы (AlOH)2+ последовательно превращаются в ионы Al(OH)2+ и незаряженные частицы Al(OH)3,
(AlOH)2+ + HOH ↔ Al(OH)2+ + H+;
Al(OH)2+ + HOH ↔ Al(OH)3 + H+.
Анионы HS– превращаются в молекулы сероводорода H2S,
(HS)– + HOH ↔ H2S↑ + OH– .
Из-за связывания образующихся ионов H+ и OH – все указанные равновесия также практически полностью смещаются вправо, приводя к образованию слабого основания Al(OH)3 и слабой кислоты H2S. Гидроксид алюминия удаляется из раствора в виде осадка, а сероводород – в виде газа вследствие малой растворимости в воде.
Таким образом, сульфид алюминия гидролизуется необратимо, образуя продукты, уходящие из раствора в виде осадка и газа:
Al2S3 + 6НОН → 2Al(OH)3↓ + 3H2S↑.
В таких случаях принято записывать суммарное уравнение только в молекулярной форме.
Совместный гидролиз двух солей. Если одна соль образована сильным основанием и слабой кислотой, а другая – слабым основанием и сильной кислотой, то при совместном присутствии в растворе каждая их них необратимо гидролизуется до соответствующего слабого электролита (малорастворимого основания, слабой или неустойчивой кислоты).
Рассмотрим совместный гидролиз хлорида железа (III)FeCl3 и карбоната калия K2CO3, протекающий при смешивании растворов этих веществ. Поскольку соли – сильные электролиты, в растворах они полностью диссоциированы на ионы;
FeCl3 → Fe3+ + 3Cl–; K2CO3 → 2K+ + CO32–.
Содержащийся в первом растворе хлорид железа(III), образованный слабым основанием и сильной кислотой, обратимо гидролизуется по катиону (I стадия) с образованием ионов водорода (кислая среда):
Fe3+ + HOH ↔ (FeOH)2+ + H+.
Содержащийся во втором растворе карбонат калия, образованный сильным основанием и слабой кислотой, обратимо гидролизуется по аниону (I стадия) с образованием гидроксид-анионов OH– (щелочная среда):
CO32– + HOH ↔ (HCO3)– + ОH– .
При смешивании растворов указанных солей содержащиеся в них ионы H+ и OH – соединяются в молекулы воды. За счет этого вышеприведенные равновесия полностью смещаются вправо. Образующиеся при этом ионы (FeOH)2+ и (HCO3)– далее мгновенно реагируют с водой, образуя новые количества ионов H+ и OH –:
(FeOH)2+ + HOH ↔ Fe(OH)2+ + H+;
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+;
HCO3– + HOH ↔ H2CO3 + ОH–.
За счет соединения ионов H+ и OH – эти равновесия также практически полностью смещаются вправо. В результате ионы Fe3+ и CO32– превращаются в электронейтральные Fe(OH)3 и H2CO3. Гидроксид железа уходит из раствора в виде осадка, а неустойчивая угольная кислота – в виде газообразного CO2.
Из приведенных уравнений видно, что превращение одного иона Fe3+ в Fe(OH)3 в целом сопровождается образованием трех ионов H+, а превращение одного иона CO32– в H2CO3 – двух ионов ОН–:
1 Fe3+ + 3HOH ↔ 1Fe(OH)3 + 3 H+;
1 CO32– + 2HOH ↔ 1H2CO3 + 2 ОН–.
Поскольку в результате совместного гидролиза образуется нейтральный раствор, число ионов H+, возникающих при гидролизе одной соли, должно быть равно числу ионов ОН–, образующихся при гидролизе другой соли. Это равенство достигается тем, что в реакции совместного гидролиза на 2 иона Fe3+ приходятся 3 иона CO32–:
2Fe3+ + 6 HOH ↔ 2Fe(OH)3 + 6H+;
3CO32– + 6HOH ↔ 3H2CO3 + 6ОН–.
Суммируя два последних уравнения и учитывая при этом, что 6H+ + 6OH– = 6H2O, получаем уравнение совместного гидролиза в сокращенной ионно-молекулярной форме:
2Fe3+ + 6 HOH + 3CO32– + 6HOH → 2Fe(OH)3↓ + 3H2CO3 + 6H2O,
или после сокращения обеих частей уравнения на 6 молекул воды:
2Fe3+ + 3CO32– + 6HOH → 2Fe(OH)3↓ + 3H2CO3.
Для написания уравнения в полной ионно-молекулярной форме в обе части уравнения нужно добавить соответствующее количество ионов не реагирующих с водой ионов – 6 ионов K+ и 6 ионов Cl–:
2Fe3+ + 6Cl– + 6K+ + 3CO32– + 6HOH → 2Fe(OH)3↓ + 3H2CO3 + 6K+ +6Cl–.
Соединив в обеих частях данного уравнения катионы и анионы в электронейтральные частицы, получаем уравнение совместного гидролиза в молекулярной форме:
2FeCl3 + 3K2CO3 + 6HOH → 2Fe(OH)3↓ + 3H2CO3 + 6KCl.
Если образовавшиеся 3 молекулы H2CO3 разлагаются далее, образуя 3 молекулы СO2 и 3 молекулы воды, вычитаем последние из обеих частей уравнения и получаем другое уравнение в молекулярной форме:
2FeCl3 + 3K2CO3 + 3HOH → 2Fe(OH)3↓ + CO2↑ + 6KCl.
Совместный гидролиз солей препятствует протеканию между ними реакций обычного ионного обмена. Так, например, при смешивании растворов хлорида хрома(III) CrCl3 и сульфида калия K2S вместо ожидаемого сульфида Cr2S3 образуются Cr(OH)3 и H2S. По той же причине невозможно синтезировать в растворе и другие соли, например карбонаты алюминия и хрома(III).
Количественные характеристики гидролиза
Количественно гидролиз соли характеризуется степенью гидролиза и константой гидролиза.
Степень гидролизасоли – h – физическая величина, равная отношению числа ФЕ прогидролизовавшейся соли к общему числу ФЕ соли, внесенной в раствор:

Поскольку число ФЕ соли прямо пропорционально ее химическому количеству или молярной концентрации, степень гидролиза соли можно выражать и через указанные величины:

Константа гидролиза соли K h
1. Соль образована сильным основанием и слабой кислотой. Выведем константу гидролиза карбоната натрия Na2CO3. Эта соль гидролизуется по аниону:
CO32– + HOH ↔ (HCO3)– + ОH–.
Константа равновесия данного процесса выражается так:
K = 
Поскольку равновесная концентрация воды в растворе с (H2O) практически равна ее общей концентрации, т. е. является величиной постоянной (55,56 моль/дм3), последнее уравнение можно записать в виде:
K· с (H2O) = K h =  .
.
Поскольку  , подставив ее в предыдущее уравнение, получим:
, подставив ее в предыдущее уравнение, получим:
K h =  .
.
Учитывая, что  , окончательное выражение константы гидролиза Na2CO3 имеет вид:
, окончательное выражение константы гидролиза Na2CO3 имеет вид:
K h(Na2CO3) = 
Таким образом, константа гидролиза соли, образованной сильным основанием и слабой кислотой, – физическая величина, равная отношению константы воды к соответствующей константе диссоциации слабой кислоты, образовавшей эту соль.
При этом, как правило, порядок константы диссоциации (K I, K II, K III) слабой кислоты равен абсолютному значению заряда ее аниона, входящего в состав соли. Так, в рассмотренном выше примере используется константа диссоциации угольной кислоты по второй стадии (K II), поскольку заряд иона  равен 2–. В соответствии с этим константы гидролиза солей ортофосфорной кислоты выражаются так:
равен 2–. В соответствии с этим константы гидролиза солей ортофосфорной кислоты выражаются так:
K h(Na3PO4) =  , т. к. в состав соли входят ионы (PO4)3–;
, т. к. в состав соли входят ионы (PO4)3–;
K h(Na2HPO4) =  , т. к. в состав соли входят ионы (НPO4)2–;
, т. к. в состав соли входят ионы (НPO4)2–;
K h(NaH2PO4) =  , т. к. в состав соли входят ионы (Н2PO4)1–.
, т. к. в состав соли входят ионы (Н2PO4)1–.
2. Соль образована слабым основанием и сильной кислотой. Константа гидролиза соли, образованной слабым основанием и сильной кислотой, – физическая величина, равная отношению константы воды к соответствующей константе диссоциации слабого основания, образовавшего эту соль.
Например, константа диссоциации хлорида аммония имеет вид:
K h(NH4Cl) = 
3. Соль образована слабым основанием и слабой кислотой. Константа гидролиза соли, образованной слабым основанием и слабой кислотой, – физическая величина, равная отношению константы воды к произведению соответствующих констант диссоциации слабого основания и слабой кислоты, образовавших эту соль.
Например, константа диссоциации нитрита аммония имеет вид:
K h(NH4NO2) = 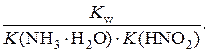
Величина константы гидролиза соли зависит от природы соли и температуры раствора:
а) чем меньше константа диссоциации слабого (ых) электролита (ов), образовавшего (их) соль, тем больше константа ее гидролиза, тем интенсивнее гидролизуется соль;
б) поскольку гидролиз соли – процесс эндотермический, то при повышении температуры константа гидролиза возрастает и соль гидролизуется интенсивнее.
Связь между степенью и константой гидролиза соли
Если соль гидролизуется только по катиону или только по аниону, степень и константа гидролиза связаны между собой уравнением, аналогичным уравнению Оствальда:
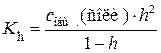 .
.
В случае, когда общая концентрация соли в растворе достаточно велика и степень ее гидролиза h << 1, выражение константы гидролиза можно записать:
 .
.
Отсюда: 
Из последней формулы следует правило:
Чем меньше концентрация соли в растворе, тем больше степень ее гидролиза, тем сильнее гидролизуется данная соль и наоборот.
Если соль гидролизуется одновременно и по катиону и по аниону, то концентрация соли в растворе практически не влияет на степень ее гидролиза:

Рассмотренные выше количественные характеристики гидролиза солей позволяют рассчитывать примерные значения рН их растворов.
Пример 1.6.9. Вычислить рН раствора гидрофосфата калия, если его молярная концентрация составляет 2 моль/дм3.
Решение.
1.Гидрофосфат калия K2HPO4, образованный сильным основанием (KOH) и слабой кислотой (H3PO4), гидролизуется по аниону:
 + HOH ↔ H2PO4– + OH–.
+ HOH ↔ H2PO4– + OH–.
Из-за образования ионов OH– среда раствора должна быть щелочной (рН > 7).
2.Используя справочные значения констант диссоциации фосфорной кислоты (приложение 2), найдем величину константы гидролиза соли:
K h(K2HPO4) = 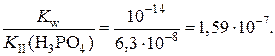
3.Рассчитаем примерное значение степени гидролиза соли:

4.Найдём концентрации гидролизующейся соли и ее анионов, реагирующих с водой:
Поскольку  то
то
 =
=
= 2 моль/дм3 · 2,82 · 10–4 = 5,64 · 10–4 моль/дм3.
Из уравнения диссоциации соли
K2HPO4 → 2K+ + HPO42–
видно, что концентрация реагирующих с водой ионов HPO42– равна концентрации гидролизующейся соли:
 = 5,64 · 10–4 моль/дм3.
= 5,64 · 10–4 моль/дм3.
5.Найдём рН раствора:
Из уравнения гидролиза следует, что концентрация ионов ОН– в растворе равна концентрации реагирующих с водой ионов HPO42–:
с(ОН)– = 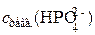 = 5,64 · 10–4 моль/дм3.
= 5,64 · 10–4 моль/дм3.
рОН = – lg с (ОН– ) = – lg5,64 · 10–4 моль/дм3 = 3,25;
pH = 14 – pOH = 14 – 3,25 = 10,75.
Вопросы для самостоятельной подготовки
Растворы электролитов
1. В чем состоит сущность теории электролитической диссоциации?
2. Приведите примеры сильных и слабых электролитов. В чем заключается их главное различие?
3. Почему деление электролитов на сильные и слабые является в определенной мере условным?
4. Чем различаются механизмы электролитической диссоциации в водных растворах веществ с ионным и ковалентным типами связей?
5. Что такое диэлектрическая постоянная растворителя и каково ее влияние на процесс диссоциации?
6. Как можно количественно охарактеризовать процесс электролитической диссоциации?
7. Что характеризует константа диссоциации слабого электролита? От каких факторов зависит ее величина?
8. От каких факторов зависит величина степени диссоциации электролита? Что она характеризует? Является ли степень диссоциации для данного электролита постоянной величиной? Почему?
9. Какова связь между степенью диссоциации и концентрацией слабого электролита в растворе?
10. Почему для характеристики диссоциации сильных электролитов применяют термин «эффективная (кажущаяся) степень диссоциации»?
11. Что такое активность и коэффициент активности ионов?
12. Дайте определения кислот, оснований и солей с точки зрения теории электролитической диссоциации.
13. В какую сторону сместится равновесие диссоциации уксусной кислоты при добавлении в ее раствор:
а) ацетата натрия;
б) воды;
в) хлороводорода;
г) гидроксида натрия?
14. Добавлением каких веществ в водный раствор аммиака можно усилить или ослабить электролитическую диссоциацию гидрата аммиака в водном растворе?
15. Какие электролиты диссоциируют постадийно? Почему величины констант диссоциации на каждой последующей стадии резко уменьшаются?
Диссоциация воды. Водородный показатель
16. Какова взаимосвязь между концентрациями ионов гидроксония и гидроксид-ионов в чистой воде и водных растворах?
17. Что такое константа воды и чему она равна при 22 оС? Почему эта величина зависит от температуры?
18. Как рассчитываются водородный и гидроксидный показатели растворов? Что они характеризуют? Как они связаны между собой?
19. В каких единицах выражаются концентрации ионов при расчете рН (рОН)?
20. Какие вещества используются в качестве кислотно-основных индикаторов? Как и при каких значениях рН изменяется окраска лакмуса, фенолфталеина и метилового оранжевого?
21. Перечислите условия, при которых реакции с участием электролитов протекают в растворах практически до конца.
22. Напишите в молекулярной и ионно-молекулярных формах уравнения реакций в растворах между:
а) углекислым газом, водой и карбонатом натрия;
б) фосфатом аммония и гидроксидом кальция (изб.);
в) сульфатом меди(II) и сероводородом;
г)алюминием и серной кислотой.
Гидролиз солей
23. Что такое гидролиз солей? Какие соли не гидролизуются?
24. Как влияют заряд и радиус ионов, входящих в состав соли, на ее гидролизуемость?
25. Каковы механизмы гидролиза солей по катиону и по аниону?
26. Какие соли и почему гидролизуются обратимо и практически по первой стадии?
27. Какие соли гидролизуются необратимо?
28. Что характеризует константа гидролиза соли? От каких факторов зависит ее величина?
29. Что характеризует степень гидролиза соли? От каких факторов зависит ее величина? Как она связана с константой гидролиза для солей разных типов?
30. Добавлением каких веществ можно ослабить или усилить процесс гидролиза хлорида цинка; карбоната калия? Напишите уравнения соответствующих процессов.
31. Какова среда водных растворов солей:
а) нитрата алюминия;
б) сульфида натрия;
в)гидрокарбоната кальция;
г)ацетата аммония?
Напишите соответствующие уравнения в ионно-молекулярных и в молекулярной формах.
32. Напишите математические выражения для констант гидролиза:
а) карбоната калия;
б) гидросульфида натрия;
в) сульфата аммония.
Произведение растворимости
(Константа растворимости)
33. Что называется произведением растворимости (константой растворимости) малорастворимого сильного электролита?
34. Для каких веществ неприменимо понятие ПР?
35. Напишите математическое выражение ПР для фторида кальция. Изменится ли величина ПР(CaF2) при добавлении в насыщенный раствор CaF2, находящийся над его осадком, следующих веществ:
а) фторида калия;
б) хлорида кальция.
Как добавление этих веществ влияет на коэффициент растворимости CaF2?
36. В каких единицах выражаются концентрации ионов при расчете величины ПР?
37. Каковы условия образования осадков малорастворимых сильных электролитов? Объясните, почему иногда при смешивании растворов нитрата свинца(II) и иодида калия осадок иодида свинца(II) не образуется, хотя в таблице растворимости он обозначен как малорастворимое вещество?
38. Сравнив соответствующие величины ПР, оцените возможность протекания реакций:
а) AgCl + KI = AgI + KCl, ПР(AgCl) = 1,8 ∙ 10–10;
б) AgI + KCl = AgCl + KI, ПР(AgI) = 1,1∙ 10–16;
39. Почему осадки солей слабых кислот обычно растворяются в сильных кислотах?
40. Почему сульфид меди(II), в отличие от сульфида марганца(II), нерастворим в соляной кислоте?
Задачи и упражнения
Т.Э.Д.
247. Напишите уравнения электролитической диссоциации следующих веществ: HNO3, H3PO4, H2SO4, CH3COOH, Ba(OH)2, Al(OH)3, Al2(SO4)3, KHSO4, Ba(OH)NO3, Fe(OH)Сl2.
248. Напишите в молекулярной и ионно-молекулярных формах уравнения реакций, протекающих в водных растворах между следующими соединениями:
а) BaCl2 + Al2(SO4)3 → д) KHS + H2SO4 →
б) Fe(OH)SO4 + BaCl2 → е)AgCl + NaI →
в) CaCO3 + CH3COOH → ж) FeCl3 + Na4[Fe(CN)6] →
г) Ca(HCO3)2 + HNO3 → з) Fe(NO3)2 + K3[Fe(CN)6] →
249. Определите молярные концентрации ионов в водных растворах следующих веществ с указанными значениями их молярных концентраций: HNO3 (0,1 моль/дм3); H2SO4 (0,05 моль/дм3); Ba(OH)2 (0,01 моль/дм3); AlCl3 (0,15 моль/дм3); Al2(SO4)3 (0,25 моль/дм3).
250. Используя справочные данные, рассчитайте молярные концентрации частиц Н+, NO2–, HNO2 в водном растворе азотистой кислоты, если ее общая молярная концентрация равна 1,2 моль/дм3.
251. Общая молярная концентрация слабой двухосновной кислоты в растворе равна 4,3 · 10–3 моль/дм3. Рассчитайте константу диссоциации указанной кислоты по первой стадии, если соответствующая ей степень диссоциации составляет 10 %?
252. При какой молярной концентрации уксусной кислоты в растворе доля ее непродиссоциировавших молекул составляет 90 %? K (СH3COOH) = 1,8 ∙ 10–5.
253. Молярные концентрации кислот HCl, H2SO4, HCOOH, CH3COOH в их растворах составляют по 0,1 моль/дм3. Рассчитайте молярные концентрации ионов водорода в этих растворах.
254. В раствор объемом 1,0 дм3 с молярной концентрацией CH3COOH, равной 1 моль/дм3, пропустили хлороводород объемом 2,24 дм3 (н. у.). Как изменились при этом молярная концентрация ионов Н+ и степень диссоциации уксусной кислоты? (Изменением объема раствора при растворении газа пренебречь.)
255. Определите степень диссоциации уксусной кислоты и молярную концентрацию ионов Н+ в растворе с массовой долей CH3COOH, равной 10 % (r = 1,04 г/см3).
256. Определите pHи рОН растворов, в которых молярные концентрации ионов Н+ равны: 0,050; 4,10 ∙ 10–3; 8,70∙10–11 моль/дм3.
257. Определите pH и pOHрастворов, в которых молярные концентрации ионов ОН– равны: 0,040; 1,80 ∙ 10–5; 6,40 ∙ 10–12 моль/дм3.
258. Определите pHследующих водных растворов:
а) 0,0020 М H2SO4;
б) 0,0010 М Ba(OH)2.
259. Определите pHводного раствора серной кислоты, если
w (H2SO4) = 1,0 %, а плотность раствора составляет 1,005 г/см3.
260. Определите pH и pOHводного раствора аммиака, в котором молярная концентрация гидрата аммиака равна 0,20 моль/дм3 NH3 ∙ H2O, а константа его диссоциации составляет 1,8 · 10–5.
261. Определите pH и pOH водного раствора уксусной кислоты, если w (CH3COOH) = 1,0 %, а плотность раствора составляет 1,02 г/см3.
262. Вычислите константу диссоциации слабой одноосновной кислоты, если ее молярная концентрация равна 0,20 моль/дм3, а рН раствора составляет 4,15.
263. Определите pH и pOHраствора, в котором молярная концентрация витамина C (слабой одноосновной аскорбиновой кислоты) составляет 0,15 моль/дм3. Константа диссоциации кислоты равна 8 ∙ 10–5.
264. Рассчитайтеконцентрацию ионов водорода в желудочном соке и в крови здорового человека, если pHэтих биологических жидкостей равен соответственно 1,5 и 7,4.
265. В раствор объемом 1,0 дм3 с молярной концентрацией уксусной кислоты, равной 0,20 моль/дм3, добавили твердый ацетат натрия массой 16,4 г. Как изменился при этом рН раствора? (Изменением объема раствора при добавлении соли пренебречь.)
266. Используя справочные данные (приложение 3), рассчитайте коэффициенты растворимости (моль/дм3 и г/дм3) солей AgCl, AgI и Ag2S.
267. Рассчитайте массу ионов Ag+, содержащихся в насыщенном растворе Ag2SO4 объемом 200 см3.
268. В насыщенном растворе PbCl2 объемом 200 см3 дополнительно растворили NaCl количеством 1,0 моль. Во сколько раз при этом уменьшилась молярная концентрация ионов Pb2+ в растворе? (Изменением объема раствора при растворении NaCl пренебречь).
269. В каком минимальном объеме воды можно растворить ортофосфат кальция массой 1 г, если ПР этой соли составляет 2,0 · 10–29?
270. Рассчитать массу иодида свинца(II), который может раствориться в воде объемом 5 дм3, если ПР данной соли составляет 1,1 · 10–9.
271. К раствору объемом 200 см3 с молярной концентрацией AgNO3, равной 2,5 ∙ 10–3 моль/дм3, добавили раствор объемом 300 см3, в котором молярная концентрация CaCl2 составляла 0,0050 моль/дм3. Образовался ли при этом осадок?
272. К раствору объемом 50 см3 с молярной концентрацией PbNO3)2, равной 2,5 ∙ 10–2 моль/дм3, добавили раствор объемом 150 см3, в котором молярная концентрация CaI2 составляла 0,0050 моль/дм3. Образовался ли при этом осадок?
273. К раствору объемом 250 см3 с молярной концентрацией AgNO3, равной 2,5 ∙ 10–3 моль/дм3, добавили раствор объемом 150 см3, в котором молярная концентрация Na2SO4 составляла 2,5 ∙ 10–2 моль/дм3. Образовался ли при этом осадок?
274. К раствору объемом 250 см3 с молярной концентрацией эквивалентов CaCl2, равной 2,2 ∙ 10–3 моль/дм3, добавили раствор объемом 250 см3, в котором молярная концентрация эквивалентов Na2SO4 составляла 4,4 ∙ 10–2 моль/дм3. Образовался ли при этом осадок?
275. Напишите уравнения гидролиза в ионно-молекулярных и молекулярной формах следующих солей: AlI3, K3PO4, ZnSO4, Al2(SO4)3, NH4CN, NH4HCO3, Al2Se3. Определите среду их растворов.
Дата добавления: 2015-07-25; просмотров: 97 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При различных сочетаниях знаков DrH и DrS 4 страница | | | При различных сочетаниях знаков DrH и DrS 6 страница |