
Читайте также:
|
Экспериментально установлено, что любой газ химическим количеством 1 моль, содержащий 6,02∙1023 молекул, при нормальных условиях (н. у.) – температуре 0 оС или 273 K, и давлении 101,325 кПа – занимает объем, равный 22,4 дм3. Этот объем, отнесенный к количеству газа, равному 1 моль, называется молярным объемом газа при н. у. и обозначается символом 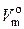 :
:
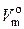 = 22,4 дм3/моль.
= 22,4 дм3/моль.
Следует помнить, что существует также понятие «молярный объем смеси газов». Эта величина обозначается 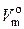 (газ. см.) и представляет собой объем смеси газов, сумма химических количеств которых равна 1 моль. Как и молярный объем индивидуального газа,
(газ. см.) и представляет собой объем смеси газов, сумма химических количеств которых равна 1 моль. Как и молярный объем индивидуального газа, 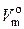 (газ. см.) равен примерно 22,4 дм3/моль.
(газ. см.) равен примерно 22,4 дм3/моль.
Понятию «молярный объем газовой смеси» соответствует понятие «средняя молярная масса газовой смеси». Эта величина обозначается
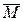 (газ. см.) и численно равна отношению массы данной смеси к сумме химических количеств всех находящихся в ней газов:
(газ. см.) и численно равна отношению массы данной смеси к сумме химических количеств всех находящихся в ней газов:
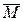 (газ. см.)
(газ. см.) 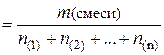 .
.
Физический смысл средней молярной массы газовой смеси: она численно равна массе смеси, в которой общее химическое количество газов равно 1 моль.
Средняя молярная масса газовой смеси связана с молярными массами образующих ее газов соотношением
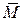 (газ. см.) = φ(Х) · М (Х) + φ(Y) · M (Y).
(газ. см.) = φ(Х) · М (Х) + φ(Y) · M (Y).
Здесь φ(X) и φ(Y) – объемные доли газов в смеси, М (X) и M (Y) – молярные массы газов. Объемная доля газа (φ) в смеси – величина, равная отношению объема газа Х к объему смеси:
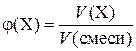 .
.
Как и массовая доля, она может выражаться в долях единицы или в процентах.
Поскольку в воздухе φ(О2) ≈ 0,21, а φ(N2) ≈ 0,78, то средняя молярная масса воздуха 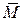 (возд.) составляет:
(возд.) составляет:
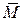 (возд) = φ(О2) · М (О2) + φ(N2) · M (N2) ≈ 0,21 · 32 + 0,78 · 28 ≈
(возд) = φ(О2) · М (О2) + φ(N2) · M (N2) ≈ 0,21 · 32 + 0,78 · 28 ≈
≈ 29 г/моль.
Следует помнить, что объемные доли (φ) газов в смеси численно равны их мольным долям (χ):
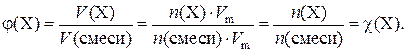
2. Плотность газа – ρ – величина, численно равная отношению его молярной массы к молярному объему при н. у.:
ρ(X)= 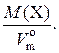
Единицы плотности газов – г/дм3, кг/м3 и т. п. Например, плотность кислорода при н. у. равна:
ρ(O2) = 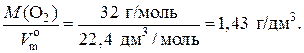
Физический смысл плотности газа в том, что она численно равна массе газа объемом 1 дм3 (н. у.).
Существует также понятие «плотность газовой смеси». Эта величина обозначается ρ(см.) и рассчитывается по формуле
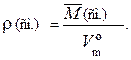
Например, плотность воздуха при н. у. равна:
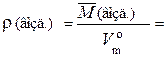
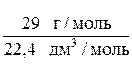 = 1,295 г/дм3.
= 1,295 г/дм3.
3. Относительная плотность газа Х по газу Y (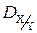 ) – величина, численно равная отношению молярных масс этих газов:
) – величина, численно равная отношению молярных масс этих газов:
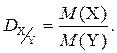
Относительная плотность одного газа по другому – величина безразмерная.
Физический смысл относительной плотности газа X по газу Y: она показывает, во сколько раз масса газа X при одних и тех же условиях больше массы газа Y, если их химические количества одинаковы:
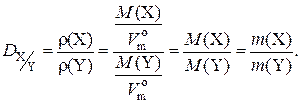
Наиболее часто при решении задач используются значения относительных плотностей газов по водороду и по воздуху, которые рассчитываются по формулам:
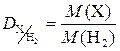 и
и 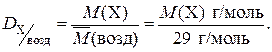
Дата добавления: 2015-07-25; просмотров: 131 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой. | | | При постоянной температуре произведение давления данной порции газа и его объема есть величина постоянная». |