
|
Читайте также: |
| Знак изменения функции | Принципиальная возможность и условия протекания реакции | ||
| D rH | D rS | D rG | |
| – | + | – | Возможна при любой температуре |
| + | – | + | Принципиально невозможна |
| – | – | ± | Возможна при низких температурах |
| + | + | ± | Возможна при высоких температурах |
Пример 1.3.4. Пользуясь справочными данными, установите, возможно ли восстановление оксида титана(IV) до свободного металла по схеме:
TiO2 (к) + 2С (графит) = Ti (к) + 2СО (г)
при температурах 298 K и 2500 K. Зависимостью D rH и D rS от температуры пренебречь.
Решение.
1) Вывод о возможности (невозможности) протекания реакции сделаем, проанализировав величину изменения энергии Гиббса в результате процесса. Для ее расчета воспользуемся уравнением Δ rG о = Δ rH o– T Δ rS o.
2) В приложении 1 найдем значения стандартных энтальпий образования и энтропий веществ:
| Вещество | TiO2 (к) | С (графит) | Ti (к) | СО (г) |
 , кДж/моль , кДж/моль
| –943,9 | –110,5 | ||
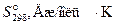
| 50,3 | 5,7 | 30,6 | 197,5 |
3) Рассчитаем стандартные значения изменения энтальпии и энтропии реакции при 298 K:
 = 2 · (–110,5) – (–943,9) = 722,9 кДж = 722900 Дж;
= 2 · (–110,5) – (–943,9) = 722,9 кДж = 722900 Дж;
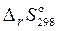 = 30,6 + 2 ∙ 197,5 – 50,3 – 2 ∙ 5,7 = 363,9 Дж/K.
= 30,6 + 2 ∙ 197,5 – 50,3 – 2 ∙ 5,7 = 363,9 Дж/K.
4) Рассчитаем стандартное изменение энергии Гиббса данной реакции при 298 K:
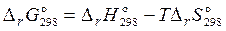 = 722900 – 298 · 363,9 = 614458 Дж.
= 722900 – 298 · 363,9 = 614458 Дж.
Поскольку  > 0, восстановление TiO2 при 298 K невозможно.
> 0, восстановление TiO2 при 298 K невозможно.
5) Рассчитаем  . Если в соответствии с условием пренебречь зависимостью
. Если в соответствии с условием пренебречь зависимостью  и
и  от температуры, то:
от температуры, то:
 = Δ rН о – T Δ rS o= 722900 – 2500 · 363,9 =
= Δ rН о – T Δ rS o= 722900 – 2500 · 363,9 =
= 722900 – 909750 = –186850 Дж.
 < 0, поэтому восстановление TiO2 графитом при 2500 K возможно.
< 0, поэтому восстановление TiO2 графитом при 2500 K возможно.
Вопросы для самостоятельной подготовки
1. Дайте определение понятиям: «система», «фаза», «окружающая среда».
2. Какие системы называются гомогенными, а какие – гетерогенными?
3. Что такое «параметр состояния», «функция состояния»?
4. Рассмотрите смысл понятий «внутренняя энергия системы» и «энтальпия». Приведите примеры реакций, у которых D H = D U и D H ≠ D U.
5. Какие факторы определяют величину изменения энтальпии реакции? Как зависит эта величина от энергии активации, пути и условия протекания процесса, присутствия катализаторов?
6. Могут ли быть экзотермичными процессы диссоциации молекул на атомы, ионы; эндотермичными – процессы образования молекул из атомов, радикалов, из других молекул?
7. Объясните смысл понятия «энтальпия образования вещества». Сформулируйте условия стандартизации этой характеристики. Чем отличаются стандартные условия от нормальных?
8. Сформулируйте закон Гесса. Какова связь между тепловым эффектом (энтальпией) реакции и энтальпией образования исходных веществ и продуктов реакции?
9. Дайте объяснение понятия «энтропия».
10. Не проводя расчетов, определите знак изменения энтропии в ходе следующих процессов:
а) 2H2 (г) + O2 (г) = 2H2O (г);
б) 2H2S (г) + 3O2 (г) = 2H2O (ж) + 2SO2 (г);
в) MgO (к) + CO2 (г) = MgCO3 (к);
г) лед ® вода ® пар;
д) CH3COOH (р-р) = CH3COOˉ (р-р) + H+ (р-р).
11. Дайте определение понятия «энергия Гиббса».
12. Каково соотношение между величиной изменения энергии Гиббса и величинами изменения энтальпии и энтропии системы?
13. Как D rG химической реакции используется в качестве критерия самопроизвольности ее протекания?
14. Возможны ли случаи, когда реакции с D rG < 0 практически не идут? Дайте объяснение.
15. Учитывая роль энтальпийного и энтропийного факторов и температуры в определении величины D rG, выделите четыре общих типа реакций, различающихся возможностью и температурными условиями их самопроизвольного протекания.
Задачи и упражнения
141. Поясните смысл понятий: «стандартные условия», «стандартное состояние», «стандартное значение термодинамической величины».
142. Что называют внутренней энергией системы? Почему в термодинамических расчетах используют не абсолютные значения внутренней энергии U, а ее изменение D U при переходе системы из одного состояния в другое?
143. Что называют тепловым эффектом реакции? Какие уравнения химических реакций называют термохимическими? Какой закон является основным законом термохимии? Дайте его формулировку.
144. Что называют энтальпией? Какая связь существует между изменением энтальпии и тепловым эффектом химического процесса?
145. Какой функцией состояния характеризуется тенденция системы к достижению так называемого наиболее вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц?
146. Как изменяется энтропия системы с повышением температуры; в реакциях синтеза и разложения веществ?
147. Как изменяется энтропия системы при испарении, конденсации, увеличении давления, фазовых переходах?
148. Какими одновременно действующими факторами определяется направленность химического процесса?
149. При соединении железа массой 2,1 г с серой выделилось 3,77 кДж. Рассчитайте энтальпию образования сульфида железа(II).
150. Определите стандартную энтальпию образования ( ) РН3, исходя из уравнения:
) РН3, исходя из уравнения:
2PH3 (г) + 4О2 (г) = Р2О5 (к) + 3Н2О (ж); 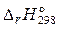 = –2360 кДж.
= –2360 кДж.
151. Исходя из теплового эффекта реакции:
6СаО (к) + Р4О10 (к) = 2Са3(РО4)2 (к);  = –1478 кДж,
= –1478 кДж,
определите  ортофосфата кальция.
ортофосфата кальция.
152. Вычислите и сравните  реакций восстановления оксида железа(III) различными восстановителями при 298 K:
реакций восстановления оксида железа(III) различными восстановителями при 298 K:
а) Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г);
б) Fe2O3 (к) + 3С(графит) = 2Fe (к) + 3СО (г);
в) Fe2O3 (к) + 3СО (г) = 2Fe (к) + 3СО2 (г).
153. Вычислите значения  для протекающих в организме реакций превращения глюкозы:
для протекающих в организме реакций превращения глюкозы:
а) С6Н12О6 (к) = 2С2Н5ОН (ж) + 2СО2 (г);
б) С6Н12О6 (к) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
Какая из этих реакций поставляет организму больше энергии?
154. Не производя вычислений, установите знак D rS о следующих процессов:
а) 2NH3 (г) = N2 (г) + 3H2 (г);
б) СО2 (к) = СО2 (г);
в) 2NO (г) + O2 (г) = 2NO2 (г);
г) 2H2S (г) + 3O2 (г) = 2H2O (ж) + 2SO2 (г);
д) 2СH3OH (г) + 3O2 (г) = 4H2O (г) + 2СО2 (г).
155. Не производя вычислений, укажите, для каких из перечисленных процессов изменение энтропии положительно:
а) СuO (к) + H2 (г) = Cu (к) + H2O (ж);
б) С(графит) + СО2 (г) = 2СО (г);
в) СН3СООН (р-р) = СН3СОО– (р-р) + Н+ (р-р);
г) 4НCl (г) + О2 (г) = 2Cl2 (г) + 2Н2О (г);
д) NH4NO3 (к) = N2O (г) + 2Н2О (г)?
156. Установите, протекание каких из нижеследующих реакций возможно в стандартных условиях при 25 оС:
а) N2 (г) + ½ О2 (г) = N2O (г);
б) 4HCl (г) + О2 (г) = 2Cl2 (г) + 2Н2О (ж);
в) Fe2O3 (к) + 3СО (г) = 2Fe (к) + 3СО2 (г)?
157. Какие из нижеприведенных реакций и при каких температурах (высоких или низких) могут протекать самопроизвольно:
а) 2N2 (г) + О2 (г) = 2N2O (г);  > 0;
> 0;
б) N2 (г) + О2 (г) = 2NO (г);  > 0;
> 0;
в) 2NO (г) + O2 (г) = 2NO2 (г);  < 0;
< 0;
г) NO (г) + NO2 (г) = N2O3 (г);  < 0;
< 0;
д) N2 (г) + 2О2 (г) = 2NO2 (г);  > 0?
> 0?
1.4. ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Факторы, влияющие на скорость
химической реакции
Скорость гомогенной реакции – это величина, численно равная изменению молярной концентрации любого из веществ, участвующих в реакции в единицу времени.
Средняя скорость реакции v срв интервале времени от t 1до t 2
определяется соотношением:
 .
.
Основные факторы, влияющие на скорость гомогенной химической реакции:
· природа (состав и строение) реагирующих веществ;
· концентрации реагентов;
· давление (если в реакции участвуют газы);
· температура;
· наличие катализатора.
Все химические реакции по стадийности подразделяются на элементарные (одностадийные) и сложные (многостадийные). Большинство химических реакций представляет собой сложные процессы, протекающие в несколько стадий, т. е. состоящие из нескольких элементарных процессов.
Для элементарных реакций справедлив закон действующих масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам.
Для элементарной реакции а А + b B →... ее скорость согласно закону действующих масс выражается уравнением:
 ,
,
где с (А)и с (В) — молярные концентрации реагирующих веществАиВ; k – константа скорости данной реакции. Физический смысл константы скорости:она численно равна скорости химической реакции при концентрациях реагентов c (А)и c (В) = 1 моль/дм3. Величина константы скорости гомогенной реакции зависит от природы реагирующих веществ, температуры и наличия катализатора.
Большинство химических реакций являются сложными, протекающими через множество промежуточных стадий. В таком случае закон действующих масс применим только к каждой отдельной стадии, а скорость реакции в целом определяется скоростью самой медленной уу стадии.
В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации не всех реагентов, а только газообразных или растворенных. Так, для реакции горения угля С (к) + О2 (г) → СО2 (г) уравнение скорости имеет вид 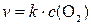 .
.
Пример 1.4.1. Константа скорости реакции 2NO (г) + O2 (г) → 2NO2 (г) при некоторой температуре равна 0,8. Рассчитайте:
а) начальную скорость реакции, если начальные концентрации реагирующих веществ равны: c 0(NO) = 0,4 моль/дм3, c 0(O2) = 0,3 моль/дм3;
б) скорость этой реакции в момент, когда количество NO в системе уменьшится на 25 %.
Решение.
1) Рассчитаем скорость данной реакции в первоначальный момент (v 0), подставив в выражение закона действующих масс начальные концентрации (c 0) веществ:
 моль/(дм3 ∙ с).
моль/(дм3 ∙ с).
2) Найдем изменение концентрации оксида азота(II) Δ c (NO):
Поскольку количество NO уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Поэтому:
Δ c (NO) = 0,25 ∙ c 0(NO) = 0,25 ∙ 0,4 моль/дм3 = 0,1 моль/дм3.
3) Из уравнения реакции найдём соответствующее изменение концентрации кислорода:
Δ c (O2) = Δ c (NO): 2 = 0,1: 2 = 0,05 моль/дм3.
4) Найдем новые концентрации (с 1) реагирующих веществ:
с 1(NO) = с 0(NO) – Δ c (NO) = 0,4 – 0,1 = 0,3 моль/дм3;
с 1(O2) = с 0(O2) – Δ c (O2) = 0,3 – 0,05 = 0,25 моль/дм3.
5) Рассчитаем новое значение скорости реакции:
 моль/(дм3 ∙ с).
моль/(дм3 ∙ с).
Пример 1.4.2. Как изменится скорость реакции
2NO (г) + Cl2 (г) → 2NOCl (г), если:
а) увеличить давление в реакционном сосуде в 2 раза;
б) уменьшить объем сосуда в 4 раза?
Решение.
1) Обозначив начальные концентрации NO и Cl2 как с 0(NO) и с 0(Cl2), запишем выражение для скорости реакции в начальный её момент:
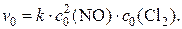
2) Поскольку давление в системе увеличивается в 2 раза, концентрации всех газообразных веществ в ней также увеличиваются в 2 раза и составляют:
c 1(NO) = 2 c 0(NO), c 1(Cl2) = 2 c 0(Cl2).
3) Учитывая, что константа скорости реакции k при увеличении давления не изменяется, подставим найденные новые значения концентраций c 1(NO) и c 1(Cl2) в выражение закона действующих масс:
 =
=  =
=
= 8 · k · c 02(NO) · c0(Cl2).
4) Найдем, во сколько раз v 1 больше v 0:
 .
.
Следовательно, при увеличении давления в системе в 2 раза скорость реакции увеличится в 8 раз.
5) Поскольку при уменьшении объема сосуда в 4 раза концентрации всех содержащихся в нем газов увеличиваются в 4 раза, новые концентрации NO и Cl2 будут равны:
c 1(NO) = 4· c 0(NO), a c 1(Cl2) = 4· c 0(Cl2).
6) Выполнив подстановку и расчеты, как в пунктах 3 и 4, получим  , т. е. уменьшение объема сосуда в 4 раза приведет к увеличению скорости реакции в 64 раза.
, т. е. уменьшение объема сосуда в 4 раза приведет к увеличению скорости реакции в 64 раза.
Влияние температуры на скорость химической реакции
Зависимость скорости реакции от температуры приближенно
определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость химических реакций увеличивается в 2 – 4 раза:
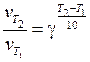 ,
,
где  – скорости реакции соответственно при температурах Т 2 и Т 1;γ– температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость данной реакции при повышении температуры на каждые 10°. Он вычисляется для каждой реакции из экспериментальных данных и в большинстве случаев принимает значения от 2 до 4. При ∆ Т ≤ 100 о значение γ практически не зависит от температуры, т. е. является для данной реакции постоянной величиной.
– скорости реакции соответственно при температурах Т 2 и Т 1;γ– температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость данной реакции при повышении температуры на каждые 10°. Он вычисляется для каждой реакции из экспериментальных данных и в большинстве случаев принимает значения от 2 до 4. При ∆ Т ≤ 100 о значение γ практически не зависит от температуры, т. е. является для данной реакции постоянной величиной.
С помощью правила Вант-Гоффа можно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции от температуры осуществимо в рамках теории активации Аррениуса.
В теории активации влияние температуры и катализатора на скорость химической реакции описывается следующим уравнением для константы скорости химической реакции:
 ,
,
где А – постоянный множитель, не зависящий от температуры, определяющийся природой реагирующих веществ; R – молярная газовая постоянная; Е а – энергия активации реакции; е – основание натуральных логарифмов. Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации реакции.
Пример 1.4.3. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастет скорость этой реакции при увеличении температуры в реакционном сосуде от 15 оС до 38 оС?
Решение:
В соответствии с правилом Вант-Гоффа:
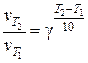 ;
;  = 5,5.
= 5,5.
Примечание. Если в вашем калькуляторе отсутствует кнопка возведения в степень, то такие арифметические вычисления можно осуществлять через стадии логарифмирования и последующего потенциирования:
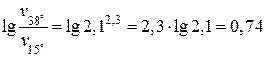 , а
, а  .
.
Химическое равновесие
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Они осуществляются только в одном направлении. Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми.
В момент начала обратимой реакции концентрации исходных веществ максимальны, а концентрации продуктов реакции равны 0. С течением времени концентрации исходных веществ и скорость прямой реакции постепенно уменьшаются, а концентрации продуктов и скорость обратной реакции постепенно увеличиваются. Однако через определенное время наступает такое состояние системы, при котором скорости прямой и обратной реакции оказываются одинаковыми ( ). Такое состояние называется состоянием химического равновесия.
). Такое состояние называется состоянием химического равновесия.
В момент, когда устанавливается равновесие, изменение концентраций всех веществ прекращается. Концентрации веществ, находящихся в равновесной системе, называются равновесными концентрациями (с р). В общем случае для любой обратимой реакции а А + b B ↔ d D + e E, независимо от ее механизма, выполняется соотношение:
 .
.
При установившемся равновесии произведение равновесных концентраций продуктов реакции, отнесенное к произведению концентраций исходных веществ, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия (K).
Пример 1.4.4. Найдите величину константы химического равновесия реакции 2А (г) + В (г) ↔ 2D (г), если начальные концентрации веществ А и В были равны соответственно 0,6 моль/дм3 и 0,4 моль/дм3, а к моменту наступления равновесия количество вещества В уменьшилось на 25 %. Рассчитайте изменение давления в системе по сравнению с первоначальным, если в исходной смеси вещество D отсутствовало.
Решение.
1) Запишем выражение константы равновесия для данной реакции:
 .
.
2) Определим равновесную концентрацию вещества В:
Поскольку к моменту наступления равновесия количество вещества В в системе уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Следовательно,
D с (В) = 0,25 ∙ с 0(В) = 0,25 ∙ 0,4 = 0,1 моль/дм3.
Тогда равновесная концентрация вещества В равна:
c р(В) = c 0(В) – D c (В) = 0,4 – 0,1 = 0,3 моль/дм3.
3) Определим равновесную концентрацию вещества А:
В соответствии с уравнением реакции D c (А) = 2D c (В) = 2 · 0,1 =
= 0,2 моль/ дм3. Следовательно, равновесная концентрация вещества А равна: c р(А) = c 0(А) – D c (А) = 0,6 – 0,2 = 0,4 моль/дм3.
4) Определим равновесную концентрацию вещества D:
В соответствии с уравнением реакции количество образовавшегося вещества D равно количеству прореагировавшего вещества А, поэтому D c (D) = 0,2 моль/дм3. Так как в первоначальный момент вещество D отсутствовало, то равновесная концентрация D равна:
c р(D) = 0 + D c (D) = 0 + 0,2 = 0,2 моль/дм3.
5) Подставим найденные равновесные концентрации веществ А, В и D в выражение для константы равновесия и рассчитаем искомую величину K:

6) Поскольку давление в системе в начальный момент реакции (р 0) и в момент наступления равновесия (р 1) пропорционально суммарной концентрации газообразных веществ, можно записать:
 .
.
Таким образом, давление в равновесной системе будет составлять 90 % от исходной величины.
Пример 1.4.5. В системе А (г) + В (г) ↔ 2D (г) равновесные концентрации равны: c р(А) = 0,4 моль/дм3; c р(В) = 0,9 моль/дм3; c р(D) =
= 0,6 моль/дм3. Найдите константу равновесия реакции и начальные концентрации (c 0) веществ А и В, если вещество D в начальный момент реакции отсутствовало.
Решение.
1) Запишем выражение константы равновесия для данной реакции и рассчитаем ее величину:

2) Учитывая, что в момент начала реакции вещество D отсутствовало, найдем изменения концентраций (Δ с) веществ А и В. Из уравнения реакции следует, что на образование 2 моль вещества D необходимо по 1 моль веществ А и В. Поскольку концентрация образовавшегося вещества D равна 0,6 моль/дм3, то концентрации исходных веществ А и В уменьшились на 0,3 моль/дм3, т. е. Δ с (А) = Δ с (В) = 0,3 моль/дм3.
3) Найдем начальные концентрации исходных веществ:
c 0(А) = c р(А) + Δ с (А) = 0,4 + 0,3 = 0,7 моль/дм3;
c 0(В) = c р(В) + Δ с (В) = 0,9 + 0,3 = 1,2 моль/дм3.
Влияние изменения внешних условий на положение
химического равновесия. Принцип Ле Шателье
Изменение условий (температуры, давления, концентраций), при которых система находится в состоянии химического равновесия ( ), вызывает нарушение равновесия. В результате неодинакового изменения скоростей прямой и обратной реакций (
), вызывает нарушение равновесия. В результате неодинакового изменения скоростей прямой и обратной реакций ( ) c течением времени в системе устанавливается новое химическое равновесие
) c течением времени в системе устанавливается новое химическое равновесие  , соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом, или смещением положения равновесия.
, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом, или смещением положения равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, то равновесие сместится в сторону той из двух противоположных реакций, которая ослабляет это воздействие.
Пример 1.4.6. В какую сторону сместится положение химического равновесия в системе
CaCO3 (к) «CaO (к) + CO2 (г);  = 178,4 кДж:
= 178,4 кДж:
а) при введении в систему углекислого газа;
б) при введении в систему оксида кальция;
в) при увеличении давления;
г) при увеличении температуры?
Решение.
В соответствии с принципом Ле Шателье равновесие в системе сдвигается таким образом, чтобы уменьшить внешнее воздействие. Поэтому:
а) введение углекислого газа приводит к повышению концентрации CO2. Для ослабления этого воздействия равновесие в системе должно сместиться влево;
б) введение твердого оксида кальция не изменяет концентрацию СаО в фазе СаО (к), и химическое равновесие не смещается;
в) увеличение давления приводит к увеличению концентрации CO2 (г) и практически никак не влияет на концентрации твердых компонентов. Равновесие сдвигается влево;
г) увеличение температуры может быть компенсировано эндотермическим процессом. Поскольку с поглощением тепла протекает прямая реакция, равновесие в системе смещается вправо.
Вопросы для самостоятельной подготовки
Дата добавления: 2015-07-25; просмотров: 125 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общее давление смеси газов, не вступающих в химическое взаимодействие, равно сумме парциальных давлений каждого из указанных газов. | | | При различных сочетаниях знаков DrH и DrS 2 страница |