
Читайте также:
|
В общем виде математическое выражение этого закона для химической реакции
a A + b B → c C + d D 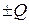
имеет вид
[ m (A) + m (B)] = [ m (C) + m (D)] 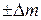 ,
,
где 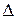 m – изменение массы за счет выделения или поглощения теплоты (энергии), происходящее в соответствии с уравнением А. Эйнштейна
m – изменение массы за счет выделения или поглощения теплоты (энергии), происходящее в соответствии с уравнением А. Эйнштейна 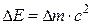 , где
, где 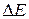 – изменение энергии (в данном случае – тепловой эффект реакции);
– изменение энергии (в данном случае – тепловой эффект реакции); 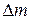 – изменение массы; с – скорость света в вакууме, равная 3∙108 м ∙ с–1. Поскольку тепловые эффекты химических реакций (
– изменение массы; с – скорость света в вакууме, равная 3∙108 м ∙ с–1. Поскольку тепловые эффекты химических реакций (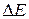 ) чрезвычайно малы по сравнению с величиной с 2, то соответствующими значениями
) чрезвычайно малы по сравнению с величиной с 2, то соответствующими значениями 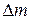 (10–9–10–11 г) можно пренебречь из-за невозможности их практического определения.
(10–9–10–11 г) можно пренебречь из-за невозможности их практического определения.
С точки зрения атомно-молекулярного учения в ходе реакции происходит лишь перераспределение атомов, но не изменяется их общее количество. Поэтому общая масса всех атомов также не изменяется.
Этот закон лежит в основе расчетов по уравнениям реакций.
Закон постоянства состава веществ
Любое сложное вещество молекулярного строения независимо от способов его получения имеет постоянный качественный и количественный состав.
Обратите внимание: данный закон применим для веществ только молекулярного строения. Например, количественный состав воды, независимо от способов ее получения, всегда один и тот же: w (H) = 11,1899 %, w (O) = 88,8101 %. Поэтому молекулярная формула воды, выведенная на основе указанных значений массовых долей элементов, всегда одна и та же – Н2,000О1,000, или просто H2O.
Экспериментально доказано, что количественный состав веществ немолекулярного строения зависит от способов их получения. Так, например, в образцах оксида меди(II), полученных разными способами, значения массовой доли меди могут изменяться от 74,6 % до 80,7 %. В соответствии с этим количественный состав оксида меди(II) выражается формулами от Cu0,739O до СuO1,053. Однако часто формулу этого вещества записывают упрощенно в виде CuO, округляя соответствующие индексы до целых чисел.
С точки зрения атомно-молекулярного учения в процессе образования молекулы обычно участвует небольшое число атомов, которые соединяются всегда в строго определенном количественном соотношении. Поэтому количественный состав образующихся молекул, а значит, и веществ молекулярного строения оказывается постоянным. В процессах же образования кристаллов немолекулярного (атомного или ионного) строения участвует очень большое число частиц, которые соединяются не всегда в строго определенном соотношении. Поэтому количественный состав образующихся атомных или ионных кристаллов может быть переменным в зависимости от способов их получения.
Количественный состав сложных веществ удобно выражать через массовые доли элементов.
Массовая доля элемента в веществе – число, показывающее, какую часть общей массы вещества составляет масса атомов данного элемента. Массовая доля обозначается символом «w» и выражается либо в долях единицы, либо в процентах (например, 0,35, или 35 %). Массовые доли элементов А и В в сложном веществе А х В у рассчитываются по формулам:
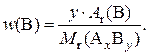
При этом сумма значений массовых долей элементов, входящих в состав вещества, всегда равна 1, или 100 %.
Пример 1.1.1. Вычислите значения массовых долей элементов в азотистой кислоте.
Решение.
1) Рассчитаем значение M r кислоты:
M r(HNO2) = A r(H) + A r(N) + 2 A r(O) = 1 + 14 + 32 = 47.
2) Рассчитаем значения массовых долей элементов:
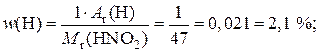
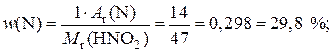
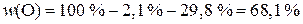 .
.
Пример 1.1.2. Определите простейшую формулу одного из оксидов азота, в котором массовая доля кислорода равна 63,15 %.
Решение.
1) Пусть масса оксида N x O y равна 100 г. Рассчитаем массы атомов кислорода и азота в оксиде:
а) m (O) = m (N x O y) · w (O) = 100 г · 0,6315 = 63,15 г;
б) m (N) = m (N x O y) – m (O) = 100 г – 63,15 г = 36,85 г.
2) Найдем химические количества атомов азота и кислорода:
а) n (N) = 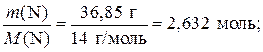
б) n (O) = 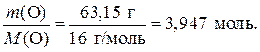
3) Найдем мольное соотношение атомов азота и кислорода в оксиде:
n (N): n (O) = 2,632 моль: 3,947 моль = 2 моль: 3 моль.
Следовательно, искомая формула оксида – N2О3.
Пример 1.1.3. Неизвестное вещество массой 6 г сожгли в кислороде, в результате чего были получены углекислый газ массой 8,8 г и вода массой 3,6 г. Определите молекулярную формулу сгоревшего вещества, если относительная плотность его паров по воздуху равна 3,103.
Решение.
Поскольку в результате сгорания вещества образовались углекислый газ и вода, делаем вывод, что в его состав входят углерод, водород и, возможно, кислород.
1) Рассчитаем массу углерода в образовавшемся СО2:
М (СО2) = 12 г/моль + 2·16 г/моль = 44 г/моль;
в СО2 массой 44 г содержится С массой 12 г
в СО2 массой 8,8 г содержится С массой x г;
x = 2,4 г (С).
2) Рассчитаем массу водорода в образовавшейся воде:
М (Н2О) = 2·1 г/моль + 16 г/моль = 18 г/моль;
в Н2О массой 18 г содержится Н массой 2 г
в Н2О массой 3,6 г содержится Н массой у г;
у = 0,4 г (Н).
3) Найдем сумму масс углерода и водорода, входивших в состав исходного вещества: m (C) + m (H) = 2,8 г.
4) Поскольку сумма масс С и Н (2,8 г) меньше массы сгоревшего вещества (6 г), делаем вывод, что в его состав входил также и кислород, масса которого m (О) = 6 – 2,8 = 3,2 г.
5) Определим простейшее мольное соотношение С, Н и О в исходном веществе, т. е. его простейшую формулу:
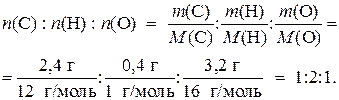
Таким образом, простейшая (эмпирическая) формула вещества – СН2О.
Следует отметить, что простейшая формула вещества отображает лишь простейшее (наименьшее) числовое соотношение атомов элементов в нем. Молекулярная же формула вещества отражает реальное число атомов каждого элемента в молекуле и получается умножением индексов в простейшей формуле в определенное число раз.
6) Рассчитаем значение молярной массы исходного вещества по его относительной плотности:
M 1(C x H y O z) = 29 · D (возд) = 29 · 3,103 = 90 г/моль.
7) Рассчитаем значение молярной массы исходного вещества по его простейшей формуле:
M 2(CH2O) = 12 + 2 + 16 = 30 г/моль.
8) Поскольку значение М 1больше значения М 2в 3 раза, то для нахождения молекулярной формулы вещества все индексы в его простейшей формуле нужно увеличить в 3 раза. Таким образом, искомая формула – С3Н6О3.
Закон эквивалентов
Вначале рассмотрим определения понятий: х имический эквивалент, число эквивалентности, фактор эквивалентности, молярная масса эквивалента, молярный объем эквивалента и количество вещества эквивалента.
Химический эквивалент – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна (т. е. химически равноценна) одному иону Н+, а в окислительно-восстановительной реакции – одному электрону.
Реальная частица – молекула, атом или ион, условная частица – определенная часть (половина, треть и т. д.) молекулы, атома или иона.
В общем случае эквивалент любого вещества Х обозначается следующим образом: 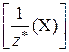 , где z * – число эквивалентности.
, где z * – число эквивалентности.
Число эквивалентности – z * – число ионов Н+ в кислотно-основной реакции или число электронов в окислительно-восстановительной реакции, которое эквивалентно (химически равноценно) в данной реакции одной частице вещества Х.
Фактор эквивалентности – f экв. = 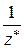
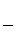 число, которое показывает, какая доля (часть) реальной частицы Х эквивалентна одному иону Н+ в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
число, которое показывает, какая доля (часть) реальной частицы Х эквивалентна одному иону Н+ в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Химическое количество эквивалентов вещества Х – n 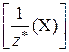 – физическая величина, численно равная отношению числа химических эквивалентов вещества Х к постоянной Авогадро:
– физическая величина, численно равная отношению числа химических эквивалентов вещества Х к постоянной Авогадро:
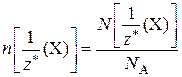
Единица химического количества эквивалентов – моль.
Молярная масса эквивалентов вещества Х – 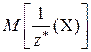 – физическая величина, равная отношению массы этого вещества к соответствующему химическому количеству его эквивалентов:
– физическая величина, равная отношению массы этого вещества к соответствующему химическому количеству его эквивалентов:
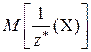 =
= 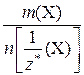 .
.
Единица молярной массы эквивалента – г/моль или кг/моль.
Молярная масса эквивалента вещества Х связана с молярной массой вещества Х соотношением:
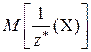 =
= 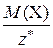 .
.
Физический смысл молярной массы эквивалентов вещества Х – она численно равна массе этого вещества, если химическое количество его эквивалентов равно 1 моль.
Молярный объем эквивалентов газа Х – 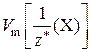 – физическая величина, равная отношению объема газа Х к соответствующему химическому количеству его эквивалентов:
– физическая величина, равная отношению объема газа Х к соответствующему химическому количеству его эквивалентов:
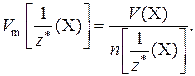
Единица молярного объема эквивалентов газа – дм3/моль или м3/моль.
Молярный объем эквивалента газа Х связан с его молярным объемом соотношением:
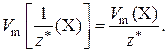
Физический смысл молярного объема эквивалентов газа Х: он численно равен объему этого газа, если химическое количество его эквивалентов равно 1 моль.
Закон эквивалентов
Дата добавления: 2015-07-25; просмотров: 165 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Детско-родительские отношения. | | | Химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой. |