
|
Читайте также: |
182. Вычислите массу карбоната калия, который необходимо добавить в раствор массой 0,85 кг с массовой долей данной соли, равной 8 %, для получения нового раствора, в котором массовая доля растворенного вещества составит 16,3 %.
183. Пентагидрат сульфата меди(II) массой 50,0 г добавили в раствор массой 550 г с массовой долей сульфата меди(II), равной 8,8 %. Вычислите массовую долю соли в полученном растворе.
184. В каком объеме раствора сульфата меди с массовой долей соли, равной 10 % (r = 1,05 г/см3), нужно растворить медный купорос массой 25 г для приготовления другого раствора, в котором массовая доля сульфата меди будет равна 20 %?
185. До какого объема необходимо упарить исходный раствор объемом 1,25 дм3 с плотностью 1,09 г/см3 и массовой долей нитрата калия 8,7 %, для получения нового раствора с плотностью 1,19 г/см3, в котором массовая доля данной соли составит 20 %.
186. Рассчитайте объем раствора с массовой долей серной кислоты 30,2 % (ρ = 1,22 г/см3), при добавлении которого к воде объемом 0,8 дм3 образуется раствор с массовой долей кислоты 5 %.
187. Рассчитайте объем воды, к которой нужно добавить раствор фосфорной кислоты объемом 400 см3 с массовой ее долей 81,2 % (ρ = 1,64 г/см3) для получения нового раствора, в котором массовая доля кислоты будет составлять 22,5 %.
188. Раствор объемом 0,75 дм3 с плотностью 1,08 г/см3 и массовой долей нитрата аммония, равной 9,7 %, упарили, в результате чего образовался новый раствор объемом 0,52 дм3 с плотностью 1,16 г/см3. Вычислите массовую долю соли в полученном растворе.
189. В раствор массой 1,5 кг с неизвестным значением массовой доли сульфата натрия добавили декагидрат указанной соли массой 0,322 кг, в результате чего образовался раствор с массовой долей сульфата натрия 16 %. Вычислите массовую долю указанной соли в исходном растворе.
190. Вычислите объем хлороводорода (н. у.), который необходимо растворить в растворе массой 500 г с массовой долей HCl, равной 12 %, для получения нового раствора, в котором массовая доля растворенного вещества составит 22 %.
191. Вычислите массу первого раствора с массовой долей кислоты 6,2 %, который необходимо добавить к второму раствору объемом 650 см3 с массовой долей той же кислоты, равной 20 % (ρ = 1,1 г/см3), для получения третьего раствора с массовой долей растворенного вещества, равной 12,4 %.
192. В раствор объемом 482,4 см3 (ρ = 1,13 г/см3) с массовой долей нитрата меди (II) 14,0 %, добавили кристаллогидрат указанной соли массой 138,2 г. В образовавшемся новом растворе массовая доля нитрата меди (II) составила 26,88 %. Определите состав добавленного кристаллогидрата.
193. При охлаждении раствора объемом 0,2 дм3 (ρ = 1,23 г/см3) с массовой долей нитрата железа(III), равной 25,0 %, выделился осадок кристаллогидрата данной соли массой 40,32 г. Определите его состав, если в растворе над осадком массовая доля растворенного вещества составляет 18,16 %.
194. В каком массовом соотношении нужно смешать растворы, в которых массовые доли нитрата кальция составляют 12 % и 50 %, для получения нового раствора с массовой долей соли 22 %.
195. В каком объемном соотношении нужно смешать растворы, в которых массовые доли гидроксида натрия составляют 7,4 % (ρ = 1,08 г/см3) и 43,1 % (ρ = 1,46 г/см3), для получения нового раствора с массовой долей щелочи 15,6 %.
196. В каком массовом соотношении нужно смешать тетрагидрат хлорида железа(II) с раствором, в котором массовая доля указанной соли составляет 5,4 %, для получения нового раствора с массовой долей растворенного вещества 19,6 %?
197. Вычислите массу гидроксида натрия и объем воды, необходимых для приготовления раствора объемом 1 дм3 (ρ = 1,22 г/см3), в котором молярная концентрация щелочи будет равна 6,12 моль/дм3.
198. Вычислите массу гексагидрата хлорида кальция, необходимого для приготовления раствора объемом 1750 см3 с молярной концентрацией соли 2,22 моль/дм3.
199. Вычислите массу гексагидрата хлорида железа(III) и объем воды, необходимых для приготовления раствора объемом 0,85 дм3, в котором молярная концентрация соли будет равна 4,11 моль/дм3 (ρ = 1,09 г/см3).
200. Вычислите массу гептагидрата сульфата железа(II) и объем воды, необходимых для приготовления раствора объемом 0,6 дм3, в котором молярная концентрация эквивалентов указанной соли будет равна 0,5 моль/дм3 (ρ = 1,06 г/см3). Приготовленный раствор будет использован для проведения реакции: 2FeSO4 + H2O2 = 2Fe(OH)SO4.
201. Вычислите объем раствора с массовой долей серной кислоты 70, 8 % (ρ = 1,62 г/см3), необходимого для приготовления раствора объемом 0,4 дм3 с молярной концентрацией кислоты, равной 0,15 моль/дм3.
202. Вычислите объем раствора с массовой долей серной кислоты 62 % (ρ = 1,52 г/см3), необходимого для приготовления раствора объемом 1,2 дм3, в котором молярная концентрация эквивалентов кислоты будет составлять 0,26 моль/дм3. (Раствор кислоты будет использован для получения средней соли).
203. Вычислите объем раствора с массовой долей азотной кислоты 64,7 % (ρ = 1,39 г/см3) и объем воды, при смешивании которых образуется новый раствор объемом 2,7 дм3 с молярной концентрацией растворенного вещества 1,24 моль/дм3 (ρ = 1,04 г/см3).
204. Вычислите объем раствора с молярной концентрацией азотной кислоты 12,9 моль/дм3 (ρ = 1,37 г/см3) и объем воды, необходимых для приготовления нового раствора объемом 1000 см3 (ρ = 1,15 г/см3), в котором массовая доля растворенного вещества будет составлять 25,5 %.
205. Вычислите объем воды и объем раствора с массовой долей серной кислоты 95,7 % (ρ = 1,84 г/см3), необходимых для приготовления нового раствора объемом 2550 см3 (ρ = 1,73 г/см3), в котором молярная концентрация кислоты будет составлять 14,16 моль/дм3.
206. Вычислите объемы растворов с массовыми долями азотной кислоты 65,8 % (ρ = 1,39 г/см3) и 25,48 % (ρ = 1,15 г/см3), при смешивании которых образуется новый раствор объемом 650 см3 с молярной концентрацией растворенного вещества 13,73 моль/дм3 (ρ = 1,38 г/см3).
207. Вычислите объемы исходных растворов с молярными концентрациями серной кислоты 17,54 моль/дм3 (ρ = 1,83 г/см3) и 3,03 моль/дм3 (ρ = 1,18 г/см3), при смешивании которых образуется новый раствор объемом 1000 см3 с молярной концентрацией растворенного вещества 9,21 моль/дм3 (ρ = 1,51 г/см3).
208. Вычислите массу пентагидрата сульфата меди(II), который необходимо добавить в раствор объемом 250 см3 с молярной концентрацией указанной соли 0,54 моль/дм3 (ρ = 1,08 г/см3) для получения нового раствора, в котором молярная концентрация растворенного вещества будет составлять 1,36 моль/дм3 (ρ = 1,21 г/см3).
209. Вычислите объем воды, необходимой для растворения пентагидрата сульфата меди(II) массой 125 г с образованием насыщенного при 50 °С раствора, если коэффициент растворимости сульфата меди(II) при указанной температуре равен 33,3 г.
210. Вычислите массу пентагидрата сульфата меди(II), который выделится из его насыщенного при 60 °С раствора массой 0,85 кг в результате охлаждения его до 10 °С, если коэффициенты растворимости сульфата меди (II) при указанных температурах равны соответственно 40,1 г и 17,4 г.
211. Вычислите массу хлорида калия и объем воды, необходимых для приготовления насыщенного при 80 °С раствора, из которого в результате охлаждения до 10 °С выделится осадок безводной соли массой 125 г. Коэффициенты растворимости хлорида калия при указанных температурах равны соответственно 51,1 г и 31,0 г.
212. Вычислите массу безводного сульфата меди(II) и объем воды, необходимых для приготовления насыщенного при 100 °С раствора, из которого в результате охлаждения до 30 °С выделится осадок пентагидрата исходной соли массой 150 г. Коэффициенты растворимости сульфата меди(II) при указанных температурах равны соответственно 75,4 г и 25,3 г.
213. Вычислите массу пентагидрата сульфата меди(II) и объем воды, необходимых для приготовления насыщенного при 60 °С раствора, из которого в результате охлаждения до 10 °С выделится осадок исходного кристаллогидрата массой 25 г. Коэффициенты растворимости сульфата меди(II) при указанных температурах равны соответственно 40,1 г и 17,4 г.
214. Насыщенный при 50 °С раствор сульфата меди(II) массой 200,0 г, охладили до 30 °С, в результате чего из раствора выделился осадок пентагидрата указанной соли массой 22,64 г. Определите коэффициент растворимости сульфата меди(II) при 50 °С, если при 30 °С он равен 25,1 г.
215. В насыщенный при некоторой температуре раствор хлорида меди(II) добавили безводный хлорид меди(II) массой 5,00 г и полученную смесь нагрели до полного растворения добавленной соли. Образовавшийся насыщенный раствор охладили до исходной температуры, в результате чего из раствора выделился осадок дигидрата хлорида меди(II) массой 7,48 г. Определите коэффициент растворимости указанной соли при температуре исходного раствора.
216. В результате охлаждения насыщенного раствора массой 200,0 г с массовой долей хлорида бария 30,4 %, выделился осадок кристаллогидрата указанной соли массой 25,12 г. Определите его состав, если массовая доля хлорида бария в растворе над осадком составляет 22,52 %.
217. В раствор массой 38,45 г с массовой долей сульфата никеля(II), равной 9,23 %, добавили при нагревании новую порцию данной соли массой 19,73 г, которая полностью растворилась. Образовавшийся насыщенный раствор охладили до 20 °С, в результате чего выделился осадок кристаллогидрата массой 26,04 г. Определите его состав, если коэффициент растворимости сульфата никеля(II) при 20 °С равен 38,4 г.
218. Какой объем раствора с молярной концентрацией серной кислоты 0,50 моль/дм3 можно приготовить из другого более концентрированного раствора объемом 15 см3, в котором молярная концентрация указанной кислоты составляет 2,5 моль/дм3?
219. Массовая доля H2SO4 в растворе равна 15 %, а его плотность составляет 1,105 г/см3. Вычислите:
а) молярную концентрацию;
б) молярную концентрацию эквивалентов (раствор будет использован для получения K2SO4);
в) моляльность;
г) мольную долю;
д) массовую концентрацию кислоты в данном растворе.
220. Молярная концентрация ортофосфорной кислоты в растворе равна 7,36 моль/дм3 (ρ = 1,36 г/см3). Вычислите:
а) массовую долю;
б) молярную концентрацию эквивалентов (раствор будет использован для получения K3PO4);
в) моляльность;
г) мольную долю;
д) массовую концентрацию кислоты в данном растворе.
221. Мольная доля азотной кислоты в растворе составляет 10 % (ρ = 1,17 г/см3). Вычислите:
а) массовую долю;
б) молярную концентрацию;
в) молярную концентрацию эквивалентов;
г) моляльность;
д) массовую концентрацию кислоты в данном растворе.
222. Вычислить массу сахарозы, необходимую для приготовления раствора массой 200 г, в котором моляльность растворенного вещества будет равна 0,05 моль/кг.
223. К раствору сульфата натрия объемом 100 см3 (r = 1,032 г/см3), в котором молярная концентрация эквивалентов соли равна 0,30 моль/дм3, добавили раствор этой же соли объемом 200 см3 (r = 1,062 г/см3), в котором ее молярная концентрация составляет 0,54 моль/дм3. Вычислите молярную концентрацию и молярную концентрацию эквивалентов сульфата натрия в полученном растворе, если его плотность равна 1,049 г/см3.
224. До какого объема необходимо разбавить соляную кислоту объемом 100 см3 с массовой долей хлороводорода 36 % (r = 1,18 г/см3) для приготовления другого раствора, в котором массовая доля HCl будет составлять 20 % (r = 1,10 г/см3)? Чему равна молярная концентрация хлороводорода в приготовленном растворе?
225. Какой объем (н. у.) аммиака необходимо растворить в воде объемом 200 см3 для получения раствора с массовой долей аммиака 10 %?
226. Азотная кислота, содержащаяся в растворе объемом 200 см3, реагирует полностью со смесью солей, состоящей из K2CO3 массой 4,14 г и Na2CO3 массой 2,12 г. Вычислите молярную концентрацию кислоты в исходном растворе.
227. В подкисленном серной кислотой растворе перманганата калия молярная концентрация эквивалентов указанной соли равна 0,01 моль/дм3. Какой объем этого раствора необходим для полного окисления сульфата железа(II), содержащегося в кристаллогидрате состава (NH4)2SO4 × FeSO4 × 6H2O массой 9,8 г? (В результате реакции  окисляется до
окисляется до  , а
, а 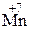 восстанавливается до
восстанавливается до  ).
).
228. Какой объем раствора с массовой долей азотной кислоты 40 % (r= 1,25 г/см3) необходимо добавить к раствору объемом 500 см3, в котором мольная доля той же кислоты равна 2,8 % (r = 1,05 г/см3), для приготовления раствора с массовой долей HNO3, равной 20 %?
229. К раствору серной кислоты объемом 100 см3, в котором молярная концентрация эквивалентов равна 4 моль/дм3 (r = 1,12 г/см3), добавили раствор этой же кислоты объемом 200 см3, в котором ее мольная доля составляет 0,29 (r = 1,605 г/см3). Вычислите массовую долю H2SO4 в приготовленном растворе.
230. В растворах нитрата магния и нитрата хрома(III) молярные концентрации солей равны соответственно 2,0 моль/дм3 и 1,0 моль/дм3. Эти растворы смешали и выпарили, а полученную смесь твердых нитратов прокалили. В полученной смеси оксидов магния и хрома(III) массой 51,2 мольная доля Cr2O3 равна 0,10. Рассчитайте объемы исходных растворов.
231. Смесь меди и оксида меди(II) с массовой долей простого вещества 30 %, обработали раствором с массовой долей азотной кислоты 0,20 (ρ = 1,10 г/см3). В результате реакции выделился оксид азота(II) объемом 2,24 дм3 (н. у.). Вычислите массу исходной смеси и объем израсходованного раствора кислоты.
232. Вычислите объем (н. у.) оксида серы(VI), при растворении которого в воде образуется раствор объемом 400 см3 с массовой долей серной кислоты, равной 0,50 % (ρ = 1,01 г/см3).
233. Насыщенный при 80 оС раствор нитрата калия, содержащий воду массой 200 г, охладили до 0 оС. Вычислите массу безводной соли, выделившейся при этом в осадок, если коэффициенты растворимости KNO3 при 80 оС и при 0 оС равны соответственно 170 г и 17 г. Какая часть (%) исходной соли осталась в растворе над осадком?
234. Насыщенный при 80 оС раствор хлорида меди(II), содержащий воду массой 200 г, охладили до 10 оС. Рассчитайте массу выделившегося при этом осадка дигидрата соли, если коэффициенты растворимости безводного CuCl2 при указанных температурах равны соответственно 98,1 г и 71,5 г. Чему равна масса раствора над осадком?
235. В насыщенном при 90 оС растворе массовая доля K2Cr2O7 составляет 45,2 %. Каков коэффициент растворимости дихромата калия при этой температуре?
236. Насыщенный раствор KСlO3 массой 200 г с массовой долей соли, равной 32 %, охладили до 0 оС, в результате чего выделился осадок безводной соли массой 59,5 г. Чему равен коэффициент растворимости хлората калия при 0 оС?
237. Рассчитайте молярную концентрацию хлорида натрия в физиологическом растворе (ρ = 1,01 г/см3), в котором массовая доля NaCl составляет 0,90 %.
238. Для полной нейтрализации серной и азотной кислот, содержащихся в растворе массой 10 г, потребовался раствор объемом 12,5 см3 (ρ = 1,18 г/см3) с массовой долей гидроксида натрия 19 %. При добавлении хлорида бария (избыток) к исходному раствору массой 20 г образовался осадок массой 4,66 г. Определите массовые доли кислот в исходном растворе.
239. Найдите массу гексагидрата хлорида кальция, который необходимо добавить к раствору объемом 47 см3 (ρ = 1,08 г/см3) с массовой долей карбоната натрия, равной 25 %, для приготовления раствора, в котором массовая доля Na2CO3 будет составлять 10 %?
240. Сплав меди, железа и цинка общей массой 24 г поместили в раствор массой 150 г с массовой долей хлороводорода 15 %. Рассчитайте массовые доли всех веществ в образовавшемся растворе, если массовые доли металлов в исходной смеси были одинаковыми.
241. К раствору объемом 400 см3 (ρ = 1,15 г/см3) с молярной концентрацией дигидрофосфата натрия 2,5 моль/дм3 добавили раствор гидроксида натрия массой 400 г с массовой долей щелочи 15 %. Рассчитайте массовые доли веществ в образовавшемся растворе.
242. К раствору массой 200 г с массовой долей хлорида кальция, равной 5,0 %, добавили карбонат натрия массой 12,72 г. Через образовавшуюся смесь пропустили углекислый газ объемом 1,12 дм3 (н. у.), который полностью поглотился. Определите массовые доли веществ в образовавшемся растворе.
243. Раствор объемом 40,3 см3 (ρ = 1,14 г/см3) с массовой долей азотной кислоты 37,8 % нейтрализовали раствором гидроксида калия с массовой долей КОН 33,6 %. Полученный нейтральный раствор охладили до 0 оС. Рассчитайте массу безводного KNO3, выпавшего в осадок, если в насыщенном растворе над осадком массовая доля соли составляет 11,6 %?
244. Раствор сульфата натрия разделили на 2 равные части. В первую из них добавили декагидрат сульфата натрия массой 24,15 г, а во вторую – гексагидрат указанной соли массой 12,50 г. В образовавшихся новых растворах массовые доли растворенного вещества стали равны соответственно 13,0 % и 11,2 %. Вычислите массу исходного раствора и массовую долю соли в нем.
245. Газ, выделившийся при прокаливании карбоната кальция, пропустили через раствор гидроксида бария объемом 125 см3 (ρ = 1,10 г/см3). При этом в результате полного взаимодействия веществ образовался только один продукт – осадок массой 4,925 г. Определите массовую долю щелочи в использованном растворе и массу исходного CaCO3.
246. Для полного растворения смеси цинка и оксида цинка общей массой 30,8 г потребовался раствор массой 245 г с массовой долей серной кислоты, равной 16 %. Вычислите массу простого вещества в исходной смеси и массовую долю соли в образовавшемся растворе.
1.6. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Электролиты, которые в водных растворах распадаются на ионы полностью (или почти полностью), называются сильными электролитами. К ним относятся почти все соли, гидроксиды щелочных и щелочноземельных металлов, некоторые неорганические кислоты, в том числе HCl, HBr, HI, HNO3, H2SO4, HClO4 и др.
Электролиты, диссоциирующие в растворах не полностью (частично), называются слабыми электролитами. К ним относятся все органические и большинство неорганических кислот (например, HF, HNO2, H2S, H2SO3, HCN, H2SiO3, H2CO3 H3PO4 и др.); малорастворимые основания, гидрат аммиака, вода, пероксид водорода и некоторые другие вещества. В растворах слабых электролитов устанавливаются равновесия между непродиссоциировавшими молекулами и ионами, образовавшимися в результате их диссоциации. Например, в водном растворе циановодородной (синильной) кислоты устанавливается равновесие:
НСN ↔ Н+ + СN–.
Константа равновесия данного процесса, выражающаяся через молярные концентрации соответствующих частиц, называется константой диссоциации (K дис):

Степенью диссоциации α электролита Х называется доля его молекул, подвергшихся диссоциации, т. е. α – величина, равная отношению числа молекул, продиссоциировавших на ионы, N дис(Х), к общему числу молекул, введенных в раствор, N общ(Х):
 .
.
Поскольку число частиц пропорционально их химическому количеству n (X) и молярной концентрации c (X), то степень диссоциации электролита можно выражать и через указанные величины:
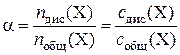 .
.
Следовательно, степень диссоциации синильной кислоты можно выразить так:
 .
.
Из уравнения диссоциации указанной кислоты следует, что с дис(HСN) = с (Н+) = с (СN–). Поэтому выражение степени диссоциации можно записать так:

Из этого уравнения следует, что с (Н+) = с (СN–) = с общ(HСN) · α.
Концентрация непродиссоциировавших молекул равна:
с недис(HСN) = с общ(HСN) – с дис(HСN) =
= с общ(HСN) – с общ(HСN) · α= с общ(HСN) · (1 – α).
После подстановки с дис(HСN) и с недис(HСN) в выражение константы диссоциации циановодородной кислоты получаем математическое выражение закона разбавления Оствальда:
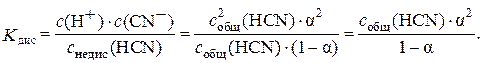
Когда электролит очень слабый, т. е. α → 0, K дис ≈ с общ · α 2, откуда
α ≈  .
.
Если в растворе слабого электролита AB степень его диссоциации равна α, то концентрации ионов A+ и В– в растворе одинаковы и составляют:
с (А+) = с (В–) = α · с общ(АВ).
Подставив сюда значение α из предыдущего соотношения, находим:
с (А+) = с (В–) ≈  ≈
≈  .
.
Пример 1.6.1. Определите концентрации ионов и непродиссоциировавших молекул в водном растворе HF, если ее молярная концентрация составляет 0,010 моль/дм3. Степень диссоциации HF равна 25 %.
Решение.
1.Запишем уравнение электролитической диссоциации HF:
HF «H+ + F–.
2.Найдем концентрации каждого из ионов:
с (Н+) = с (F–) = с общ(HF) · α = 0,010 моль/дм3· 0,25 = 2,5∙10–3 моль/дм3.
3.Найдем концентрацию непродиссоциировавших молекул HF:
с недис(HСN) = с общ(HСN) – с дисс(HСN) =
= 0,01 – 0,0025 = 0,0075 моль/дм3 = 7,5∙10–3 моль/дм3.
Пример 1.6.2. Чему равна степень электролитической диссоциации уксусной кислоты в растворе, если ее молярная концентрация составляет 2,0 моль/дм3? Какова концентрация ионов Н+ в этом растворе? K дис(CH3COOH) = 1,8 ∙ 10–5.
Решение.
1.Запишем математическое выражение закона разбавления Оствальда для уксусной кислоты:

Поскольку общая концентрация уксусной кислоты в данном растворе достаточно велика и степень ее диссоциации a << 1, можно воспользоваться упрощенной формулой:

2.Выразим из этого уравнения α и рассчитаем ее значение:
 ≈ 3 ∙ 10–3.
≈ 3 ∙ 10–3.
3.Найдем концентрацию ионов Н+ в растворе:
с (Н+) = с общ(CH3COOH) · α = 2,0 моль/дм3 · 3 ∙ 10–3 = 6,0 ∙ 10–3 моль/дм3.
Константа воды (ионное произведение воды).
Водородный показатель
Вода, будучи очень слабым электролитом, диссоциирует в незначительной степени, образуя ионы водорода и гидроксид-ионы:
Н2О ↔ Н+ + ОН–.
Этому процессу соответствует константа диссоциации:
 = 1,8·10–16 (при 22 оС).
= 1,8·10–16 (при 22 оС).
Поскольку степень диссоциации воды чрезвычайно мала, то равновесная концентрация ее недиссоциированных молекул с недисс(Н2О) практически равна общей концентрации воды: с недис(Н2О) = с общ(Н2О) = 55,55 моль/дм3 (поскольку 1000 г: 18 г/моль = 55,55 моль). Тогда выражение константы диссоциации воды можно преобразовать следующим образом:
с (Н+) · с (ОН– ) = K дисс · с общ(Н2О) = 1,8 · 10–16 · 55,55 = 10–14 = K w,
Константа K w называется константой воды или ионным произведением воды. Ее физический смыслзаключается в том, что в чистой воде или в любом водном растворе при 22 оС произведение молярных концентраций ионов Н+ и ОН– равно 10–14.
Диссоциация воды – эндотермический процесс, поэтому при увеличении температуры диссоциация молекул Н2О усиливается и значение K w возрастает:
T, oC 10 22 30 50 100
K w ∙ 10–14 0,36 1,00 1,89 5,60 74,00
В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 22 оС составляют 10–7 моль/дм3.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. В нейтральных растворах при 22 оС с (Н+) = с (ОН–) = 10–7 моль/дм3.
В кислых растворах концентрация ионов водорода выше концентрации гидроксид-ионов:
с (Н+) > с (ОН–) и с (Н+) > 10–7 моль/дм3 (при 22 оС).
Дата добавления: 2015-07-25; просмотров: 127 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При различных сочетаниях знаков DrH и DrS 2 страница | | | При различных сочетаниях знаков DrH и DrS 4 страница |