
|
Читайте также: |
276. Какова среда водных растворов солей: NaHCO3, KHSO3, Cs2SO4, K2HPO4, RbH2PO4, НСООNH4, Ba(OH)Cl? Напишите уравнения возможных реакций.
277. Используя справочные данные, рассчитайте рН раствора сульфита натрия, если его молярная концентрация составляет 1,2 моль/дм3.
278. Используя справочные данные, рассчитайте рН раствора фосфата калия, если его молярная концентрация составляет 1,5 моль/дм3.
279. Используя справочные данные, рассчитайте рН раствора гидрокарбоната калия, если молярная концентрация его эквивалентов составляет 1,8 моль/дм3.
280. Известно, что среда водного раствора гидрофосфата натрия слабощелочная, а дигидрофосфата натрия – слабокислая. Содержащиеся в этих солях анионы могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–. Какой из этих процессов преобладает в указанных растворах? Ответ подтвердите, сравнив константы диссоциации ионов с соответствующими константами гидролиза солей.
281. Учитывая, что ионы 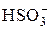 в растворе могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–, определите среду водного раствора гидросульфита натрия. Ответ подтвердите соответствующими расчетами.
в растворе могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–, определите среду водного раствора гидросульфита натрия. Ответ подтвердите соответствующими расчетами.
282. Сравните гидролизуемость солей в каждой паре, если их молярные концентрации в растворах одинаковы:
а) FeCl2 – FeCl3; г) Be(NO3)2 – Mg(NO3)2;
б) Na2CO3 – Na2SiO3; д) Na2CO3 – (NH4)2CO3;
в) NaHCO3 – Na2CO3; е) Na2S – Na2Se.
283. Напишите в молекулярной и ионно-молекулярной формах уравнения совместного гидролиза карбоната натрия и следующих солей:
а) хлорид железа(III);
б) сульфат алюминия;
в) нитрат хрома(III);
г) сульфат меди(II).
Будет ли изменяться состав продуктов при замене карбоната натрия на гидрокарбонат?
1.7. СТРОЕНИЕ АТОМА
И ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
Вопросы для самостоятельной подготовки
1. Перечислите и охарактеризуйте элементарные частицы, входящие в состав атомов. Какие из этих частиц относятся к нуклонам?
2. Дайте определение понятий: нуклид; протонное число; массовое (нуклонное) число; изотопы; изобары; изотоны.
3. Что общего в понятиях «нуклид» и «элемент» и чем они отличаются? Какие нуклиды называются радионуклидами?
4. Что такое радиоактивность? Каковы ее причины? Приведите примеры основных типов радиоактивных превращений.
5. Объясните причины и сущность корпускулярно-волновой двойственности микрообъектов.
6. Что такое электронное облако; волновая функция; электронная плотность; атомная орбиталь? В чем различие понятий орбиталь и орбита?
7. Какой смысл имеют квантовые числа, характеризующие состояние электрона в атоме? Какие численные значения они могут принимать?
8. Дайте толкование понятий: электронная оболочка; энергетический уровень; электронный слой; подуровень; атомная орбиталь.
9. Что такое эффективный заряд атомного ядра?
10. Поясните основные принципы распределения электронов по уровням, подуровням и орбиталям в атомах.
11. Сформулируйте правила Клечковского. Какие энергетические подуровни характеризуются одинаковыми значениями суммы n + l, равными 3, 4, 5, 6 и 7?
12. Напишите формулы электронных конфигураций атомов элементов F, Ne, P, Ca, Co, La, Ru, W, Po, U, Bk, Md. Для каждого из элементов изобразите электронно-графические схемы двух последних энергетических уровней их атомов.
13. Что является главной характеристикой атома?
14. Дайте современную формулировку периодического закона и поясните его физический смысл.
15. Каковы основные формы изображения таблицы периодической системы элементов? Укажите их сходства и различия.
16. Каков физический смысл номера периода, номера группы в таблице периодической системы? Покажите на примерах.
17. Что такое s -, p -, d -, f -элементы? Каково их расположение по периодам и группам в таблице периодической системы? Каковы максимальные емкости периодов?
18. В чем проявляется сходство и различие элементов групп «А» и «В» (главных и побочных подгрупп)? Поясните понятие «элементы-аналоги».
19. Каковы факторы, определяющие характер изменения химических свойств атомов элементов и соответствующих простых веществ по периодам и группам?
20. Объясните суть понятий: эффективный, ковалентный, ионный, ван-дер-Ваальсовский, металлический, орбитальный радиусы. В чем их сходство и различие?
21. Какие радиусы отвечают по смыслу понятию «атомный радиус»? Поясните, как влияют на величину атомного радиуса следующие факторы: эффективный заряд ядра, конфигурация внешнего электронного слоя, число электронных слоев, тип химической связи и ее кратность.
22. Что такое потенциал ионизации и энергия ионизации атома? Чем они отличаются и как связаны между собой? От каких факторов зависит его величина?
23. Проанализируйте изменение первой энергии ионизации атомов элементов второго периода по мере увеличения Z.
24. Дайте определение понятия «сродство к электрону».
25. Какие факторы определяют величину сродства к электрону? Как можно объяснить различные знаки этой характеристики для атомов разных элементов?
26. Могут ли существовать в свободном состоянии анионы O2ˉ, S2ˉ, N3ˉ? Почему?
27. Что такое электроотрицательность? Какую способность атома она характеризует?
28. Каковы принципы построения шкалы электроотрицательности элементов? Как изменяется эта характеристика по периодам и группам периодической системы по мере увеличения Z?
1.8. ХИМИЧЕСКАЯ СВЯЗЬ
И МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ
Вопросы для самостоятельной подготовки
1. Что такое химическая связь? Укажите условия и причины ее образования.
2. Какова природа химической связи?
3. Каковы основные типы химической связи? Укажите сходство и различия между ними.
4. Дайте определение ковалентной связи. Какова схема ее образования (на примере молекул H2, Cl2 и HCl)?
5. Назовите и проиллюстрируйте конкретными примерами основные механизмы образования ковалентной связи.
6. Сформулируйте основные положения метода валентных связей.
7. Перечислите основные свойства ковалентной связи и поясните их суть.
8. Перечислите виды ковалентной связи. Объясните механизм образования s-, p- и d- связей.
9. Что такое кратность связи? Каково ее влияние на длину и энергиию связи между атомами?
10. Что такое валентность? Чем она определяется?
11. Каковы условия образования полярной и неполярной ковалентной связи? Поясните понятие «эффективный заряд атома» на конкретных примерах.
12. Что такое электрический диполь? В каком соотношении находятся длина диполя и длина связи в двухатомной молекуле?
13. Что является мерой полярности связи?
14. Проанализируйте в сравнительном плане полярность молекул CO2 и SO2; NH3 и NF3; H2O и H2S.
15. Что такое стереохимия?
16. Чем определяется геометрическая форма молекул с ковалентным типом связей?
17. Дайте объяснение концепции гибридизации атомных орбиталей.
18. Поясните основные условия устойчивой гибридизации орбиталей.
19. Каковы основные типы гибридизации орбиталей? Какие геометрические формы частиц им соответствуют?
20. Что такое связывающие и несвязывающие орбитали? Каково их влияние на геометрическую форму частиц с ковалентными связями?
21. Как влияет природа лиганда и кратность связи на геометрическую форму однотипных частиц?
22. Что такое координационное число атомной частицы? Какова его количественная интерпретация?
23. Приведите примеры частиц с многоцентровыми (делокализованными) связями.
24. Чему равна валентность и степень окисления атомов азота и углерода в молекулах: N2, NH3, N2H4, NH2OH, NF3, CH4, CCl4, C2H6, C2H4, C2H2, CO2, CO?
25. Проанализируйте следующие молекулярные частицы (установите характер распределения валентных электронов, тип гибридизации орбиталей центральных атомов, валентные углы, полярность частиц, валентность и степень окисления отдельных атомов): CO, CO2, N2O, NO2, N2O5, HNO3, H2SO4, BF, BF3, NH3, NF3,  ,
, 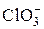 ,
, 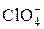 , HN3, SO2, SO42-, NO3-, NH4+, BF4-.
, HN3, SO2, SO42-, NO3-, NH4+, BF4-.
26. Дайте определение ионной связи. Какова ее природа и механизм образования?
27. Что такое степень ионности связи?
28. Перечислите и объясните основные характеристики ионной связи. Укажите, в чем ее сходство и различие с ковалентной полярной связью?
29. Чем определяется величина координационного числа ионов в ионных соединениях?
30. Какая связь в каждом из соединений – HClO, NaHSO4, KOH, H2CO3 – характеризуется наибольшей степенью ионности?
31. Дайте определение металлической связи. Какова ее природа и механизм образования?
32. Перечислите типы межмолекулярного взаимодействия. В чем заключаются их особенности?
33. Рассмотрите механизм образования водородной связи, ее отличие от химической связи и сил межмолекулярного взаимодействия.
34. Как влияет наличие водородной связи между молекулами или внутри молекул на физические и химические свойства веществ? Поясните на примере изменения свойств веществ в рядах HF – HI; H2O – H2Te; NH3 – SbH3; CH4 – SnH4.
35. Поясните роль водородной связи в биологических объектах на примере воды, белков, полисахаридов, ДНК, РНК.
1.9. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ
К окислительно-восстановительным относятся реакции, протекающие с изменением степеней окисления атомных частиц (а. ч.), входящих в состав реагирующих веществ.
Степень окисления – условный заряд а. ч., рассчитанный исходя из допущения, что вещество состоит из ионов.
Поскольку такое допущение является условным, понятие «степень окисления» носит также условный характер и является величиной формальной, не отражающей реального распределения зарядов между атомами. Однако это понятие широко используется при составлении уравнений окислительно-восстановительных реакций (ОВР).
Cтепени окисления а. ч. принимают значения от –4 до +8 в соответствии с правилами:
1. Степень окисления а. ч. в простых веществах равна 0, например, 
2. А. ч. водорода в большинстве своих соединений находятся в степени окисления, равной +1. Однако в соединениях со щелочными и щелочноземельными металлами они проявляют степень окисления, равную –1, например: 
3. А. ч. кислорода в подавляющем большинстве соединений находятся в степени окисления, равной –2, например:  ,
,  . В пероксидах они проявляют степень окисления, равную –1, например:
. В пероксидах они проявляют степень окисления, равную –1, например:  ,
,  . Положительные степени окисления а. ч. кислорода проявляют лишь в соединениях с фтором, например
. Положительные степени окисления а. ч. кислорода проявляют лишь в соединениях с фтором, например 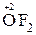 .
.
4. А. ч. фтора в соединениях всегда проявляют только одну степень окисления, равную –1.
5. А. ч. элементов группы I-A (щелочные металлы) в соединениях всегда проявляют степень окисления, равную +1.
6. А. ч. элементов группы II-A (Be, Mg, щелочноземельные металлы), а также Zn и Cd в соединениях всегда проявляют степень окисления, равную +2.
7. А. ч. алюминия в соединениях находятся в степени окисления +3.
Степени окисления а. ч. других элементов могут иметь переменные значения и рассчитываются исходя из того, что сумма степеней окисления всех а. ч. в молекуле или формульной единице равна 0, а в ионе – его заряду.
Пример 1.9.1. Рассчитайте степень окисления а. ч. фосфора в ортофосфате кальция Са3(РО4)2.
Pешение.
Обозначим искомую степень окисления а. ч. фосфора через х. Учитывая число атомов каждого элемента в формульной единице и значения степеней их окисления, составим уравнение:
3 · (+2) + 2 · х + 8 · (–2) = 0, откуда х = + 5.
В ходе любой ОВР одновременно протекают 2 процесса – окисление и восстановление. С точки зрения электронной теории окисление – процесс отдачи электронов, в ходе которого степень окисления атома повышается, а восстановление – процесс присоединения электронов, в ходе которого степень окисления атома понижается.
А. ч., которые в ходе ОВР отдают электроны, называются восстановителями, как и вещества, в состав которых они входят.
А. ч., присоединяющие электроны, называются окислителями, как и вещества, содержащие эти частицы.
Таким образом, в ходе ОВРвосстановитель, отдавая электроны, восстанавливает, но сам окисляется; окислитель, принимая электроны, окисляет, но сам восстанавливается. При этом общее число электронов, отданных а. ч.-восстановителями, всегда равно числу электронов, принятых а. ч.-окислителями.
Окислительно-восстановительные свойства веществ можно определить, исходя из значений степеней окисления а. ч., входящих в их состав:
1. Если в состав вещества входят а. ч. элемента в минимальной степени окисления, то оно может проявлять только восстановительные свойства.
2. Если в состав вещества входят а. ч. элемента в максимальной степени окисления, то оно может проявлять только окислительные свойства.
3. Если в состав вещества входят а. ч. элемента в промежуточной степени окисления, то оно может проявлять как восстановительные, так и окислительные свойства.
Важнейшие восстановители
1. Простые вещества – все металлы и некоторые неметаллы, например Н2, С, Si, P4 и др.
2. Водородные соединения щелочных и щелочноземельных металлов, а также водородные соединения некоторых неметаллов, например: HI, HBr, H2O2, H2S, H2Se, H2Te, NH3, PH3, AsH3, SbH3, SiH4, SnH4.
3. Оксиды элементов, атомы которых находятся в промежуточной степени окисления. Это оксиды ряда неметаллов – СО, SO2, NO, P2O3, а также низшие оксиды некоторых р- и d -элементов – SnO, FeO, СrO, VO и соответствующие им соли, например SnCl2, FeSO4 и др.
4. Некоторые кислородсодержащие кислоты и их соли, в состав которых входят атомы элементов в промежуточных степенях окисления, например H2SO3, H3PO2, H3PO3, и их соли, а также тиосульфаты (Na2S2O3), дисульфиты (Na2S2O5), дитиониты (Na2S2O4), нитриты.
5. Некоторые органические вещества, например спирты, альдегиды, некоторые карбоновые кислоты (H─COOH, HOOC─COOH), углеводы (С6H12O6).
Важнейшие окислители:
1. Простые вещества – галогены, озон, кислород, сера.
2. Оксиды некоторых р - и d -элементов в высоких степенях окисления, например Cl2O7, ClO2, I2O5, SO3, SeO3, SeO2, N2O5, NO2, PbO2, Mn2O7, MnO2, CrO3, V2O5.
3. Кислородсодержащие кислоты некоторых р - и d -элементов в высоких степенях окисления, например HClO3, H5IO6, HIO3, HBrO4, HBrO3, H2SO4, H2SeO4, H2SeO3, HNO3, H2CrO4, H2Cr2O7, HMnO4, и соли этих кислот. К окислителям относятся также кислородсодержащие кислоты галогенов, в которых они проявляют и более низкие степени окисления, например HClO, HClO2, а также их соли;
4. Пероксид водорода Н2О2, пероксиды щелочных и щелочноземельных металлов (Na2O2, BaO2).
Ниже приведена классификация окислительно-восстановительных реакций.
Дата добавления: 2015-07-25; просмотров: 78 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При различных сочетаниях знаков DrH и DrS 5 страница | | | ОВР межмолекулярного типа |