
|
Читайте также: |
Скорость химических реакций
1. Что называется скоростью химической реакции?
2. Какие факторы влияют на скорость химической реакции?
3. Как скорость химической реакции зависит от концентраций реагентов? Сформулируйте основной закон химической кинетики – закон действующих масс – и укажите условия его применения.
4. Напишите математические выражения закона действующих масс для следующих реакций:
а) 2NOCl (г) = 2NO (г) + Cl2 (г);
б) Fe2O3 (к) + H2 (г) = 2FeO (к) + H2O (г).
5. От каких факторов зависит величина константы скорости реакции? Каков ее физический смысл?
6. Каково влияние давления на скорость химической реакции?
7. Как влияет повышение (понижение) температуры на скорость химической реакции?
8. Что такое температурный коэффициент скорости химической реакции?
9. Почему скорость химической реакции с повышением температуры возрастает намного быстрее, чем число столкновений молекул?
10. Какие молекулы называются активными?
11. Что такое энергия активации и активированный комплекс?
12. Каково соотношение величин энергии химических связей в реагирующих молекулах и энергии активации реакции?
13. Приведите энергетическую диаграмму химической реакции и отобразите на диаграмме энергию активации и тепловой эффект реакции. Как объяснить, что тепловой эффект реакции не зависит от ее энергии активации?
14. Как влияет величина энергии активации на скорость химической реакции?
15. Возможны ли реакции с энергией активации, равной нулю?
16. Какова взаимосвязь между константой скорости реакции и энергией активации?
17. Каково влияние величины энергии активации на температурный коэффициент скорости реакции?
18. Какие вещества называются катализаторами?
19. В чем заключается ускоряющее действие катализатора?
20. Каково влияние катализатора на величину энергии активации химической реакции? Поясните с использованием энергетической диаграммы.
21. На примере объясните сущность теории промежуточных продуктов.
22. В чем состоит особенность ферментативных реакций?
Химическое равновесие
23. Какое состояние системы называется химическим равновесием?
24. Как определить момент наступления химического равновесия?
25. Можно ли считать постоянство концентраций реагентов в системе доказательством истинности химического равновесия?
26. Что такое константа химического равновесия? Каков ее физический смысл?
27. Запишите математические выражения констант равновесия для систем:
а) 4HCl (г) + O2 (г) «2Cl2 (г) + 2H2O (г)
б) 2Fe (к) + 3Cl2 (г) «2FeCl3 (к)
28. Каково влияние температуры, давления, концентрации и присутствия катализатора на величину константы химического равновесия?
29. Каково влияние температуры, давления, концентрации и присутствия катализатора на состояние химического равновесия?
30. Сформулируйте принцип Ле Шателье.
31. В какую сторону сместится равновесие
2NO (г) + O2 (г) «2NO2 (г);  = –113 кДж при:
= –113 кДж при:
а) уменьшении давления;
б) введении в систему кислорода;
в) повышении температуры?
32. В каком направлении произойдет смещение равновесия
Fe3O4 (к) + 4H2 (г) «3Fe (к) + 4H2O (г) при:
а) введении в систему водорода;
б) введении в систему прокаленного оксида кальция;
в) увеличении давления?
33. Какие реакции относятся к фотохимическим?
34. Приведите примеры неразветвленных и разветвленных цепных реакций.
35. Каково значение фотохимических реакций для живой природы?
Задачи и упражнения
158. Напишите математические выражения закона действующих масс для реакций:
а) А (г) + 2В (г) = АВ2 (г); в) 2А (р-р) + В (р-р) = А2В (р-р);
б) А (г) + В (к) = АВ (г); г) А (р-р) + В (к) = D (р-р) + E (к).
159. Рассчитайте, как изменится скорость реакции
2А (г) + В (г) = 2С (г), если:
а) увеличить концентрацию вещества А в 3 раза;
б) уменьшить концентрацию вещества В в 4 раза;
в) увеличить давление в системе в 2 раза;
г) увеличить объем системы в 3 раза?
160. Начальные концентрации реагентов равны: с 0(А) = 0,06 моль/дм3 и с 0(В) = 0,10 моль/дм3. Рассчитайте, как изменится скорость реакции 2А (г) + В (г) → 2D (г) по сравнению с первоначальной в тот момент, когда количество вещества В в системе уменьшится на 10 %?
161. В сосуд объемом 2 дм3 ввели кислород массой 0,32 г и оксид азота(II) массой 0,30 г. Рассчитайте, как изменится скорость реакции 2NO (г) + О2 (г) → 2NO2 (г) по сравнению с первоначальной в тот момент, когда количество NO в системе уменьшится на 20 %?
162. Температурный коэффициент скорости реакции равен 2. Рассчитайте, как изменится ее скорость, если в системе:
а) увеличить температуру от –2 оС до 38 оС;
б) понизить температуру от 25 оС до –5 оС;
в) увеличить температуру от 22 оС до 45 оС?
163. При повышении температуры на 40 оС скорость реакции возрастает от 0,025 моль/(дм3· с) до 0,8 моль/(дм3· с). Определите температурный коэффициент скорости данной реакции.
164. При понижении температуры в системе от x оС до y оС скорость реакции уменьшилась от 0,027 моль/(дм3· с) до 0,001 моль/(дм3· с). Определите величину температурного коэффициента скорости данной реакции, если: а) x = 22, y = –8; б) x = 50, y = 22; в) x = –5, y = –45.
165. На сколько градусов и как необходимо изменить температуру в системе, чтобы скорость реакции увеличилась в 100 раз, если температурный коэффициент равен 3,1?
166. В какую сторону сместится равновесие в системах:
а) H2 (г) + I2 (г) ↔ 2HI (г);  = –26 кДж;
= –26 кДж;
б) N2 (г) + О2 (г) ↔ 2NO (г);  = 181 кДж;
= 181 кДж;
в) 2СО (г) + О2 (г) ↔ 2СО2 (г);  = –569 кДж;
= –569 кДж;
г) 2Н2О (г) ↔ 2Н2 (г) + О2 (г);  = 484 кДж
= 484 кДж
при увеличении давления; при увеличении объема системы; при охлаждении системы?
167. Напишите математические выражения констант равновесия для систем:
а) N2 (г) + О2 (г) ↔ 2NO (г);
б) CH3COOH (р-р) ↔ H+ (р-р) + CH3COO– (р-р);
в) CuO (к) + Н2 (г) ↔ Cu (к) + Н2О (г);
г) 2NO (г)+ О2 (г) ↔ 2NO2 (г);
д) [Ag(CN)2]–(р-р) ↔ Ag+(р-р) + 2CN–(р-р).
168. Стандартная энтальпия образования PCl5 (г) равна 464 кДж/моль. Какие условия необходимо создавать для увеличения практического выхода PCl5 при его синтезе из простых веществ?
169. Химическое равновесие 2NO (г) + О2 (г) ↔ 2NO2 (г) установилось при концентрациях оксида азота(II), кислорода и оксида азота(IV), равных соответственно 0,08; 0,03 и 0,02 моль/дм3. Вычислите константу равновесия и начальные концентрации оксида азота(II) и кислорода, если в исходной системе оксид азота(IV) отсутствовал.
170. Вычислите константу равновесия реакции N2O4 (г) ↔ 2NO2 (г), если начальная концентрация N2O4 была 0,06 моль/дм3, а к моменту наступления равновесия его количество уменьшилось на 50 %. Оксид NO2 в первоначальный момент реакции отсутствовал.
171. Найдите константу равновесия реакции N2 (г) + 3H2 (г) ↔ 2NH3 (г), если начальные концентрации азота и водорода были равны соответственно 0,2 и 0,6 моль/дм3, а к моменту наступления равновесия количество азота в системе уменьшилось на 20 %. Как изменилось давление в системе при переходе от ее начального состояния к равновесному, если аммиак в исходной смеси отсутствовал?
172. При некоторой температуре константа равновесия гомогенной системы N2 (г) + 3H2 (г) ↔ 2NH3 (г) равна 1. Равновесные концентрации водорода и аммиака равны соответственно 0,2 и 0,08 моль/дм3. Вычислите равновесную и начальную концентрации азота, если в исходной смеси аммиак отсутствовал.
173. При некоторой температуре константа равновесия обратимой реакции FeO (к) + CO (г) ↔ Fe (к) + CO2 (г) равна 0,5. Найдите равновесные концентрации СО и СО2, если их начальные концентрации были равны соответственно 0,05 и 0,01 моль/дм3.
174. Константа равновесия СО2 (г) + Н2 (г) ↔ СО (г) + Н2О (г) при некоторой температуре равна 1. Определите, на сколько процентов уменьшится количество СО2 в системе к моменту наступления равновесия, если начальные количества СО2 и Н2 были равны соответственно 1 моль и 3 моль? (CO и Н2О в начале реакции отсутствовали).
175. Константа равновесия в системе СО2 (г) + Н2 (г) ↔ СО (г) + Н2О (г) при некоторой температуре равна 1. Определите, в каком объемном соотношении были смешаны СО2 и Н2, если к моменту наступления равновесия количество водорода уменьшилось на 80 %? (CO и Н2О в начале реакции отсутствовали).
176. Константа равновесия в системе Н2 (г) + Br2 (г) ↔ 2HBr (г) при некоторой температуре равна 1. Определите объемные доли компонентов равновесной системы, если количества водорода и брома до начала реакции составляли соответственно 0,3 моль и 0,2 моль. (HBr в исходной смеси отсутствовал).
177. В замкнутом сосуде протекает реакция АВ (г) ↔ А (г) + В (г). Константа равновесия равна 0,04, а равновесная концентрация вещества А составляет 0,02 моль/дм3. Найдите начальную концентрацию вещества АВ и степень его разложения.
178. Пользуясь справочными данными, определите константу равновесия системы 2NO2 (г) ↔ N2O4 (г) при 25 оС исходя из изменения энергии Гиббса реакции.
1.5. КОЛИЧЕСТВЕННЫЙ СОСТАВ РАСТВОРОВ
Раствор – это гомогенная система, состоящая из двух или более веществ. Вещества, составляющие раствор, называются компонентами раствора. Растворы бывают газообразные, жидкие и твердые.
Для биологии и медицины наибольший интерес представляют жидкие водные растворы. Любой раствор состоит из растворенных веществ и растворителя, хотя эти понятия в известной степени условны. Обычно растворителем считается тот компонент, который в растворе находится в том же агрегатном состоянии, что и до его образования. Например, в водном растворе глюкозы (твердое вещество) растворителем является вода, а смесь спирта (жидкость) и воды (жидкость) можно назвать в зависимости от количества компонентов раствором спирта в воде или раствором воды в спирте.
В растворах электролитов вне зависимости от соотношения компонентов и их агрегатного состояния электролиты всегда рассматриваются как растворенные вещества.
Свойства растворов определяются их качественным и количественным составом. На практике для выражения количественного состава растворов используют следующие величины:
а) безразмерные – массовая, объемная и мольная доли;
б) размерные – массовая концентрация, молярная концентрация, молярная концентрация эквивалентов вещества и моляльность.
Массовая доля растворенного вещества – w – физическая величина, численно равная отношению массы растворенного вещества m (Х) к общей массе раствора:

Массовая доля выражается в долях единицы, процентах (%), промилле (‰) и (для очень разбавленных растворов) в миллионных долях (ppm, или млнˉ1). Например, если в растворе массой 100 г содержится аммиак массой 3 г, то его массовая доля в растворе составляет 0,03, или 3 %, или 30 ‰.
Объемная доля растворенного вещества – j – физическая величина, численно равная отношению объема жидкого (или газообразного) вещества V (Х) к общему объему раствора (или газовой смеси):

Объемная доля, как и массовая, выражается в долях единицы, процентах (%) и промилле (‰). Для водных растворов этилового спирта 1 объемный процент принято обозначать как 1о (1 градус).
Если, например, объемная доля O2 в воздухе составляет 21 %, это значит, что в воздухе объемом 100 дм3 содержится кислород объемом 21 дм3. Если объемная доля этилового спирта в растворе составляет 96 % (96º), то в данном растворе объемом 100 см3 содержится этанол объемом 96 см3.
Мольная доля растворенного вещества – c – физическая величина, численно равная отношению химического количества растворенного вещества n (Х) к общему химическому количеству всех компонентов раствора:

Она выражается так же в долях единицы или в процентах.
Массовая концентрация (титр) вещества – T (X) – физическая величина, численно равная отношению массы растворенного вещества к объему раствора:

Единицы массовой концентрации: кг/дм3, г/см3, г/дм3, г/см3, мг/см3. В клинической практике массовую концентрацию ионов часто выражают в миллиграммах на 100 см3 раствора (мг-%).
Молярная концентрация вещества – с (X) – физическая величина, численно равная отношению химического количества растворенного вещества к объему раствора:
 .
.
Она выражается в моль/дм3.
Иногда на практике используют сокращенное обозначение молярной концентрации. Оно состоит из числа, большой буквы М и формулы вещества, например, «0,2 М HCl», что равнозначно записи: с (HCl) = 0,2 моль/дм3.
Молярная концентрация эквивалентов вещества (эквивалентная концентрация) –  – физическая величина, численно равна отношению химического количества эквивалентов растворенного вещества
– физическая величина, численно равна отношению химического количества эквивалентов растворенного вещества  к объему раствора:
к объему раствора:

Она также выражается в моль/дм3.
Моляльность растворенного вещества – b (X) – физическая величина, численно равная отношению химического количества растворенного вещества к массе растворителя:

Единицы моляльности – моль/кг.
Коэффициент растворимости вещества (растворимость) – s – максимальная масса вещества, способная раствориться в воде массой 100 г при данной температуре с образованием насыщенного раствора.
Коэффициентом растворимости также называют молярную концентрацию вещества в его насыщенном растворе при данной температуре.
Как правило, растворимость большинства твердых веществ при нагревании увеличивается.
Растворимость газов увеличивается при понижении температуры, а также при повышении давления газов над жидкими растворителями. Эта зависимость выражается законом Генри: Растворимость газа при постоянной температуре прямо пропорциональна его давлению над растворителем:
s (X) = k · p (X).
Пример 1.5.1. Рассчитайте объемы воды и раствора BaCl2 с массовой долей соли 10 % (ρ = 1,09 г/см3), необходимые для приготовления нового раствора объемом 1,0 дм3 с массовой долей соли, равной 2,0 %, и плотностью 1,012 г/см3.
Решение.
1. Вычислим массу нового раствора объемом 1,0 дм3:
m (р-ра) = V (р-ра) · ρ(р-ра) = 1000 см3 × 1,012 г/см3 = 1012 г;
2. Вычислим массу BaCl2 в полученном растворе m (BaCl2):
в растворе массой 100 г содержится BaCl2 массой 2 г,
в растворе массой 1012 г содержится BaCl2 массой x г,
 = 20,2 г.
= 20,2 г.
3. Вычислим массу исходного раствора, содержащего соль массой 20,2 г:
в растворе массой 100 г содержится BaCl2 массой 10 г,
в растворе массой y г содержится BaCl2 массой 20,2 г,
 = 202 г.
= 202 г.
4. Вычислим объем исходного раствора массой 202 г:
V (р-ра) =  =
=  = 185 см3.
= 185 см3.
5.Найдем массу и объем добавленной воды:
m (H2O) = m (приг. р-ра) - m (исх. р-ра) = 1012 - 202 = 810 г.
Поскольку плотность воды при комнатной температуре равна 1,0 г/см3, ее объем составит:
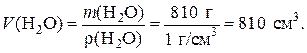
Пример 1.5.2. Рассчитайте массы воды и пентагидрата сульфата меди(II) (CuSO4 × 5H2O), необходимые для приготовления раствора объемом 1,0 дм3 с массовой долей CuSO4, равной 8,0 % (ρ = 1,084 г/см3).
Решение.
1. Найдем массу приготовленного раствора:
m (р-ра) = V (р-ра) × r(р-ра) = 1000 см3 × 1,084 г/см3 = 1084 г.
2. Найдем массу соли CuSO4 в этом растворе:
в растворе массой 100 г содержится CuSO4 массой 8 г,
в растворе массой 1084г содержится CuSO4 массой х г,
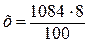 = 86,7 г.
= 86,7 г.
3. Вычислим массу кристаллогидрата, содержащего CuSO4 массой 86,7 г:
M (CuSO4 × 5H2O) = 160 г/моль + 5 × 18 г/моль = 250 г/моль.
В кристаллогидрате массой 250 г содержится CuSO4 массой 160 г,
в кристаллогидрате массой у г содержится CuSO4 массой 86,7 г:
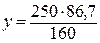 = 135,5 г.
= 135,5 г.
4. Найдем массу воды:
m (H2O) = m (приг. р-ра) – m (CuSO4 × 5H2O) = 1084 г - 135,5 г = 948,5 г.
Пример 1.5.3. Рассчитайте объемы воды и раствора серной кислоты с массовой долей 96 % (ρ = 1,84 г/см3), необходимые для приготовления раствора H2SO4 объемом 100 см3 с массовой долей 15 % и плотностью 1,10 г/см3.
Решение.
1. Найдем массу приготовленного раствора:
m (р-ра) = V (р-ра) · ρ(р-ра) = 100 см3 × 1,10 г/см3 = 110 г.
2. Найдем массу кислоты в приготовленном растворе:
в растворе массой 100 г содержится H2SO4 массой 15 г,
в растворе массой 110г содержится H2SO4 массой х г,
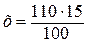 = 16,5 г.
= 16,5 г.
3. Найдем массу исходного раствора, содержащего такую массу H2SO4:
в растворе массой 100 г содержится H2SO4 массой 96 г,
в растворе массой у г содержится H2SO4 массой 16,5 г,
 = 17,19 г.
= 17,19 г.
4. Вычислим объем исходного раствора:
V (р-ра) =  =
= 
5. Вычислим массу воды, необходимую для приготовления раствора:
m (H2O) = m (приг. р-ра) – m (исх. р-ра) = 110 г – 17,19 г = 92,81 г.
6. Рассчитаем объем воды:

Пример 1.5.4. Какой объем раствора с массовой долей серной кислоты 80 % (ρ = 1,732 г/см3) потребуется для приготовления другого раствора объемом 250 см3, в котором молярная концентрация эквивалентов серной кислоты будет составлять 0,50 моль/дм3? Приготовленный раствор будет использован для осуществления реакции
H2SO4 + 2KOH = K2SO4 + 2H2O.
Решение.
1.Рассчитаем молярную массу эквивалентов кислоты:
Из уравнения реакции видно, сто эквивалентом кислоты является половина ее молекулы, т. е.  Поэтому молярная масса эквивалентов кислоты равна:
Поэтому молярная масса эквивалентов кислоты равна:
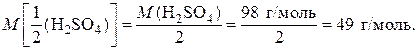
2.Найдем химическое количество эквивалентов кислоты в приготовленном растворе:
 0,25 дм3 · 0,5 моль/дм3 =
0,25 дм3 · 0,5 моль/дм3 =
= 0,125 моль
3.Рассчитаем массу H2SO4 в приготовленном растворе:
 = 49 г/моль · 0,125 моль =
= 49 г/моль · 0,125 моль =
= 6,125 г.
4.Найдем массу исходного раствора, содержащего H2SO4 массой 6,125 г:
в растворе массой 100 г содержится кислота массой 80 г,
в растворе массой х г содержится кислота массой 6,125 г,
 = 7,66 г.
= 7,66 г.
5.Вычислим объем исходного раствора серной кислоты:
V (р-ра) =  =
= 
Пример 1.5.5. Насыщенный при 60 оС раствор нитрата калия массой 40 г охладили до 20 оС. Найдите массу выделившегося при этом осадка KNO3, если коэффициенты его растворимости при указанных температурах равны соответственно 110,1 и 31,6 г.
Решение.
1.Найдем массу соли в исходном насыщенном при 60 оС растворе массой 40 г:
в растворе массой (100 + 110,1) г содержится соль массой 110,1 г,
в растворе массой 40 г содержится соль массой х г,
х = 
2.Найдем массу воды в этом растворе:
m (H2O) = m (р-ра) – m (KNO3) = 40 г – 20,96 г = 19,4 г.
Поскольку при охлаждении раствора в осадок выпадает безводная соль, масса воды в растворе не изменяется. Поэтому масса воды в охлажденном растворе также будет равна 19,4 г.
3.Вычислим массу KNO3, который образует насыщенный при 20 оС раствор, если масса воды равна 19,4 г:
в воде массой 100 г растворяется KNO3 массой 31,6 г,
в воде массой 19,4 г растворяется KNO3 массой y г,
 = 6,02 г.
= 6,02 г.
4.Найдем массу осадка соли:
Поскольку в охлажденном растворе над осадком останется соль масссой 6,02 г, масса осадка равна:
m (KNO3)↓ = 20,96 г – 6,02 г = 14,96 г.
Вопросы для самостоятельной подготовки
1. Дайте определение понятия «раствор».
2. Объясните с точки зрения молекулярно-кинетических представлений процесс растворения твердых, жидких и газообразных веществ в воде.
3. Чем отличаются растворы от механических смесей; от химических соединений?
4. Можно ли считать, что объем раствора всегда равен сумме объемов растворителя и растворенного вещества?
5. Какие факторы определяют тепловой эффект растворения?
6. Как влияет природа растворителя и растворяемого вещества на его растворимость? Какие еще факторы влияют на растворимость веществ?
7. Приведите примеры газов, имеющих незначительную и очень большую растворимость в воде. Чем это объясняется?
8. Как влияют температура и давление на растворимость газов в воде?
9. Может ли насыщенный раствор быть разбавленным, а концентрированный раствор – ненасыщенным? Приведите примеры.
10. Какие растворы называются пересыщенными? Как можно получить и сохранить пересыщенный раствор?
11. Что произойдет с насыщенным, пересыщенным и ненасыщенным растворами сульфата меди при внесении в каждый из них нескольких кристалликов медного купороса?
12. Что такое кристаллогидраты? Приведите примеры.
13. Что представляет собой коэффициент растворимости вещества и как его выражают?
14. Как изменяется растворимость веществ с изменением температуры?
15. Каковы основные способы выражения количественного состава растворов?
16. Что такое массовая доля вещества в растворе? Как она выражается?
17. Чем отличается молярная концентрация вещества от молярной концентрации эквивалентов вещества? Как они связаны между собой?
18. Найдите массовую долю H3PO4 в растворе, если ее молярная концентрация составляет 2,8 моль/дм3, а плотность раствора равна 1140 кг/м3.
19. Расчитайте молярную концентрацию эквивалентов HCl в растворе с массовой его долей, равной 36 %, если плотность раствора составляет 1,18 г/см3.
20. Как связаны молярные концентрации эквивалентов реагирующих веществ с объемами растворов, в которых они содержатся?
Задачи и упражнения
179. Рассчитайте массу карбоната калия и объем воды, необходимых для приготовления раствора объемом 1,2 дм3, в котором массовая доля соли будет равна 12 % (ρ = 1,11 г/см3).
180. Рассчитайте массу декагидрата сульфата натрия и объем воды, необходимых для приготовления раствора объемом 0,5 дм3, в котором массовая доля соли будет равна 14 % (ρ = 1,13 г/см3).
181. Вычислите массу дигидрата хлорида меди(II), который необходимо растворить в воде массой 0,8 кг для получения раствора с массовой долей хлорида меди(II), равной 14,5 %.
Дата добавления: 2015-07-25; просмотров: 113 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При различных сочетаниях знаков DrH и DrS 1 страница | | | При различных сочетаниях знаков DrH и DrS 3 страница |