
Читайте также:
|
Математическое выражение закона – уравнение Клапейрона:
 ,
,
где V 1 – объем газа при давлении р 1 и температуре Т 1; V 2 – объем газа при давлении р 2 и температуре Т 2.
При решении задач данное уравнение часто используется для расчета объема газа V o при нормальных условиях (р о ,Т о), если известно значение объема V 1 при других условиях (p 1, T 1):
 , откуда следует, что
, откуда следует, что  .
.
Пример 1.1.14. При температуре 45 оС и давлении 68,8 кПа объем газа равен 120,4 дм3. Вычислите его объем при нормальных условиях.
Решение.
Из уравнения объединенного газового закона выразим V 0 и рассчитаем его:
 .
.
Если химическое количество газа равно 1 моль, то значение дроби  является постоянной величиной и называется молярной газовой постоянной (R). В случае, когда давление газа выражается в кПа, а объем – в дм3, R принимает значение, равное 8,314 Дж/моль·K. С учетом этого для 1 моль газа можно записать:
является постоянной величиной и называется молярной газовой постоянной (R). В случае, когда давление газа выражается в кПа, а объем – в дм3, R принимает значение, равное 8,314 Дж/моль·K. С учетом этого для 1 моль газа можно записать:
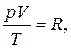 или pV = RT.
или pV = RT.
Если же химическое количество газообразного вещества равно n моль, то
pV = nRT.
Подставив в это уравнение  , получим уравнение Клапейрона – Менделеева:
, получим уравнение Клапейрона – Менделеева:
 .
.
Оно связывает математически давление газа, его объем, массу и температуру. Данное уравнение позволяет вычислить любую из входящих в него величин, если известны остальные.
Пример 1.1.15. Вычислите значение молярной массы вещества, если его пар массой 2,6 г при температуре 87 oС и давлении 83,2 кПа занимают объем, равный 1200 см3.
Решение.
Из уравнения Клапейрона – Менделеева выразим M и рассчитаем ее значение:

Закон парциальных давлений газов (закон Дальтона)
Дата добавления: 2015-07-25; просмотров: 135 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| При постоянном давлении отношение объема данной порции газа к его абсолютной температуре есть величина постоянная. | | | Общее давление смеси газов, не вступающих в химическое взаимодействие, равно сумме парциальных давлений каждого из указанных газов. |