
|
Читайте также: |
Облитерирующий тромбангиит (ОТ) — хроническое воспалительное заболевание артерий среднего и мелкого калибра, вен с преимущественным вовлечением дистальных отделов сосудов верхних и нижних конечностей (редко церебральных и висцеральных) и с последующим распространением патологического процесса на проксимальные зоны сосудистого русла [Olin J., 1994].
Сосудистые заболевания, сопровождающиеся гангреной дистальных отделов конечностей, были известны еще до нашей эры в Египте и Греции. Первым описал гангрену конечностей у мужчин молодого возраста Фу-кидид, живший в Афинах (430 лет до н.э.). Активное изучение происхождения гангрены нижних конечностей приходится на конец XIX в. Большинство исследователей того времени причину омертвения тканей видели в необратимых изменениях стенки сосуда с закрытием их просвета. Первый, кто высказал в 1869 г. предположение о первичном воспалительном процессе в сосудистой стенке, был Winiwarter, причем тромбоз, по его мнению, был следствием воспаления. Термин "облитерирующий эндартериит" предложил патологоанатом Fridlander в 1876 г., хотя первое классическое клиническое описание данного заболевания принадлежит опять же Winiwarter (1878). На основании клинико-анатомических исследований Buerger (1908) пришел к выводу, что повышение свертываемости и вязкости крови в сочетании с воспалительными изменениями сосудистой стенки приводит к развитию множественного тромбоза. Он же первым установил, что при этом заболевании поражаются не только артерии, но и вены, и придавал большое значение мигрирующему тромбофлебиту. Buerger назвал это заболевание облитерирующим тромбангии-
том и считал необходимым выделить его в отдельную нозологическую форму (1910). И лишь в 1955 г. на Международной ангиологической комиссии термин "облитерирующий тромбангиит", обозначающий отдельную нозологическую форму, был официально принят.
Gruber (1917) впервые высказал предположение об аллергической природе ОТ с клиническим проявлением гиперергической аллергической реакции. Поддержал и развил аллергическую теорию А.И.Абрикосов (1933). Параллельно появилась теория гиперадреналинемии, предложенная В.А.Оппелем (1911), который причину болезни видел в гиперфункции надпочечников. Помимо этих теорий, в развитии ОТ в различное время были предложены нейро-генная [Введенский А.А., 1892], кор-тикоорганная [Вишневский А. В., 1934] и нейрогуморальная [Шаповалов И.П., 1958] теории. В 70-е годы активное развитие иммунологии подтвердило возможность аутоиммунной природы ОТ.
Эпидемиология. Специальных эпидемиологических исследований распространенности ОТ в общей популяции не проводилось. По данным клиники Мейо (Рочестер, Миннесота, США), заболеваемость ОТ с конца 50-х до середины 80-х годов неуклонно снижалась. В 1986 г. она находилась на уровне 12,6 случая на 100 000 больных, обратившихся в эту клинику [Lie J., 1987, 1989]. В Испании с 1982 по 1990 г. было зарегистрировано 11 случаев на 100 000 больных [Fernandez-Miranda С. et al., 1993]. ОТ встречается у 2,6—6,7 % больных с патологией сосудов нижних конечностей; чаще болеют лица, проживающие на Ближнем Востоке, в Юго-Восточной Азии, Японии, Восточной Европе и Южной Америке [Tanade Т., 1994].
Этиология и патогенез. Этиология ОТ, несмотря на экспериментальные исследования и многочисленные клинические наблюдения, до настоящего времени остается во многом неясной. Продолжают дискутироваться основные положения этой сложной проблемы, причем ни одна из выдвинутых концепций не раскрывает в полной мере происхождения данного заболевания.
При тщательном анализе зарубежной и отечественной литературы за последние десятилетия удалось выявить некоторую закономерность в механизме развития ОТ.
Первичным звеном в этиопатоге-незе ОТ некоторые авторы считают его наследственную обусловленность, или генетическую предрасположенность. В последние годы, однако, возникла новая концепция, свидетельствующая об исключительной роли собственных антигенов гисто-совместимости в реализации ряда ключевых функций иммунитета, что создает предпосылки для расшифровки механизмов взаимосвязи между HLA-антигенами и болезнями. Гены HLA- системы главным образом связаны с регуляцией иммунного ответа и/или являются посредниками в иммунологических реакциях [Aerbajinai W. et al., 1997]. Отмечено, что антигены А1, В8, В9, В5, В7, DRW2 чаще встречаются у больных ОТ, чем у здоровых. Так, при наличии В5-антигена HLA-системы риск развития этого заболевания составляет 78,2 %.
Вполне вероятно, что не существует единых антигенов, ответственных за развитие ОТ, и их разнообразие объясняется этническими или региональными особенностями. Однако в любом случае представляют интерес механизмы реализации иммуно-генетической предрасположенности к ОТ. Наследственная предрасположенность может оказаться нереализованной без провоцирующих факторов внешней среды. Таким фактором, в частности, является табакокуре-
ние, которое усугубляет развитие заболевания и снижает эффект лечения. Само заболевание определяется даже как disease of young tabacco smokers (болезнь молодых курильщиков). Более 98 % больных ОТ являются злостными курильщиками, а по некоторым данным, ими являются все больные ОТ [Sayin A. et al., 1993].
Сравнительный анализ частоты ампутаций среди групп больных, продолжающих и прекративших курение, показал, что количество больших ампутаций у больных, продолжающих курить, в 18—22 раза больше, а эффект от проведенного оперативного и терапевтического лечения, как правило, оказывается непродолжительным. Ампутацию у больных, продолжающих курить, многие рассматривают как закономерный исход заболевания [Levesque H. et al., 1994].
Влияние табачного дыма на организм человека разнообразно. Самые вредные компоненты курения — монооксид углерода, котинин (основной метаболит никотина) и гликопроте-идный антиген, являющийся основным в пусковом механизме аутоиммунного процесса. Эти компоненты табачного дыма выступают в роли антигенов и повышают аллергическую "настроенность" организма, что подтверждается увеличением содержания IgE в сыворотке крови длительно курящих людей. Никотин и карбоксигемоглобин вызывают функциональные и структурные изменения эндотелиальных клеток.
Курение нарушает биосинтез тром-боксана А2 и простациклина, что приводит к нарушению реологических свойств крови и дисфункции эндотелия. В то же время некоторые авторы не исключают возможности изменения антигенной структуры интимы сосудов вследствие гипер-чувствительности к компонентам табачного дыма. Таким образом, курение следует рассматривать как фактор риска развития ОТ — этот провоцирующий фактор на фоне генетичес-
кой предрасположенности является пусковым механизмом гиперерги-ческой реакции замедленного типа. Рассмотрению ОТ как болезни с аллергическим генезом положили начало патоморфологические исследования А.И.Абрикосова (1935). По его мнению, сосудистая стенка из-за ее постоянной экспозиции по отношению к циркулирующим в крови веществам особенно легко сенсибилизируется. А.И.Абрикосов отметил, что ОТ присущи четыре признака, характеризующие этот патологический процесс как системное аллергическое воспаление:
• изменение не ограничивается тем сосудом, в районе разветвления которого развилась спонтанная гангрена;
• поражению свойственны приступы периодической вспышки процесса в новых местах;
• начальные изменения заключаются в фибриноидном некрозе стенки сосуда с последующим разрастанием внутренней оболочки и тромбозом;
• сходство морфологических изменений при ОТ с экспериментальной анафилатоксией у животных.
Анализ данных литературы последних лет свидетельствует о признании многими авторами аутоиммунного генеза ОТ. Процесс начинается в виде множественных разрывов внутренней эластической мембраны. Проведенные патогистологические исследования выявили гранулемы, содержащие гигантские клетки в области разрывов внутренней эластической пластинки, где обнаружено скопление IgG, анафилатоксинов СЗа, С5а, циркулирующих иммунных комплексов. Образующиеся в результате повреждения сосудистой стенки антигены (измененные клетки эндотелия) активируют Т- и В-звенья иммунитета [Ledford D.K., 1992].
Внутрисосудистая активация системы комплемента приводит к образованию ряда веществ, обладающих лигандными свойствами в отноше-
нии специфических рецепторов форменных элементов крови, тканевых макрофагов, тучных клеток. Следствием этих взаимодействий является образование биологически активных аминов, анафилатоксинов, способных вызвать локальные или распространенные изменения кровообращения [Maslowski L. et al., 1995].
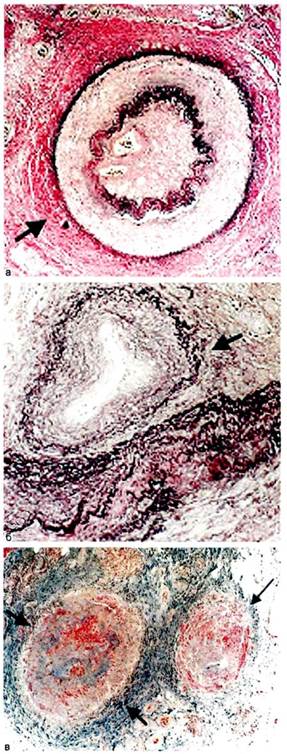
Сенсибилизированные Т-лимфо-циты, биологически активные амины, антисосудистые антитела, циркулирующие иммунные комплексы, анафилатоксины воздействуют на сосудистую стенку, что приводит к ее пролиферативному воспалению, увеличению проницаемости, агрегации тромбоцитов и нейтрофилов, вазо-констрикции. Таким образом, в основе патологии артерий при ОТ лежит иммунное воспаление, представляющее собой проявление как замедленной, так и немедленной гиперчувствительности. Преобладают при ОТ продуктивные артерииты с имму-ноклеточным механизмом повреждения сосудистой стенки. Реже развиваются некротические (деструк-тивно-инфильтративные и деструк-тивно-пролиферативные) артерииты, также с иммуноклеточным механизмом повреждения. Иммунному воспалению при ОТ подвергаются не только артерии (рис. 7.14), но и вены, а также сосуды системы микроциркуляции (артериолы, капилляры, венулы). При деструктивном характере поражения в стенке этих сосудов выявляются иммунные комплексы.
Иммунологические изменения в стенке сосудов приводят к мукоид-ному набуханию интимы, адвенти-ции, дистрофии и деструкции эндотелия, воспалительной инфильтрации стенок и как результат — возникновению тромбозов в пораженном сосуде [Lie J.Т., 1989]. Воспаление сосудистой стенки вызывает локальное ухудшение кровотока и ишемию тканей. На фоне локальной ишемии выявляются значительное местное снижение регионарного уровня основных компонентов противосвертыва-
|
ющей системы (антитромбин III, антитромбин — резерв), резкое замедление Хагеманза-висимого фибринолиза и эу-глобулинового лизиса. На фоне локального поражения сосудистой стенки (артерий и вен) отмечается значительное повышение уровня фактора Вил-лебранда. Заметно повышается уровень спонтанной и АДФ-индуцированной агрегации тромбоцитов. При активации местных механизмов гемостаза (сосудистых и тромбоцитар-ных), усилении свертывающих свойств крови на фоне про-грессирования патологического процесса в сосудистой стенке, истощения и угнетения естественных противосвертываю-щих и плазминовых механизмов развивается стойкая локальная предтромботическая ситуация в сосудах пораженной конечности (артерии и вены).
Таким образом, иммунные реакции, приводящие к повреждению эндотелия сосуда, являются первичными. Гиперкоагуляция крови играет вторичную, но очень важную роль в развитии болезни. Иммунные комплексы, отлагающиеся в тканях, обнаружены в 100 %, аутоантитела к сосудистой стенке - в 86 % [Li L., 1989]. В схематическом виде патогенез заболевания выглядит так: генетическая предрасположенность, курение, запуск аутоиммунного процесса, отек сосудистой стенки с ее повреждением, локальный тромбоз (схе-
Рис. 7.14. Облитерирующий тромб-ангиит артерий (а), вен (б), арте-риол и венул (в). Микроскопическая картина. Электронное фото.

ма 7.1). Понимание этого процесса очень важно для выработки тактики лечения больных ОТ.
Клиническая картина. Облитери-рующий тромбангиит — заболевание, встречающееся главным образом у молодых мужчин (18—40 лет). Патологический процесс всегда по-

Рис. 7.15. Локализация поражения артерий при облитерирующем тромбангиите.
ражает дистальные отделы магистральных артерий нижних конечностей. В 25 % случаев патологический процесс локализуется в дистальных отделах магистральных артерий верхних конечностей. Встречаются единичные случаи поражения висцеральных, коронарных и брахиоце-фальных артерий при ОТ (рис. 7.15). В течении заболевания выделяют 3 варианта:
• острое злокачественное генерализованное, встречающееся обычно у молодых больных (18—25 лет), когда в период от 3 мес до 1 года процесс приобретает системный характер;
• подострое волнообразное в виде обострений и ремиссий различной продолжительности;
• хроническое, постепенно прогрессирующее (болезнь развивается в течение многих лет с длительным периодом компенсации регионарного кровообращения без выраженных обострений). Это наиболее благоприятный вариант. Хроническое течение чаще наблюдается у больных в возрасте 30—35 лет и впоследствии нередко сочетается с атеросклерозом.
Клиническое течение ОТ принципиально разделяется на 2 основные стадии: функциональную — спастическую и облитерирующую — органическую. Спастическая стадия заболевания сопровождается невыраженной симптоматикой. Больные ощущают онемение, парестезии, волнообразные приливы похолодания, зябкости конечностей в дистальных отделах, беспричинную усталость, зуд, тяжесть в ногах, обычно под действием провоцирующих факторов. Эти жалобы носят преходящий характер, и больные нередко остаются без врачебного внимания и помощи. Объективные показатели гипоксии конечностей мало выражены и обратимы. Возможны стертые проявления перемежающейся хромоты и болевого синдрома. Не следует считать, однако, эту практически доклиническую стадию заболевания находящейся
I
вне компетенции врача. Заболевание прогрессивно развивается, поэтому лечение важно начать в обратимой, функциональной фазе заболевания. Стадия облитерации дистального артериального русла характеризуется возникновением регионарной ишемии, когда клинические проявления стабилизируются. Соответственно выраженности ишемии конечности меняется клиническая картина. Сначала обнаруживаются повышенная утомляемость конечностей, чувствительность к холоду, онемение, дис-гидроз, парестезии, в дальнейшем присоединяются перемежающаяся
хромота и болевой синдром. Нарастают трофические нарушения: уменьшение тургора кожи и ее эластичности, гипотермия, нарушение потоотделения, изменение цвета и роста ногтей, волос. Часто возникают па-ронихии и панариции, наблюдается атрофия кожи, подкожной клетчатки, мышц стопы и голени. Трофические изменения затрагивают и костные структуры стопы.
При прогрессировании заболевания развиваются и необратимые трофические изменения: вначале поверхностные, а затем и глубокие язвы (рис. 7.16), гангрена. Язвы плохо

Рис. 7.16. Глубокая язва дистального отдела стопы при облитерирующем тромбангиите.
поддаются консервативному лечению, легко инфицируются, сопровождаются постоянными болями в покое, приводят к вынужденному положению конечности. Наряду с этим в поздних стадиях ОТ возникают паралич капилляров, лимфангиит, флебит, сопровождающиеся температурной реакцией, цианозом стопы, голени, развитием влажной гангрены. В этой фазе заболевания наряду с признаками резкой регионарной ишемии обычно возникают симптомы общей интоксикации и септического состояния организма.
Для клинической характеристики поражения сосудистого русла при ОТ используют стандартную классификацию ишемии конечности: I степень ишемии — субклинические проявления (в описании спастической стадии заболевания); II степень — явления перемежающейся хромоты; III степень — появление болей в покое; IV степень — наличие язвенно-некротических дефектов на стопе.
Диагностика. ОТ, как правило, не сопровождается поражением ветвей аорты, поэтому обычные для атеро-склеротического поражения шумы над бедренными артериями, брюшной аортой и ветвями дуги аорты не определяются. Характерное для ОТ поражение дистальных артерий в первую очередь устанавливают пальпацией тыльной артерии стопы, задней большеберцовой, подколенной, локтевой и лучевой артерий. Резкое ослабление пульсации или ее отсутствие свидетельствуют об органическом поражении.
При вовлечении поверхностных вен конечностей заболевание начинается остро, нередко после сильного переутомления, травмы, инфекционных заболеваний (грипп, ангина и др.), местной инфекции. Первыми его признаками являются ноющие боли по ходу подкожных вен голени и стопы, реже верхних конечностей. Участки поражения вен могут быть ограниченными (в виде горошин) или достаточно распространенными
(длиной до 15—20 см). Вены утолщаются, появляется инфильтрация кожи. Больной жалуется на чувство тяжести, зуд, жжение, "налитость" конечностей; тромбофлебиты носят "мигрирующий" характер. Одновременно наблюдаются субфебрилитет, увеличение СОЭ, лейкоцитоз. Когда наступает период ремиссии, вены слегка болезненны, утолщены, пара-вазальная клетчатка уплотнена.
В патологический процесс вовлекается и артериальное русло. При этом значительно меняется цвет кожи, которая становится отечной, ци-анотичной, а при опускании конечности возникает гиперемия кожных покровов. У больных развиваются отеки стоп, области голеностопных суставов. На первых этапах заболевания артериального русла можно выделить довольно короткий спастический период, в дальнейшем быстро переходящий в характерную картину тромбоза дистальных артерий конечности.
Инструментальное обследование направлено на оценку регионарной макро- и микрогемодинамики пораженной конечности.
Для оценки регионарной макрогемодинамики используют комплексное ультразвуковое исследование, которое заключается в определении сегментарного артериального давления на уровне верхней и нижней третей бедра и голени с вычислением лоды-жечно-плечевого индекса (ЛПИ), а также спектральный анализ доппле-ровского сигнала с определением характера кровотока по пораженным артериальным сегментам. Результаты, полученные при измерении АД на лодыжке, и величины ЛПИ при ОТ выше, чем у больных с соответствующими клиническими стадиями ишемии вследствие атеросклероти-ческого поражения. Более высокие цифры АД на лодыжке и Л ПИ при ОТ связаны с повышенной жесткостью пораженных берцовых артерий, которые противодействуют компрессии манжеты. Необходимо подчерк-
нуть, что определение ЛПИ имеет значение прежде всего для динамического наблюдения за состоянием кровообращения у больного в процессе лечения.
В комплексе ультразвуковых методов диагностики используют также дуплексное сканирование. Его применение необходимо при сомнениях в проходимости артериального сегмента в месте предполагаемого наложения проксимального анастомоза; при оценке возможности использования большой подкожной вены в качестве трансплантата в предоперационном периоде; для послеоперационного контроля функционирования артериального трансплантата.
Окончательным методом оценки поражения дистального артериального русла является селективная рент-геноконтрастная ангиография, выполненная через трансфеморальный (контралатеральная конечность) или трансаксиллярный доступ по методике Сельдингера (рис. 7.17). Если больному не показано хирургическое
вмешательство, ангиографию проводить не следует.
Наиболее информативным методом оценки микроциркуляции пораженной конечности является транс-кутанное определение напряжения кислорода на стопе.
Исследование проводят в положении больного лежа и сидя, датчик фиксируют на тыльной поверхности стопы в первом межпальцевом промежутке. При напряжении кислорода в положении лежа менее 30 мм рт.ст. показано проведение активной внутривенной инфузионной терапии. При напряжении кислорода менее 10 мм рт.ст. ожидать положительного результата от консервативной терапии нецелесообразно, и при наличии условий необходима реконструктивная сосудистая операция.
Лабораторная диагностика. Лабораторные изменения при ОТ неспецифичны. Практически отсутствуют ускорение СОЭ и лейкоцитоз. В то же время повышение концентрации С-реактивного белка (СРВ) отмеча-

|
Рис. 7.17. Типичное поражение артерий голени и стопы при облитерирую-щем тромбангиите.
ется более чем у 60 % больных и коррелирует с индексом клинической активности васкулита [Баранов А.А. и др., 1997]. Большое внимание необходимо уделять показателям клеточного и гуморального иммунитета. Показателями истинной активности ОТ являются данные гуморального иммунитета, а именно циркулирующие иммунные комплексы, IgG и IgM. Повышение их уровня требует назначения противовоспалительной терапии.
Лечение больных ОТ — трудная задача. Оно включает амбулаторный, стационарный, санаторно-курортный этапы, консервативные и хирургические методы. Следует учитывать форму заболевания, стадию, ведущие патогенетические звенья в его развитии. Без этого лечение становится неэффективным и приводит к инва-лидизации больного. Наиболее эффективным способом предотвращения прогрессирования болезни является полный отказ от курения. У больных, которые отказались от курения, необходимость в ампутации конечностей возникает очень редко.
В спастической стадии болезни пациенты подлежат диспансерному наблюдению. В комплекс медикаментозных препаратов входят средства, улучшающие микроциркуляцию, — ангинин (продектин), трентал, агапу-рин; сосудорасширяющие — мидо-калм, бупатол, миолитики (но-шпа, папаверин); воздействующие на периферические холинореактивные системы (падутин, андекалин, депо-калликреин, прискол, вазоластин); витамины группы В (В1 В6, В12); транквилизаторы, седативные средства, антидепрессанты при психогенных нарушениях. Кроме того, рекомендуется физиотерапия (диатермия на область поясницы, диадинамичес-кие токи на область поясницы и стопы), санаторно-курортное лечение (сероводородные, радоновые, нарзанные, хвойно-жемчужно-кислородные ванны, грязевые аппликации на область поясницы), лечебная физкультура.
При II стадии заболевания больные также подлежат диспансерному наблюдению и консервативному лечению. Дважды в год требуются стационарное консервативное лечение и проведение комплексного ультразвукового исследования для уточнения степени и распространенности поражения артериального русла конечностей. К перечисленным выше медикаментозным средствам следует добавить солкосерил, никошпан, га-лидор, пипольфен, преднизолон, эс-кузан, индометацин (метиндол).
Целесообразно проведение курса внутривенных вливаний реополи-глюкина по 400 мл ежедневно в течение 10 дней. В стадии стойкой ремиссии показано бальнеологическое лечение на курортах Кавказских Минеральных Вод и в санаториях с аналогичным комплексом минеральных вод и грязелечения.
В III и IV стадиях заболевания (критическая ишемия конечности) при болях в покое и трофических расстройствах лечение носит другой характер и проводится обязательно в условиях стационара. При повышении показателей гуморального иммунитета (ЦИК и IgG и IgM), а также С-реактивного белка есть показания к проведению противовоспалительного лечения — ударная пульс-терапия (депо-преднизолоны и цитоста-тики). Назначают препараты, улучшающие микроциркуляцию (пенток-сифиллин) и дезагреганты (ацетилсалициловая кислота, курантил, тиклид). Антикоагуляционную терапию назначают в зависимости от изменений коагулограммы. Показан курс внутривенных вливаний реопо-лиглюкина с тренталом и солкосерил ом.
Целесообразно применение длительных эпидуральных блокад, являющихся эффективным методом улучшения регионарного кровотока. Блокаду выполняют с помощью постоянного микроирригатора, введенного в эпидуральное пространство на уровне L.i 2- В качестве анестетика
рекомендуется 2 % раствор тримека-ина по 10 мл 3—6 раз в сутки в течение 7—10 дней.
При поздних стадиях заболевания показаны длительные внутриартери-альные инфузии с помощью катетеризации наружной подвздошной артерии через нижнюю надчревную артерию. Инфузии проводят 2 раза в сутки; курс продолжают до 3 нед. Инфузат может включать в себя новокаин, глюкозу, реополиглюкин, гепарин, антибиотики (после определения чувствительности флоры язвенно-некротического дефекта), солко-серил, трентал, компламин, витамины С и группы В.
При лечении критической ишемии у больных ОТ наиболее эффективен препарат вазапростан (проста-гландин Е1). Проводят 20—28 внутривенных инфузии по 60 мкг/сут. На поздних стадиях заболевания возникает необходимость хирургического лечения.
Отдельного внимания заслуживает лечение больных ОТ с явлениями мигрирующего тромбофлебита. Это лечение проводят в условиях стационара. С момента появления первых признаков воспаления поверхностных вен лечение должно быть направлено на борьбу с аллергическим, воспалительным процессом и вторичным спазмом дистального артериального русла. Больным назначают витамины, общеукрепляющие средства.
Лечение мигрирующего тромбофлебита позволяет предотвратить артериальный тромбоз и резкое ухудшение состояния больных. Уменьшить воспалительную реакцию венозной стенки можно с помощью местного лечения: чередования спиртовых компрессов с гепариновой мазью, с водорастворимыми мазями (левомеколь, левосиновая мазь, диоксиколь), а также назначения медикаментозной терапии (эскузан, троксевазин).
Эффективно использование прямых антикоагулянтов и антиагрегант-ных препаратов. Одновременно долж-
на проводиться внутривенная инфу-зионная терапия реополиглюкином с тренталом и солкосерилом.
Хирургическое лечение больных ОТ показано при II—IV стадиях заболевания и включает 3 основных вида операций: реконструктивные, паллиативные, органоуносящие. Эти операции могут применяться в сочетании.
Реконструктивные операции, направленные на восстановление проходимости дистального артериального русла при ОТ, выполняют в тех случаях, когда процесс носит сегментарный характер. Методы операций не отличаются от таковых при обли-терирующем атеросклерозе, однако дистальный анастомоз нередко накладывают на уровне берцовых артерий в нижней трети голени. Предпочтительно аутовенозное бедренно-подколенное или бедренно-берцовое шунтирование.
При восходящем артериальном тромбозе, достигающем устья глубокой артерии бедра, возможны два вида операций: не всегда успешная тромбэндартерэктомия из бедренной артерии или профундопластика, направленная на обеспечение кровотока по этой важной магистрали кровообращения. Во всех случаях реконструктивные операции при ОТ желательно сочетать с поясничной симпатэктомией.
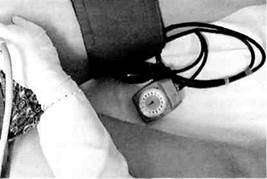
Предложенная в 1924 г. J.Diez поясничная симпатэктомия направлена на ликвидацию ангиоспазма дистального артериального русла, а также стимуляцию коллатерального кровообращения. Показанием к проведению поясничной симпатэктомии является прирост линейной скорости кровотока по общей бедренной артерии на 50 % и более после ишеми-ческой пробы (компрессия на протяжении 3 мин верхней трети бедра манжетой при давлении, превышающем системное) (рис. 7.18). Симпатэктомия показана при II и III стадиях заболевания; успех ее проведения при IV стадии заболевания сомнителен. Показания к десимпатизации зави-
|
Рис. 7.18. Проведение компрессионной пробы при облитерирующем тромбан-гиите.
сят от локализации процесса. При преимущественном поражении левой нижней конечности показана левосторонняя внебрюшинная поясничная симпатэктомия LII-III. При преимущественном поражении правой нижней конечности, а также при

Рис. 7.19. Уровни ампутации при определении ТсР02 у больных облитерирую-щим тромбангиитом.
двустороннем поражении показана одновременная двусторонняя внебрюшинная поясничная симпатэктомия LII-III. При одновременном поражении верхних и нижних конечностей целесообразно поэтапное проведение грудной и поясничной сим-патэктомии.
Поясничная симпатэктомия сопровождается повышением температуры кожи в связи с улучшением мышечного кровотока в нижних конечностях, особенно на стопе. Условиями успешного оперативного лечения являются строгое определение показаний к нему и продуманное патогенетически обоснованное консервативное лечение, адекватная послеоперационная реабилитация.
При отсутствии эффекта от комплексного лечения больного при IV стадии ОТ показана ампутация конечности в соответствии с требованиями последующего протезирования и формированием культи только из жизнеспособных тканей. При выборе уровня ампутации необходимо ориентироваться на данные транску-танного определения напряжения кислорода, полученные на различных уровнях пораженной конечности (рис. 7.19). Уровень кислорода 40 мм рт.ст. и более в избранном сегменте конечности позволяет сделать благоприятный прогноз в отношении
перспектив заживления послеоперационной раны.
При невозможности выполнения стандартной реконструктивной операции из-за отсутствия проходимых артерий на стопе и голени используют и другие методы реваскуляриза-ции дистальных отделов конечности: имплантацию сальника на сосудистой ножке на голень и артериализа-цию с реверсией венозного кровотока стопы и голени.
Трансплантацию сальника на голень применяют в двух видах — свободном и на сосудистой ножке. Эффект лечения обусловлен прежде всего местным действием сальника. При трансплантации сальника на голень явления критической ишемии удается купировать в 67—86 % случаев, причем при успешной операции отмечается стойкий эффект.
Эффект от операции наблюдается лишь через 3—4 нед. Рецидив ишемии наступает в 5—10 % случаев в течение 5 лет.
Другой вид лечения критической ишемии у больных ОТ — артериали-зация венозного кровотока стопы. Эта методика, предложенная A.Sheil в 1977 г., была усовершенствована и активно применяется в отделении хирургии сосудов Института хирургии им. А.В.Вишневского [Покровский А.В. и др., 1990, 1996, 1998] (рис. 7.20). В раннем послеоперационном периоде удается сохранить 83—90 % конечностей от ампутации. Через 5 лет жизнеспособными и функционально полноценными остается около 75—80 % оперированных конечностей.
Таким образом, лечение больных ОТ должно носить комплексный характер. При наличии органических изменений сосудов показаны обследование и стационарное лечение 2 раза в год.
Прогноз при ОТ в отличие от атеросклероза в целом благоприятный — при условии отказа от курения. Смертность больных не превышает

Рис. 7.20. Артериализация глубокой венозной системы стопы у больного обли-терирующим тромбангиитом.
таковой в общей популяции. Летальные исходы наиболее часто встречаются при поражении сосудов кишечника, распространенном поражении сосудов верхних и нижних конечностей, при тромбоэмболии ветвей легочной артерии и инфекционных осложнениях заболевания. Без адекватного лечения у 70 % больных в течение первых 3 лет от начала заболевания приходится выполнять различные ампутации [Mills J. et al., 1991]. Риск эпизодов обострения гораздо выше у больных, не прекращающих курения.
Литература
Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. — Ярославль: Верхняя Волга, 1999. — 616 с.
Покровский А.В., Дан В.Н., Хоровец А.Г., Чу-пин А.В. Артериализация венозного кровотока стопы в лечении тяжелой ишемии у больных с окклюзирующими поражениями дистального артериального русла нижних
1Д-4ЯЯК
конечностей // Хирургия. — 1990. — № 5. — С. 35-42.
Покровский А.В., Дан В.Н., Чупин А.В., Хо-ровец А. Г. Артериализация венозной системы стопы в лечении критической ишемии нижней конечности при окклюзии дисталь-ного артериального русла//Ангиол. и сосуд. хир. - 1996. - № 4. - С. 73-93.
Aerbajinai W., Tsuchiya Т., Kimura A. et al. HLA class II DNA typing in Buerger's disease // Int. J. Cardiol. - 1997. - Vol. 54. - Suppl. SI 97-202.
Bhargava J.S., Makker A., Bhargava K., Shaunik A. V., Sharda A., Kumar P.S. Pedicled omental transfer for ischaemic limbs-a 5-year experience // J. Indian. Med. Assoc. — 1997. — Vol. 95, N4. - P. 100-102.
Fernandez-Miranda C, Rubio R., Vicario J.L. et al. Tromboangitis obliterante (enfermedad de Buerger). Estudio de 41 casos // Med. Clin. Bare. - 1993. - Vol. 9 - P. 3.
Ledford D.K. Immunologic aspects of cardiovascular disease // J.A.M.A. — 1992. — Vol. 268, N 20. - P. 2923-2929.
Levesque H., Cailleux N., Courtois H. Peptides vasoactivs d'origine endotheliale. Perspectives therapeutiques / Presse med. — 1994. — Vol. 23, N 25. -P. 1172-1177.
Li L. Preliminary application of the immuno-gold-silver staining technique in diagnosing
thromboangiitis obliterans//Chung. Hua. Wai. Ко. Tsa. Chih. - 1989. - Vol. 27, N 4. -P. 233-235.
Lie J.T. Thromboangiitis obliterans (Buerger's disease) revisited//Path. Ann. — 1988. — Vol. 23, Pt. 2. - P. 257-291.
Lie J.T. The rise and fall and resurgence of thromboangiitis obliterans (Buerger's disease) // Acta. Pathol. Jpn. - 1989. - Vol. 39, N 3. -P. 153-158.
Maslowski L., Szaba A., Zawadzka A. The concentration of immunoglobulins in the blood of patients with Buerger's disease // Int. Angiology. - 1995. - N 1. - P. 362.
Mills J.L., Porter J.M. Buerger's disease (thromboangiitis obliterans) // Ann. Vase. Surg. - 1991. - Vol. 5, N 6. - P. 570-572.
Olin J. W. Thromboangiitis obliterans // Curr. Opin. Rheumatol. - 1994. - Vol. 6, N 1. -P. 44-49.
SayinA., Bozkurt A.K., Tuzun N. et al. Surgical treatment of Buerger's disease: experience with 216 patients // Cardiovasc. Surg. — 1993. — Vol. 1, N 4. - P. 377-380.
Tanabe T. Intractable vasculitis syndromes — incidence and epidemiology // Nippon. Rinsho. - 1994. - Vol. 52, N 8. - P. 1987-1991.
Дата добавления: 2015-10-21; просмотров: 131 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Облитерирующий атеросклероз | | | Окклюзионные поражения артерий стопы |