
Читайте также:
|
Принципы коррекции низкой про-
изводительности сердца у кардио-
хирургических больных были сфор-
мулированы J.Kirklin и N.Kouchou-
kos в 1974 г. Предложенный подход
основан на оценке основных детер-
минант сердечного выброса: конт-
рактильности, преднагрузки, пост-
нагрузки и частоты сердечных со-
кращений. Алгоритм содержит ряд
допущений. Во-первых, адекват-
ность преднагрузки желудочков
сердца оценивается по величине
давлений наполнения желудочков
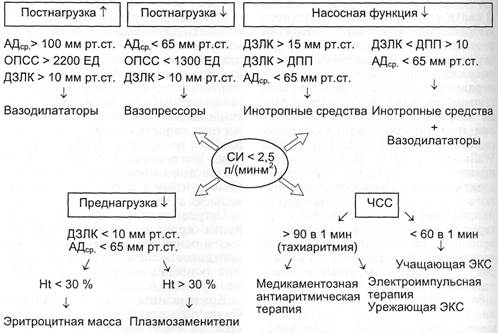
Схема 3.2. МОДИФИЦИРОВАННЫЙ АЛГОРИТМ КОРРЕКЦИИ НИЗКОГО СЕРДЕЧ-
НОГО ВЫБРОСА
|
сердца, в то время как состояние
притока крови к сердцу более точно
отражает конечно-диастолический
объем желудочков сердца. У ряда
больных между этими параметрами
нет прямой корреляционной зави-
симости. Кроме того, ДЗЛК соот-
ветствует КДД левого желудочка
при отсутствии легочной гипертен-
зии, а среднее давление в правом
предсердии соответствует КДД пра-
вого желудочка при интактном три-
куспидальном клапане. Во-вторых,
описывая состояния, характеризую-
щиеся высоким давлением напол-
нения желудочков сердца и низким
СВ, авторы пользуются термином
«контрактильность», т.е. сократите-
льная функция миокарда, в то
время как в физиологии для этих
целей пользуются параметрами, ха-
рактеризующими силу и скорость
сокращения мышечных волокон
сердца. С нашей точки зрения, бо-
лее корректно пользоваться терми-
ном «насосная функция сердца»,
хотя для лечения подобных состоя-
ний используют препараты, улуч-
шающие контрактильность. В-тре-
тьих, при оценке сопротивления
изгнанию крови, т.е. постнагрузки,
по величине среднего АД можно
судить при отсутствии патологии
аортального клапана. И наконец,
алгоритмом можно пользоваться,
исключив такие осложнения, как
тампонада миокарда, падение про-
изводительности сердца при сдав-
лении полых вен или смещении
средостения в результате пневмото-
ракса и массивного гемо- или гид-
роторакса, а также нарушений рит-
ма сердца.
Модифицированный алгоритм
коррекции низкого сердечного вы-
броса представлен на схеме 3.2.
Падение СВ на фоне высоких
значений давления наполнения же-
лудочков сердца является показа-
нием к назначению препаратов с
положительным инотропным эф-
фектом. Подбор препарата и его
дозы осуществляют индивидуально
под контролем показателей гемоди-
намики и кислородтранспортной
функции. Более подробно совре-
менные подходы к назначению
препаратов этой группы изложены
в разделе «Симпатомиметики».
В комплексной терапии сердеч-
ной недостаточности также исполь-
зуют диуретики и препараты, улуч-
шающие метаболизм и энергетиче-
ский потенциал миокарда (40 %
раствор глюкозы с инсулином, фос-
фокреатин, цитомак, альфа-токо-
ферол). Низкая производительность
сердца может наблюдаться в случа-
ях изолированной или превалирую-
щей правожелудочковой недоста-
точности. При этом давление на-
полнения правого желудочка серд-
ца выше ДЗЛК. Лечение заключает-
ся в назначении инотропных пре-
паратов в сочетании с вазодилата-
торами.
При снижении преднагрузки, ха-
рактеризующемся падением СВ на
фоне низких давлений наполнения
желудочков сердца, показана инфу-
зия плазмозаменителей, а если на-
блюдаются низкие значения гема-
токрита, — эритроцитной массы
(см. раздел «Послеоперационные
кровотечения»).
Для определения оптимального
давления наполнения желудочков
сердца целесообразно пользоваться
пробой с нагрузкой объемом жидко-
сти. Для этого в центральную вену в
быстром темпе вводят раствор плаз-
мозаменителя, регистрируя измене-
ние СВ при увеличении ДЗЛК и
ДПП на 1—2 мм рт.ст. Если во
время проведения пробы СВ снижа-
ется, инфузию жидкости прекраща-
ют. На рис. 3.30 представлены вари-
анты кривых функции левого желу-
дочка сердца. При нормальном от-
вете на пробу значения СИ достига-
ют 2,5— 3,5 л/(мин • м2) после воз-
растания ДЗЛК до 10—12 мм рт.ст.
(кривая 1). У некоторых больных
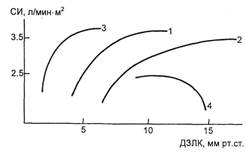
Рис. 3.30. Алгоритм регуляции сердеч-
ного выброса. Объяснение в тексте.
нормальная производительность
сердца наблюдается при высоких
давлениях наполнения, достигаю-
щих 18—20 мм рт.ст. (кривая 2).
Встречаются случаи, когда нормаль-
ная производительность сердца на-
блюдается при относительно невы-
соких значениях показателей пред-
нагрузки (кривая 3). У ряда пациен-
тов при низких давлениях наполне-
ния желудочков сердца инфузия не-
больших объемов приводит к резко-
му падению СИ, что свидетельству-
ет о низких функциональных резер-
вах миокарда и необходимости ино-
тропной поддержки (кривая 4). В
этих случаях возможно введение
жидкости в медленном темпе под
прикрытием симпатомиметиков.
Высокое сопротивление изгна-
нию крови (постнагрузка) характе-
ризуется повышением среднего АД
и ОПСС. В этих случаях необходи-
мо прежде всего исключить цент-
рализацию кровообращения в резу-
льтате гиповолемии, поэтому пер-
воначально производят восполне-
ние ОЦК до нормальных значений
давлений наполнения желудочков
сердца, после чего начинают инфу-
зию вазодилататоров (см. раздел
3.9.2.4).
В ряде клинических ситуаций
встречается относительная гипово-
лемия или сосудистая недостаточ-
ность. При этом для нормализации
АД и СИ применяют препараты с
вазопрессорным эффектом.
Падение производительности сер-
дца может развиваться на фоне бра-
диаритмий (синусовая, узловая бра-
дикардия, атриовентрикулярная
блокада II—III степени), а также та-
хиаритмий. Коррекцию этих нару-
шений осуществляют с помощью
электрокардиостимуляции, электро-
импульсной терапии или медика-
ментозной терапии.
Симпатомиметики. J.Wilson и со-
авт. (1999), опираясь на результаты
контролируемого рандомизирован-
ного исследования, пришли к за-
ключению, что периоперационное
применение инотропной поддерж-
ки и регуляция жидкостного балан-
са под контролем инвазивного мо-
ниторинга значительно снижают
число осложнений, летальность и
сроки пребывания в стационаре бо-
льных. При операциях на сердце и
магистральных сосудах частота ис-
пользования симпатомиметиков до-
стигает 50 %. Основные гемодина-
мические эффекты наиболее часто
используемых симпатомиметиков
представлены в табл. 3.3.
Таблица 3.3. Гемодинамические эф-
фекты терапевтических доз симпато-
миметиков

Основными показаниями к ис-
пользованию симпатомиметиков
являются сердечная, сосудистая
недостаточность или их сочетание.
В связи с этим при выборе препа-
рата и подборе его оптимальной
дозы учитывают особенности их
влияния на гемодинамику и кисло-
родтранспортную функцию паци-
ентов. Гемодинамические эффекты
симпатомиметиков определяются
их дозой и индивидуальной чувст-
вительностью больного к препа-
рату.
Известно, что наиболее выражен-
ным хронотропным эффектом об-
ладает изопротеренол, поэтому он
является препаратом выбора у бо-
льных с брадикардией и нарушени-
ями проводимости сердца. Прове-
денные нами исследования показа-
ли, что изопротеренол снижает со-
противление большого и малого
круга кровообращения и увеличи-
вает показатели оксигенации арте-
риальной крови. Допамин при ис-
пользовании его в дозах свыше
5 мкг/(кг • мин) вызывал статисти-
чески значимое повышение сопро-
тивления сосудов малого круга кро-
вообращения и фракции внутриле-
гочного шунтирования. Эти эффек-
ты не характерны для добутамина,
поэтому ему следует отдавать пред-
почтение у больных с легочной ги-
пертензией и нарушениями оксиге-
нирующей функции легких. У па-
циентов, имеющих сочетание сер-
дечной недостаточности с наруше-
нием функции почек, оправдано
применение средних доз добутами-
на и небольших [до 2 мк/(кг • мин)]
доз допамина.
В ряде клинических ситуаций на-
блюдаются признаки высокой пост-
нагрузки сердца в сочетании с на-
рушением его инотропной функ-
ции. В подобных случаях сочетают
введение инотропных средств (до-
бутамин, допамин) с вазодилатато-
рами (нитропруссид натрия, адалат,
исрадипин).
Адреналин считается препаратом
выбора при анафилактических ре-
акциях, которые могут возникать во
время операции или в послеопера-
ционном периоде. Кроме того, в
ряде случаев, когда высокие дозы
добутамина или допамина не при-
водят к стабилизации гемоди-
намики, улучшить ситуацию уда-
ется путем подключения 300—
500 нг/(кг • мин) адреналина.
 В учебниках по сердечно-сосуди-
В учебниках по сердечно-сосуди-
стой хурургии, издаваемых 20 лет
назад, звучал прямой запрет на ис-
пользование норадреналина [Кон-
стантинов Б.А., 1981]. В настоящее
время благодаря усовершенствова-
нию методов диагностики стало
возможным диагностировать изоли-
рованную сосудистую недостаточ-
ность, в результате чего норадрена-
лин был «реабилитирован» и нашел
свое место в послеоперационной
интенсивной терапии у данной ка-
тегории больных. Изолированная
сосудистая недостаточность в по-
слеоперационном периоде может
наблюдаться при выраженной ги-
пертермии, интоксикации после ре-
васкуляризации нижних конечно-
стей на фоне выраженных доопера-
ционных трофических нарушений,
при сепсисе и синдроме полиорган-
ной недостаточности. В этих случа-
ях удается добиться улучшения ге-
модинамики на фоне введения
50—500 нг/(кг-мин) норадреналина.
Препарат также может применяться
в сочетании с инотропными средст-
вами при комбинации сердечной и
сосудистой недостаточности.
В течение последнего десятиле-
тия существенно изменилась такти-
ка назначения симпатомиметиков
при интенсивной терапии. Это по-
ложение иллюстрирует табл. 3.4.
Проведенный нами сравнительный
анализ частоты использования раз-
личных симпатомиметиков в 1992 и
2001 гг. показал, что сейчас значи-
тельно сократилась частота исполь-
зования монотерапии допамином и
добутамином. Чаще всего данные
препараты применяют в небольших
[до 5 мкг/(кг-мин)] или средних
[5—10 мкг/(кг-мин)] дозах. Наблю-
давшееся 10 лет назад применение
этих препаратов в высоких дозах
[10—20 мкг/кг-мин)] встречается
крайне редко. В частности, высокие
дозы допамина используют в 4 раза
реже, а у 90 % пациентов применя-
ют небольшие и средние дозы пре-
парата.
Таблица 3.4. Частота использования
различных доз допамина (в процен-
тах) в раннем периоде после операций
на сердце и магистральных сосудах

Аналогичная тенденция верна и
для добутамина (табл. 3.5). Помимо
того что данный препарат стал ли-
дировать по частоте применения,
высокие его дозы применяют лишь
у 2 % больных, получающих симпа-
томиметики.
Таблица 3.5. Частота использования
различных доз добутамина (в процен-
тах) в раннем периоде после операций
на сердце и магистральных сосудах

Полученные данные объясняют-
ся более активным использованием
комбинации различных симпатоми-
метиков, позволяющей оптимизи-
ровать интенсивную терапию за
счет дифференцированного учета
присущих каждому из них эффек-
тов. Известно, например, что как у
допамина, так и у добутамина при
высоких дозах инфузии превалиру-
ет вазопрессорный альфа-эффект.
В связи с этим их целесообразно
применять в умеренных дозах,
обеспечивая вазопрессорный эф-
фект за счет параллельной инфузии
норадреналина.
В последние годы в отделении
послеоперационной интенсивной
терапии кардиохирургического кор-
пуса РНЦХ РАМН наблюдается
следующая статистика: монотера-
пия добутамином осуществляется у
35 %, допамином — у 6 %, норадре-
налином — у 15 %, адреналином —
у 8 % пациентов. У остальных боль-
ных применяют рационально подо-
бранную комбинацию различных
препаратов. Во всех случаях подбор
симпатомиметика при выраженной
недостаточности кровообраще-
ния — кропотливая работа, кото-
рую осуществляют под контролем
инвазивного мониторинга с учетом
индивидуальной реакции пациента
на вводимые препараты.
Сердечные гликозиды. Обладая
положительным инотропным и от-
рицательным хронотропным эф-
фектом, сердечные гликозиды не
увеличивают потребление миокар-
дом кислорода [Константинов Б.А.,
1981]. Обычно препараты этой
группы неэффективны при выра-
женной ОНК, в частности при кар-
диогенном шоке. Спорным остает-
ся также вопрос об их назначении в
острой стадии инфаркта миокарда.
Вместе с тем сердечные гликозиды
остаются препаратами выбора у бо-
льных с застойной сердечной недо-
статочностью.
Сердечные гликозиды назначают
больным с распространенным кар-
диосклерозом, пациентам, которым
выполняют коррекцию клапанных
пороков сердца или вентрикулото-
мию, при мерцательной аритмии с
целью урежения частоты пульса и
восстановления синусового ритма.
Противопоказаниями к назначе-
нию сердечных гликозидов являют-
ся атриовентрикулярная блокада
II—III степени, слабость синусово-
го узла, узловой ритм, синоаурику-
лярная блокада.
В нашей практике мы применяем
сердечные гликозиды у больных с
нарушениями проводимости сердца
на фоне проведения ЭКС через
миокардиальные электроды. Чаще
применяют внутривенную форму
дигоксина, поскольку он выводится
почками и является таким образом
более управляемым препаратом.
Его средние суточные дозы состав-
ляют 0,12—0,4 мг/м2.
Инфузионно-трансфузионная те-
рапия. Принципы инфузионно-
трансфузионной терапии. Жидкост-
ные пространства организма. Об-
щее содержание воды в организме
составляет около 60 %, при этом
она распределяется в различных
жидкостных пространствах. Во
внутриклеточном пространстве на-
ходится 2/3воды и во внеклеточ-
ном - 1/3[Lewis R.T., 1980].
Внеклеточное пространство со-
стоит из интерстициального и внут-
рисосудистого секторов. Обычно
75 % внеклеточной жидкости нахо-
дится в интерстиции и 25 % — в со-
судистом русле. Имеются значите-
льные различия в электролитном
составе внутриклеточного и внекле-
точного жидкостного пространства.
В клетках преобладает содержание
ионов калия, а во внеклеточном
пространстве — ионов натрия и
хлора. Для поддержания электро-
литного градиента необходимо
функционирование натрий-калие-
вого насоса.
В норме мембрана клетки обла-
дает относительной проницаемо-
стью для ионов электролитов, но
она свободно проницаема для
воды. Например, снижение кон-
центрации натрия и осмолярности
во внеклеточном пространстве по-
сле инфузии 5 % раствора глюко-
зы сопровождается перемещением
воды в клетку, что может привести
к уравниванию осмотического дав-
ления в этих жидкостных секторах.
И наоборот, увеличение концент-
рации натрия и осмолярности во
внеклеточном пространстве, на-
пример в результате инфузии ги-
пертонического раствора на-
трия, сопровождается перемещени-
ем воды из внутриклеточного во
внеклеточное пространство. Инфу-
зия изотонических растворов элек-
тролитов не изменяет осмолярно-
сти внеклеточного пространства и
тем самым не приводит к переме-
щению воды.
Перемещение воды между двумя
компонентами внесосудистого про-
странства определяется прежде все-
го разностью концентрации белка.
Коллоидно-осмотическое давление
является основным фактором, бла-
годаря которому эндотелий непро-
ницаем для белков плазмы. При на-
рушениях белкового обмена в резу-
льтате осмотического дисбаланса
вода переходит из интерстициаль-
ного пространства в кровяное рус-
ло. Молекулы кристаллоидов не со-
здают градиента давления, посколь-
ку они свободно проходят через
мембрану капилляра. В норме 60 %
КОД обеспечивается за счет раз-
личных белков (из них 75 % — за
счет альбумина, остальное — за
счет глобулинов и фибриногена).
40 % КОД поддерживается за счет
концентрации катионов. У пациен-
тов отделения интенсивной тера-
пии нормальный КОД составляет
от 18 до 20 мм рт.ст. [Rackow E.C.
et al, 1977].
Показания к инфузионно-транс-
фузионной терапии:
• абсолютный дефицит объема
циркулирующей крови (абсолютная
гиповолемия при кровотечении,
недовосполненной кровопотере во
время и после операции; потеря
жидкости и электролитов при по-
лиурии и через желудочно-кишеч-
ный тракт, гипертермии);
• относительная гиповолемия
(вазодилатация, анафилактический
и септический шок, феномен депо-
нирования крови и жидкости);
• сердечная недостаточность в
комплексной терапии при необхо-
димости увеличения насосной фун-
кции сердца через механизм Фран-
ка—Старлинга;
• парентеральное питание;
• коррекция кислотно-щелочного
и электролитного баланса, регуля-
ция онкотического давления крови.
Препараты крови. Цельная донор-
ская кровь, эритроцитная масса. От-
рицательные последствия трансфу-
зии донорской крови хорошо изве-
стны [Константинов Б.А. и др.,
2000], поэтому показания к ее ис-
пользованию в хирургии стараются
максимально сузить.
Большинство авторов сходятся во
мнении, что у больных, перенес-
ших операцию на сосудах, оптима-
льный гематокрит составляет 30—
35 %. По нашему мнению, этот по-
казатель следует определять инди-
видуально с учетом величины арте-
риального транспорта кислорода и
основной его детерминанты — сер-
дечного индекса. Согласно прове-
денным исследованиям, у опериро-
ванных больных снижение гемо-
глобина на 1 г% должно сопро-
вождаться возрастанием СИ на
400 мл/(мин • м2]). В противном
случае наблюдаются признаки неа-
декватной тканевой оксигенации,
что требует трансфузии эритроцит-
ной массы или инотропной поддер-
жки с последующей гемотрансфу-
зией, которая не может быть вы-
полнена в срочном порядке. Таким
образом, показания к переливанию
цельной крови или эритроцитной
массы определяют индивидуально.
У большинства больных гемотранс-
фузия показана при снижении Ht <
< 30 %. У больных с низким кар-
диореспираторным резервом опти-
мальный гематокрит определяют с
учетом артериального транспорта
кислорода и состояния тканевой
оксигенации.
При интенсивной терапии у опе-
рированных больных широко испо-
льзуют кровесберегающие техноло-
гии. Для этого производят предопе-
рационную заготовку аутокрови и
аутоплазмы в предоперационном
периоде, забор и аутотрансфузию
крови во время операции и в ран-
нем послеоперационном периоде.
При операциях, протекающих с
планируемой массивной кровопоте-
рей, применяют селл-сейвер (cell-
saver) — сепаратор клеток кро-
ви, предназначенный для сбора и
трансфузии аутоэритроцитов. Ап-
парат транспортируют вместе с па-
циентом в отделение интенсивной
терапии и используют при про-
должающейся послеоперационной
кровопотере. У больных, опериро-
ванных в условиях ИК, дренажи
присоединяют к кардиотомному ре-
зервуару. При значительной крово-
потере в течение первых 8 ч со-
бранную в нем кровь после отмыва-
ния жидкой части используют для
гемотрансфузии. Поскольку при
кровотечении происходят травми-
рование и разрушение части эрит-
роцитов, трансфузия цельной кро-
ви, излившейся по дренажам, мо-
жет сопровождаться массивным
внутрисосудистым гемолизом.
Нашивная донорская плазма —
продукт обработки крови, поэтому
она содержит в готовом виде мно-
гие ценные вещества, однако ей
присущи и отрицательные свойства
крови: цитратная токсичность, аци-
доз, гиперкалиемия и др. При ин-
фузии нативной плазмы крови име-
ется риск таких осложнений, как
заражение вирусным гепатитом,
ВИЧ-инфекция; высока также ве-
роятность анафилактических реак-
ций. Наличие в ней чужеродных
лейкоцитов, когда не используются
лейкоцитарные фильтры, может
вызвать реакцию системного воспа-
лительного ответа, особенно при
введении больших объемов, поэто-
му ее использование у больных с
небольшой кровопотерей следует
ограничить, заменив растворами
кристаллоидных и синтетических
коллоидных растворов. Примене-
ние нативной плазмы оправдано
при острой гипо- и диспротеине-
мии и отсутствии синтетических
коллоидных растворов и растворов
альбумина.
Свежезамороженная плазма в от-
личие от нативной содержит факто-
ры свертывания: весь комплекс ста-
бильных факторов гемостаза, фиб-
ринолиза, системы комплемента
и пропердина, разномолекулярные
белковые комплексы, обеспечиваю-
щие онкотическое давление, анти-
тела, а также иммунологическую
составляющую крови. В этой связи
среди компонентов крови по объ-
ему применения в клинике этот
препарат занимает первое место
[Константинов Б.А. и др., 2000].
Показаниями к применению свеже-
замороженной плазмы являются
подготовка больных с дефицитом
факторов свертывания, острый
ДВС-синдром, послеоперационные
кровотечения, связанные с дефици-
том факторов свертывания.
Криопреципитат — концентриро-
ванная смесь плазменных факторов
свертывания крови, полученная из
свежезамороженной плазмы.
Основными показаниями к исполь-
зованию криопреципитата являют-
ся дефицит факторов свертывания
и послеоперационные кровотече-
ния.
Кристаллоидные растворы. Наи-
более часто в практике интенсив-
ной терапии используют изотони-
ческие растворы хлорида натрия и
лактата Рингера. Их способность к
увеличению ОЦК идентична. Они
легко проходят через сосудистую
мембрану и равномерно распреде-
ляются во внеклеточном простран-
стве. Исследования, проведенные у
пациентов, находящихся в критиче-
ском состоянии, показали, что че-
рез 1—2 ч после инфузии в сосуди-
стом русле остается менее 20 % вве-
денного объема кристаллоидов
[Lamke L.O. et al., 1976].
Несмотря на то что оба раствора
имеют низкий рН, для нейтрализа-
ции ацидоза обычно требуется вве-
дение небольших объемов щелоч-
ных растворов. Лактат натрия, со-
держащийся в растворе лактата
Рингера, не является кислотой, и
он метаболизируется в печени, пре-
вращаясь в бикарбонат, который
оказывает умеренный ощелачиваю-
щий эффект.
Растворы кристаллоидов неток-
сичны, их введение не приводит к
анафилактоидным реакциям. При
восполнении значительного дефи-
цита О ЦК только растворами крис-
таллоидов, когда вводят большие их
объемы, неизбежно возникновение
интерстициального отека, прежде
всего отека легких. Кроме того, не-
обходимо учитывать, что для вос-
полнения дефицита ОЦК раствора-
ми кристаллоидов объем инфузии
должен в 3—4 раза превышать объ-
ем кровопотери, поскольку они
равномерно распределяются во всех
жидкостных пространствах орга-
низма.
Гипертонический раствор хлорида
натрия. В результате инфузии ги-
пертонического раствора NaCl при-
рост объема внеклеточного про-
странства существенно превышает
объем введенного раствора, что
обусловлено перемещением воды
из внутриклеточного пространства.
Положительный гемодинамический
эффект гипертонического раствора
натрия объясняется не только уве-
личением ОЦК. Есть данные о том,
что он обладает положительным
инотропным эффектом и снижает
ОПСС и сопротивление легочных
сосудов за счет расширения прека-
пилляров [Wildenthal К. et al., 1969].
Его положительный терапевтиче-
ский эффект объясняют также по-
вышением венозного тонуса, кото-
рое обусловлено вагусным рефлек-
сом, запускаемым при попадании
гипертонического раствора в сосу-
ды малого круга кровообращения
[Gazitua et al., 1971]. Следует, одна-
ко, учитывать, что введение гипер-
тонического раствора натрия может
приводить к гиперосмолярности,
гипернатриемии, гиперхлоремиче-
скому ацидозу и гипокалиемии. В
результате дегидратации головного
мозга могут возникать такие клини-
ческие симптомы, как дезориента-
ция, оглушенность, судороги. У бо-
льных с низкими резервами произ-
водительности сердца может разви-
ться отек легких. В связи с этим не-
контролируемое введение гиперто-
нического раствора натрия хлорида
недопустимо. Данный препарат
можно вводить, пока сывороточная
концентрация натрия не превышает
150 ммоль/л, а осмолярность сыво-
ротки крови — 350 мосмоль/л.
Коллоидные растворы. Альбумин
является основным белком, кото-
рый образуется в печени и состав-
ляет около 50 % ее синтетической
функции. Альбумин занимает поч-
ти 50 % от общего состава белков
плазмы и обеспечивает от 2/3 до 2/4
КОД плазмы.
Увеличение КОД и объема цир-
кулирующей крови в результате ин-
фузии раствора альбумина зависит
от его концентрации. Выпускают
2,5 %, 5 %, 10 %, 20 % и 25 % рас-
творы альбумина. В 1 л 5 % раство-
ра содержится 50 г альбумина, что
создает КОД, составляющий 20 мм
рт.ст. Выпускается также 25 % рас-
твор, содержащий 12,5 г альбумина
в 50 мл раствора, что создает КОД,
составляющий около 100 мм рт.ст.
Инфузия альбумина приводит к эф-
фективному восполнению дефици-
та ОЦК и стабилизации гемодина-
мики. Инфузия 500 мл 5 % раствора
альбумина увеличивает ОЦК на
450—600 мл [Lamke L.O. et al.,
1976]. При нормальной капилляр-
ной проницаемости через 2 ч в со-
судистом русле остается 90 % вве-
денного раствора альбумина. При
острой гиповолемии предпочтение
отдают 5 % раствору альбумина, а
25 % раствор обычно используют у
больных с сочетанием гиповолемии
и повышенного объема внеклеточ-
ной жидкости.
Длительность гемодинамического
эффекта, обусловленного инфузией
раствора альбумина, различна при
разных патологических состояниях.
В некоторых случаях наблюдаются
значительный переход альбумина в
интерстициальный сектор и его на-
копление в коже или интерстициа-
льном пространстве легких.
Частота анафилактических реак-
ций, связанных с инфузией альбу-
мина, составляет примерно 0,11 %
[Ring J. et al., 1977]. Риск зараже-
ния гепатитом отсутствует, поско-
льку во время приготовления рас-
твора его держат при температуре
60 °С в течение 10 ч. Отсутствует
также риск передачи ВИЧ-инфек-
ции. Есть указания на то, что при
введении больших объемов раство-
ров альбумина может понижаться
сывороточная концентрация иони-
зированного кальция, что приводит
к отрицательному инотропному эф-
фекту.
Альбумин обладает некоторыми
уникальными эффектами, отличаю-
щими его от синтетических коллои-
дов и кристаллоидов: способностью
регулировать содержание во вне-
клеточном пространстве различных
веществ, таких как железо и били-
рубин, блокировать свободные ра-
дикалы, что сопровождается подав-
лением перекисного окисления
липидов, связывать различные
токсичные вещества, образующиеся
при воспалительном процессе, вли-
ять на проницаемость микрососу-
дов для молекул других белков.
Восполнение уровня альбумина со-
провождается нормализацией про-
ницаемости эндотелия. Благода-
ря вышеперечисленным свойствам
альбумина многие врачи отдают
ему предпочтение перед другими
плазмозамещающими растворами.
Существенным фактором, ограни-
чивающим широкое применение
растворов альбумина, является их
высокая стоимость.
Декстраны представляют собой
смесь полимеров глюкозы различ-
ной величины и молекулярной мас-
сы. Чаще всего в клинической
практике используют декстран-70
(макродекс, полиглюкин) и декст-
ран-40 (реомакродекс или реопо-
лиглюкин).
Инфузия декстрана приводит к
увеличению объема плазмы. Длите-
льность и степень этого увеличения
определяются общим объемом ин-
фузии, скоростью инфузии, моле-
кулярной массой и клиренсом пре-
парата из плазмы. Мелкие молеку-
лы декстрана очень быстро филь-
труются почками, приводя к уме-
ренному диуретическому эффекту,
или проходят через эндотелий в ин-
терстициальное пространство, от-
куда в последующем возвращаются
в кровоток по лимфатическим пу-
тям. Крупные молекулы декстрана
недолго хранятся в гепатоцитах,
клетках почечных канальцев и
ретикулоэндотелиальной системы.
Они не обладают токсическим эф-
фектом и постепенно метаболизи-
руются в углекислоту и воду.
Инфузия декстрана-70 сопровож-
дается более продолжительным эф-
фектом, чем декстана-40. Через 3 ч
в плазме остается 70 % введенного
декстрана-70, а через 24 ч — 30 %
[Thompson W.L. et al., 1975]. После
введения 1 л декстрана-70 больным
в раннем послеоперационном пери-
оде в среднем объем плазмы увели-
чивается на 790 мл. Это сравнимо с
эффектом от введения аналогично-
го объема 6 % гидроксиэтилкрахма-
ла и больше, прироста ОЦК в резу-
льтате введения аналогичного объе-
ма 5 % альбумина.
У декстрана-40 онкотическое
давление выше, чем у 6 % декстра-
на-70, однако вследствие его очень
быстрого выведения почками уве-
личение объема плазмы непродол-
жительно. У пациентов с нормаль-
ной функцией почек уже через 6 ч
60 % декстрана-40 выводится с мо-
чой [Arturson G. et al., 1964]. У па-
циентов, находящихся в критиче-
ских состояниях, помимо увеличе-
ния объема плазмы, наблюдается
улучшение микроциркуляции. Оба
препарата снижают вязкость крови
и, таким образом, за счет улучше-
ния периферического кровотока
приводят к улучшению тканевой
оксигенации. У пациентов с нару-
шенной микроциркуляцией и рео-
логией крови эти эффекты декстра-
на-40 имеют большое значение и
используются для профилактики
тромботических осложнений в ран-
нем послеоперационном периоде.
Значительный объем декстрана-
40 фильтруется в почках и поступа-
ет в почечные канальцы. Это суще-
ственно повышает вязкость мочи.
В связи с тем что канальцевая реаб-
сорбция воды при этом не прекра-
щается, декстран может приводить
к необратимой закупорке почечных
канальцев и острой почечной недо-
статочности [Mailloux L. et al.,
1967]. Вероятность повреждения
почек повышается при нарушении
их функции или обезвоживании ор-
ганизма, поэтому следует избегать
введения декстрана-40 больным с
почечной недостаточностью.
Декстран-70 реже вызывает раз-
витие острой почечной недостаточ-
ности, возможно, потому, что зна-
чительно меньшая часть его моле-
кул фильтруется гломерулами почек
[Feest T.G. et al., 1976].
Частота анафилактоидных реак-
ций на декстраны составляет около
0,032 % [Ring J. et al., 1977]. Тяже-
лые реакции возникают приблизи-
тельно в 0,008 % случаев; обычно
они развиваются в течение 5 мин
после начала инфузии декстрана.
К побочным эффектам декстра-
нов относят также снижение факто-
ров свертывания за счет гемодилю-
ции, покрытия внутренней стенки
сосудов и клеточных элементов, а
также нарушения образования фиб-
ринового сгустка. Декстран-40 при-
водит к нарушениям свертывающей
системы крови в большей степени,
чем декстран-70. В целях снижения
риска кровотечений объем инфузи-
руемого декстрана должен быть
ограничен до 20 или 1,5 г/(кг • сут)
[Alik M. et al., 1967]. Нельзя забы-
вать, что геморрагические осложне-
ния могут возникать у пациентов с
предрасположенностью к ним, на-
пример с тромбоцитопенией. Паци-
ентами высокого риска считают бо-
льных с почечной недостаточно-
стью, поскольку у них возможны
сочетание уремической дисфунк-
ции тромбоцитов и значительное
увеличение периода полувыведения
декстрана.
Растворы гидроксиэтилкрахмала.
В клинической практике использу-
ют 6 % и 10 % растворы гидрокси-
этилкрахмала (ГЭК) в изотониче-
ском растворе натрия хлорида.
Наиболее часто применяют следую-
щие формы растворов ГЭК: гемохес
(B.Braun), HAES-стерил, плазма
стерил (Фрезениус), инфукол (Зе-
рум-Верк) и др. Фармакокинетика
их сложна вследствие неоднородно-
сти молекулярной массы и различ-
ной степени гидроксиэтилирования
вещества, содержащегося в рас-
творе. Молекулы с мол.м. менее
50 000 Да очень быстро экскретиру-
ются почками и распределяются в
различных тканях организма. Мо-
лекулы с большей массой могут
также попадать в различные ткани
организма, а также захватываться
клетками ретикулоэндотелиальной
системы или разрушаться амилазой
крови с последующим выведением
с мочой или желчью. У нормальных
индивидуумов 46 % из 500 мл вве-
денного 6 % раствора ГЭК выво-
дится с мочой в течение 2 сут, а
остальные 54 % — в течение 6 сут
[Yacobi A. et al., 1982]. Ткани с от-
носительно высокой активностью
макрофагов, например печень и се-
лезенка, захватывают небольшое
количество гидроксиэтилкрахмала
и задерживают его на довольно
длительный период времени. Нали-
чие молекул ГЭК в клетках ретику-
лоэндотелиальной системы не угне-
тает их функцию [Shatney C.H.,
1984]. Несмотря на то что его моле-
кулы попадают также в клетки эпи-
телия почечных канальцев, появля-
ющиеся морфологические измене-
ния не сопровождаются функцио-
нальными нарушениями [Shat-
ney С.Н. et al., 1984].
ГЭК является очень эффектив-
ным плазмозамещающим препара-
том. Прирост объема плазмы зна-
чительно больше объема инфузиру-
емого раствора. Через 24 ч после
введения 1000 мл препарата объем
плазмы в среднем превышает ис-
ходный на 285 мл, причем эф-
фективность гидроксиэтилкрахмала
сравнима с альбумином или даже
выше, что объясняется более высо-
ким КОД 6 % раствора ГЭК.
Объем вводимого раствора ГЭК
обычно подбирают индивидуально.
Обычно для ликвидации гиповоле-
мии достаточно введения 500—1000
мл, однако у больных с продолжаю-
щимся кровотечением или септиче-
ским шоком для стабилизации ге-
модинамики могут потребоваться
значительно большие объемы. Не-
смотря на высокие вводимые объ-
емы, препарат не оказывает отри-
цательного влияния на функцию
почек, печени или легких. Изуче-
ние влияния раствора ГЭК на свер-
тывающую систему крови в услови-
ях клиники свидетельствует об от-
сутствии значительных коагулоло-
гических изменений, а имеющиеся
сдвиги в состоянии свертывающей
системы крови объясняются эф-
фектом гемодилюции. Несмотря на
это, не рекомендуется превышать
дозу 20 мл/(кг • сут). Частота ана-
филактоидных реакций на ГЭК не-
высока. Сообщается о 14 реакциях
на 16 405 инфузий, что составляет
0,085 % [Ring J. et al., 1977].
После введения ГЭК нередко по-
вышается уровень сывороточной
амилазы. Гиперамилаземия может
привести к ошибочной постановке
диагноза панкреатита. Вместе с тем
данных об отрицательном влиянии
препарата на поджелудочную желе-
зу нет. При подозрении на наличие
панкреатита у больных, получав-
ших гидроксиэтилкрахмал, реко-
мендуют ориентироваться на сыво-
роточную концентрацию липазы
или динамику уровня амилазы
[Mishler J.M. et al., 1977].
Препараты желатина. В послед-
ние годы разработаны новые препа-
раты из желатина; одной из раз-
новидностей модифицированного
жидкого желатина является гелофу-
зин (B-Braun). Отечественный ана-
лог — модежель.
Гелофузин — 4 % раствор жела-
тина (модифицированный жидкий
желатин) в растворе хлорида на-
трия. Желатин получают из колла-
геновой ткани (хрящей) крупного
рогатого скота методом термиче-
ской деградации, гидролиза и сук-
цинирования. Это плазмозамещаю-
щий раствор с периодом полувыве-
дения около 9 ч, имеющий сред-
нюю мол.м. около 30 000 Да, колло-
идно-осмотическое давление (КОД)
453 мм вод.ст., или 33,3 мм рт.ст., и
осмолярность 274 мосм/л.
В проспективном рандомизиро-
ванном исследовании [Beards S.C.
et al., 1994] сравнивали инфузию
500 мл гелофузина и гидроксиэтил-
крахмала Hespan, которые вводили
в течение 10 мин пациентам с гипо-
волемическим шоком. Положитель-
ный гемодинамический эффект, за-
ключавшийся в возрастании произ-
водительности сердца и артериаль-
ного транспорта кислорода при не-
котором снижении концентрации
гемоглобина, отмечен в обеих груп-
пах. Авторами не получено стати-
стически достоверных различий
между гемодинамическими реакци-
ями на введение сравниваемых пре-
паратов.
Согласно данным Марютина и
соавт. (1997), у пациентов с продол-
жающейся кровопотерей, получав-
ших гелофузин, полиглюкин или
гидроксиэтилкрахмал, наибольший
волемический эффект наблюдался
при использовании гидроксиэтил-
крахмала, однако при анализе по-
казателей гемостаза и количества
геморрагических рецидивов выяв-
лено несомненное преимущество
гелофузина. Раствор модифициро-
ванного жидкого желатина не влия-
ет на свертывающую систему кро-
ви, даже если объем инфузий пре-
вышает 4 л за 24 ч [Edwards J.D. et
al., 1987]. Есть указания на особые
его преимущества при исходной ги-
покоагуляции и/или тромбоцитопе-
нии, а также в ситуациях с высоким
риском развития ДВС-синдрома
[Марютин и др., 1998]. Считается,
что гелофузин при инфузионной
терапии гиповолемических состоя-
ний различного генеза у больных
хирургического профиля оказывает
стойкий волемический и гемодина-
мический эффект, устраняет мик-
роциркуляторные нарушения и
улучшает газотранспортную функ-
цию крови [Beards S.C. et al., 1994].
Особого внимания заслуживает
преимущество препаратов желати-
на по сравнению с другими синте-
тическими коллоидами у больных с
почечной недостаточностью. В ра-
боте H.Kohler (1979) показано, что
при снижении уровня клубочковой
фильтрации с 90 до 0,5 мл/мин пе-
риод полувыведения препаратов
желатина увеличивается менее чем
в 2 раза, гидроксиэтилкрахмала —
в 2,5 раза, а декстрана-40 — в
7,5 раза. Более того, имеются ука-
зания на то, что у больных с ану-
рией усиление элиминации ГЭК в
печени может приводить к разви-
тию портальной гипертензии и ас-
цита.
Поскольку концентрация натрия
в растворе гелофузина составляет
154 ммоль/л, нельзя забывать о воз-
можности избыточного накопления
этого электролита в организме па-
циентов с почечной недостаточно-
стью.
Частота анафилактических реак-
ций на препараты модифицирован-
ного жидкого желатина составляет
от 1 на 6000 до 1 на 13 000 случаев.
Такие реакции являются результа-
том выброса большого количества
вазоактивных субстанций и чаще
наблюдаются у лиц, предрасполо-
женных к аллергии [Ring J. et al.,
1977].
Имеются публикации о возмож-
ном негативном влиянии раство-
ров, в основе которых лежит жела-
тин, на систему иммунитета [Sale-
usky, 1995; Brodin В., 1984].
В настоящее время практически
все исследователи сходятся во мне-
нии, что идеального плазмозамени-
теля не существует. В связи с этим
при их назначении учитывают ин-
дивидуальные особенности пациен-
та, специфику проводимых тера-
певтических процедур и свойства,
присущие каждому из плазмозаме-
нителей.
Основные принципы инфузион-
но-трансфузионной тактики заклю-
чаются в сокращении перелива-
ния продуктов донорской крови,
при применении кровосберегаю-
щих технологий, комбинированном
назначении коллоидных и кристал-
лоидных препаратов.
Послеоперационное кровотечение.
Оценка кровопотери по дренажам
не всегда позволяет полностью
контролировать ее объем. Часть
крови может задерживаться в поло-
стях организма, а проходимость
дренажей — нарушаться в результа-
те образования в них сгустков кро-
ви, сдавления или перегиба. В свя-
зи с этим у больных, оперирован-
ных на органах грудной клетки, в
первые часы послеоперационного
периода контролируют показатели
гематокрита и свертывающей сис-
темы крови, показатели гемодина-
мики и газового состава артериаль-
ной крови. Обязательно выполняют
рентгенографию органов грудной
клетки, а при подозрении на скоп-
ление жидкости в области средосте-
ния и перикарда — трансторакаль-
ную эхокардиографию.
Значимой считается потеря по
дренажам более 70 мл/м2 геморра-
гической жидкости с гематокритом,
близким по значению к гематокри-
ту крови в течение 2—4 ч в отсутст-
вие выраженных нарушений свер-
тывающей системы крови или при
наличии признаков гиперкоагуля-
ции. Это является показанием к по-
вторному оперативному вмешатель-
ству с целью гемостаза.
При подозрении на внутреннее
кровотечение объем потери эритро-
цитной составляющей ОЦК можно
приблизительно определить по сте-
пени падения гематокрита крови:
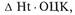
где Ht выражен в процентах, а ОЦК
вычисляют из расчета 70 мл/кг мас-
сы тела.
Данная формула дает приблизи-
тельный результат, поскольку не
учитывает объем эритроцитов, по-
ступающих из внутренних депо, а
также перемещения жидкости из
внесосудистых пространств орга-
низма. Кроме того, необходимо
учитывать объем введенных инфу-
зионно-трансфузионных препара-
тов. Таким образом, данную фор-
мулу можно использовать при усло-
вии адекватного восполнения ОЦК
под контролем данных, получаемых
при гемодинамическом мониторин-
ге.
Поскольку хирургическое крово-
течение обычно сопровождается
вторичными нарушениями гемоста-
за, в первые часы при наличии
признаков кровотечения проводят
консервативную гемостатическую
терапию:
• апротинин — 2000—6000 млн
ЕД;
• переливание криопреципитата
и свежезамороженной плазмы;
• переливание тромбоконцентра-
та в объеме 6—8 доз.
За исключением случаев профуз-
ного кровотечения, дифференциа-
льная диагностика между хирурги-
ческой причиной кровотечения и
нарушениями гемостаза нередко
представляет очень сложную зада-
чу. В этих случаях важно не допус-
тить потери больших объемов кро-
ви.
Следствием массивной кровопо-
тери и гемотрансфузии являются
ДВС-синдром, синдром системной
воспалительной реакции и СПОН
(см. соответствующие разделы).
Если кровотечение продолжается
после проведения консервативных
мероприятий, вопрос решают в по-
льзу повторного оперативного вме-
шательства.
Нарушения ритма и проводимости
сердца. Тахиаритмии могут приво-
дить к падению сердечного выброса
за счет уменьшения диастолическо-
го наполнения желудочков сердца и
снижения коронарного кровотока.
Синусовая тахикардия может
возникать в результате гиповоле-
мии, введения инотропных препа-
ратов, выброса катехоламинов в
кровь вследствие хирургического
стресса, реакции на боль и эмоцио-
нальных реакций пациента. Причи-
ной тахикардии может являться
также гипертермия. Лечение сину-
совой тахикардии начинают с
устранения вызвавшей ее причины.
Желудочковая экстрасистолия
встречается у 17—50 % больных,
перенесших операции реваскуляри-
зации миокарда. Причинами дан-
ной аритмии являются хирургиче-
ская травма, электролитный дисба-
ланс (прежде всего гипокалиемия и
гипомагниемия), изменения рН и
РаО2, введение катехоламинов, раз-
дражающее действие термодилюци-
онного катетера или дренажей в по-
лости средостения. После исключе-
ния экстракардиальных причин
упорную желудочковую экстраси-
столию купируют введением лидо-
каина или амиодарона, а при воз-
можности перорального пути введе-
ния применяют соталол. Появление
желудочковой тахикардии или фиб-
рилляции желудочков служит пока-
занием к срочной дефибрилляции.
У пациентов, оперированных на
сосудах сердца и торакоабдомина-
льном отделе аорты, частота воз-
никновения суправентрикулярной
тахикардии (предсердная пароксиз-
мальная тахикардия, мерцание и
трепетание предсердий) достигает
20-35 % [Hudak CM. et al., 1998].
Причинами этого являются нару-
шения электролитного баланса,
ишемия предсердия во время пере-
жатия аорты, образование воспали-
тельного инфильтрата в области
проводящих путей сердца. При вы-
сокой ЧСС выполняют электроим-
пульсную терапию, а при наличии
противопоказаний применяют ан-
тиаритмическую медикаментозную
терапию. В целях снижения ЧСС
назначают верапамил или бета-бло-
каторы, а для восстановления сину-
сового ритма — амиодарон, бре-
ви-блок, хинидин. У пациентов с
признаками сердечной недостаточ-
ности используют сердечные глико-
зиды. Трепетание предсердий, как
правило, не поддается медикамен-
тозной терапии, в связи с чем при
данном виде нарушения ритма при-
меняют электроимпульсное лече-
ние.
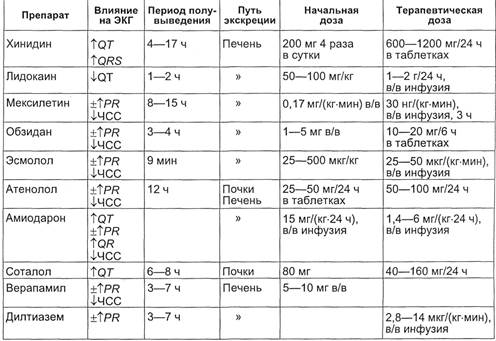
Основные эффекты и доза анти-
аритмических препаратов представ-
лены в табл. 3.6.
Брадиаритмии (синусовая или
узловая брадикардия, атриовентри-
кулярная блокада II—III степени)
возникают в результате угнетения
клеток проводящей системы серд-
ца в результате кардиоплегии, инт-
раоперационной травмы и отека,
периоперационного инфаркта мио-
карда. В целях улучшения прово-
димости сердца назначают минера-
локортикоидные гормоны (целе-
стон, дексаметазон), нестероидные
противовоспалительные средства
(диклофенак), инфузию изопроте-
ренола или астмапента. При воз-
никновении атриовентрикулярной
блокады II—III степени или бради-
аритмии, сопровождающейся паде-
нием сердечного выброса, прово-
дят временную электрокардиости-
муляцию.
Электроимпульсная терапия и
электрокардиостимуляция. У боль-
ных, оперированных на сердце
(операции аортокоронарного шун-
тирования, сочетание АКШ с про-
тезированием клапанов сердца,
операции на восходящей аорте в
сочетании с протезированием или
|
Таблица 3.6. Сравнительная характеристика антиаритмических препаратов
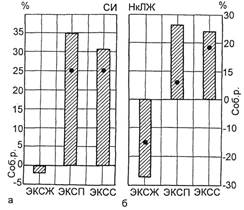
Рис. 3.31. Изменение СИ (а) и НкЛЖ
(б) при применении различных видов
учащающей ЭКС по сравнению с соб-
ственным ритмом (узловая и синусовая
брадикардии) (р<0,005).
Соб.р. — собственный ритм пациента;
ЭКСЖ — желудочковая экстрасистолия;
ЭКСП — предсердная экстрасистолия;
ЭКСС — секвенциальная экстрасистолия;
НкЛЖ — насосный коэффициент левого
желудочка сердца.
пластикой аортального клапана или
имплантация клапансодержащего
кондуита и др.), во время операции
к миокарду правого желудочка под-

Рис. 3.32. Изменение СИ (а) и НкЛЖ
(б) при применении различных видов
учащающей ЭКС по сравнению с соб-
ственным ритмом (ППБ) (р<0,005).
Условные обозначения те же, что на рис.
3.31.
шивают электроды для проведе-
ния электрокардиостимуляции. Мы
считаем целесообразным подшива-
ние электродов также и к миокарду
правого предсердия. Если при воз-
никновении брадиаритмий миокар-
диальные электроды отсутствуют,
экстренно устанавливают эндокар-
диальный электрод. Для проведе-
ния ЭКС необходим двухкамерный
электрокардиостимулятор. При со-
хранной атриовентрикулярной про-
водимости целесообразно прово-
дить предсердную ЭКС. В против-
ном случае применяют секвенциа-
льную (предсердно-желудочковую
ЭКС) с подбором оптимального
времени задержки между стимуля-
цией предсердия и желудочка. При
невозможности применения выше-
указанных режимов используют же-
лудочковую ЭКС. На рис. 3.31 по-
казаны гемодинамические эффекты
перечисленных выше методов элек-
трической стимуляции при узловой
и синусовой брадикардии. Пред-
сердная и секвенциальная ЭКС
приводят к приблизительно одина-
ковому возрастанию сердечного ин-
декса. Вместе с тем предсердная
ЭКС более физиологична, поэтому
прирост СИ при ней происходит на
фоне более благоприятного соотно-
шения между ударной работой и
давлением наполнения левого же-
лудочка сердца, что отражает пока-
затель насосного коэффициента
желудочка. При желудочковой
ЭКС, проводимой на фоне узловой
брадикардии, производительность
сердца снижалась.
На рис. 3.32 показано сравнение
желудочковой и секвенциальной
ЭКС при полной поперечной бло-
каде сердца. Желудочковая стиму-
ляция приводит к возрастанию СИ
в среднем на 12 %, в то время как
секвенциальная — на 25 %. Таким
образом, показания к желудочко-
вой ЭКС можно ограничить полной
поперечной блокадой сердца или
невозможностью проведения более
эффективных методов ЭКС.
Тахиаритмии, возникающие в
раннем послеоперационном перио-
де, могут приводить к падению
производительности сердца за счет
не только сокращения длительно-
сти диастолы, но и увеличения по-
требности миокарда в кислороде и
нарушения функции искусственных
клапанов сердца. Выбор между
электроимульсной терапией и ме-
дикаментозным лечением зависит
от вида тахиаритмии и общего со-
стояния пациента. Следует учиты-
вать, что большинство антиаритми-
ческих препаратов обладает отрица-
тельным инотропным эффектом,
поэтому у больных с сердечной не-
достаточностью в первые часы по-
слеоперационного периода пред-
почтительно использовать электро-
импульсные методы лечения, осо-
бенно если они находятся на про-
дленной ИВЛ.
Пароксизмальная желудочковая
тахикардия является абсолютным
показанием к выполнению кардио-
версии у данной категории пациен-
тов. Пароксизм тахиформы мерца-
ния или трепетания предсердий мо-
жет быть купирован сверхчастой
стимуляцией предсердий (с часто-
той импульса 400—800 в 1 мин), а
при неэффективности — с помо-
щью кардиоверсии. Есть сообще-
ния о положительном эффекте пар-
ной урежающей стимуляции желу-
дочков сердца при тахиаритмиях,
рефракторных к другим методам
лечения. Вместе с тем вопрос о вы-
боре между медикаментозными и
электроимпульсными методами ку-
пирования тахиаритмии до сих пор
остается дискутабельным и решает-
ся индивидуально для каждого бо-
льного.
3.10.3.3. Артериальная гипертензия
Артериальная гипертензия (АГ) —
одно из серьезных осложнений,
ухудшающих течение раннего по-
слеоперационного периода у боль-
ных, перенесших вмешательства на
сосудах. Она встречается в 30—60 %
случаев и может привести к таким
осложнениям, как нарушение гер-
метичности хирургического шва,
повышению кровоточивости тка-
ней, цереброваскулярным геморра-
гиям, ишемии миокарда [Mul-
len J.S. et al., 1988; Bertolissi M. et
al., 1998].
Причинами развития послеопе-
рационной артериальной гипертен-
зии являются:
• гипертоническая болезнь в ана-
мнезе;
• неадекватная аналгезия и седа-
ция;
• гиповолемия с явлениями цент-
рализации кровообращения;
• гипотермия;
• нейроэндокринные сдвиги во
время и после операции, прежде
всего активация симпатико-адрена-
ловой и ренин-ангиотензиновой
систем.
Учитывая особенности раннего
послеоперационного периода, мож-
но сформулировать следующие тре-
бования к гипотензивным препара-
там, применяемым в интенсивной
терапии:
• управляемость;
• высокая эффективность при
любых типах АГ;
• низкая частота возникновения
побочных эффектов;
• возможность регуляции АД при
монотерапии.
Вышеперечисленным требовани-
ям удовлетворяют инфузионные
формы антигипертензивных препа-
ратов. Применяют следующие пре-
параты.
• Нитраты:
— нитропруссид натрия в дозе
0,5—10 мкг/(кг • мин);
— нитроглицерин в дозе 5—
100 мкг/мин.
• Бета-блокаторы:
— обзидан 1—5 мг внутривенно;
— бреви-блок — 80 мг внутри-
венно, поддерживающая инфузия
25—500 мкг/(кг • мин).
• Блокаторы кальциевых каналов:
— адалат 0,35 мкг/(кг-мин), под-
держивающая доза 0,9 мкг/(кгмин);
— исрадипин — 0,6 мкг/(кг-мин),
поддерживающая доза 0,11 мкг/
(кг-мин);
— дилтиазем — 2,8—14 мкг/
(кг-мин).
Необходимо учитывать возмож-
ные побочные эффекты антигипер-
тензивных препаратов. В частно-
сти, нитроглицерин снижает не то-
лько системное, но и диастоличе-
ское давление, приводит к рефлек-
торной тахикардии, может вызы-
вать увеличение фракции внутриле-
гочного шунтирования. Кроме того,
он обладает слабым гипотензивным
эффектом. Нитропруссид натрия
также может приводить к артериа-
льной гипоксемии, а в больших до-
зах оказывает токсический эффект,
поскольку метаболизируется с об-
разованием цианидов, что может
привести к тканевой гипоксии [Fla-
herty J.Т. et al., 1982]. Применение
обзидана ограничено недостаточ-
ной кардиоселективностью и боль-
шой продолжительностью дейст-
вия, что в условиях нестабильной
гемодинамики может приводить к
развитию сердечной недостаточно-
сти. Бета-блокаторы и блокаторы
кальциевых каналов противопока-
заны больным с нарушениями про-
водимости сердца и сами могут вы-
зывать эти нарушения.
Таким образом, антигипертензи-
онные препараты в раннем послео-
перационном периоде необходимо
применять после коррекции гипо-
волемии, ликвидации мышечной
дрожи и отсутствии соответствую-
щих противопоказаний. Выбор пре-
парата и его дозы осуществляют
индивидуально для каждой клини-
ческой ситуации.
3.10.3.4. Периоперационный
инфаркт миокарда
Острый инфаркт миокарда, развив-
шийся по времени в непосредст-
венной связи с оперативным вме-
шательством и явившийся ослож-
нением хирургического лечения,
получил название периоперацион-
ного (ПИМ). Наиболее часто ПИМ
встречается при операциях аорто-
коронарного шунтирования, поэто-
му данная проблема заслуживает
пристального внимания специали-
стов по интенсивной терапии.
По данным литературы [Kawashi-
ma et al., 2001; Holmvang L. et al.,
2002; Sadeghi N. et al., 2002], часто-
та развития ПИМ в последние годы
составляет от 0,9 до 6,2 % в зависи-
мости от категории оперированных
больных и опыта проведения опе-
раций аортокоронарного шунтиро-
вания.
У подавляющего большинства
больных инфаркт миокарда возни-
кает во время операции или в тече-
ние первых суток после ее оконча-
ния.
В патогенезе периоперационного
инфаркта миокарда ведущая роль
принадлежит тромбозу аортокоро-
нарных шунтов или реконструируе-
мой коронарной артерии (в 50—
80 % случаев). При операциях мам-
марокоронарного шунтирования
причиной инфаркта миокарда мо-
жет быть спазм внутренней грудной
артерии.
Развитию тромбоза в первую оче-
редь способствуют ошибки в техни-
ке наложения шунта (травма эндо-
телия, взятие вены с клапаном, не-
достаточная или избыточная длина
шунта, несоответствие диаметра
шунта и отверстия в аорте и др.).
Кроме того, тромбозу шунтов спо-
собствует низкий кровоток по ним
(менее 40 мл в 1 мин).
Патогенетически важными фак-
торами развития ПИМ у больных
без тромбоза аортокоронарного
шунта являются плохое состояние
дистального русла коронарных ар-
терий, неполная реваскуляризация
миокарда, наличие предоперацион-
ной нестабильной стенокардии, по-
ражение ствола левой коронарной
артерии [Sadeghi N. et al., 2002].
Специфической и редкой причиной
ПИМ у кардиохирургических боль-
ных является эмболия коронарных
артерий материальными частицами
или воздухом.
Диагностика периоперационного
инфаркта миокарда основывается
на анализе клиники, данных элект-
рокардиографии, исследовании сы-
вороточных ферментов и Эхо-кар-
диографии. Радионуклидным мето-
дам исследования отводится второ-
степенная роль.
Общепринятые клинические кри-
терии инфаркта миокарда (боль,
лейкоцитоз, лихорадка) неинформа-
тивны у больных во время операции
и по ее окончании. Первыми при-
знаками инфаркта миокарда у дан-
ной категории пациентов, как пра-
вило, являются острая недостаточ-
ность кровообращения, упорные на-
рушения ритма, внезапная останов-
ка кровообращения.
«Золотым стандартом» ЭКГ-диа-
гностики крупноочагового ПИМ
считают появление нового зубца Q
в одном или более отведениях про-
должительностью не менее 0,04 с,
который сохраняется на ЭКГ в те-
чение 24—48 ч в отсутствие нару-
шений проводимости.
При сопоставлении патологоана-
томических данных с клиническим
течением мы обнаружили, что лишь
у 72,5 % больных с крупноочаговым
инфарктом миокарда имелись ти-
пичные изменения на ЭКГ с новы-
ми зубцами Q. У 16,5 % пациентов
регистрировали только снижение
амплитуды зубца R в отведениях,
соответствующих локализации ин-
фаркта миокарда, у 4,1 % — изме-
нения только конечной части желу-
дочкового комплекса, а у 6,9 % бо-
льных изменения в 12 отведениях
стандартной ЭКГ отсутствовали.
В подавляющем большинстве
случаев причинами ложноотрицате-
льных изменений на ЭКГ при
крупноочаговом ПИМ считают раз-
витие инфаркта миокарда на фоне
«старых» рубцовых изменений мио-
карда и циркулярного инфаркта
миокарда переднезадней локализа-
ции, наличие внутрижелудочковых
блокад, особенно левой ножки пуч-
ка Гиса.
Исследование сывороточных фер-
ментов является вторым по значи-
мости методом диагностики ПИМ.
До 70—80-х годов прошлого сто-
летия для диагностики ПИМ широ-
ко использовались такие сыворо-
точные ферменты, как аспартат-
аминотрансфераза (ACT), лактатде-
гидрогеназа (ЛДГ), креатинфосфо-
киназа (КФК), однако ввиду их не-
высокой специфичности точность
диагностики ПИМ при учете пере-
численных ферментов не превыша-
ла 75—80 %. Эти ферменты могут
быть использованы в диагностике
ПИМ через 12—24 ч после его раз-
вития в случаях, когда уровень ACT
не ниже 200 е/л при отношении
АСТ/АЛТ > 2 в сочетании с уров-
нем ЛДГ выше 1300 е/л и уровнем
общей КФК выше 1000 е/л. Точ-
ность диагностики при этом дости-
гает 80 %. Более ранняя диагности-
ка ПИМ возможна при исследова-
нии миокардиальной фракции кре-
атинфосфокиназы, которая повы-
шается к 6-му часу после его разви-
тия. Мы обнаружили, что у 52,5 %
больных с ПИМ после аортокоро-
нарного шунтирования МВ-КФК
находилась в пределах 6—8 %, у
45 % — составляла более 8 %, и
только у 2,5 % пациентов ее значе-
ния были ниже 6 %. Таким обра-
зом, точность диагностики при
определении МВ-КФК составляет
97,5 %.
В последние несколько лет в ли-
тературе приводятся убедительные
данные о практически 100 % точно-
сти диагностики ПИМ с помощью
исследования у больных в сыворот-
ке крови тропонина Т и I [Svedje-
holm et al., 1999; Benoit M.O. et al.,
2001; Holmvang L. et al., 2002].
Анализ клинического течения
периоперационного инфаркта мио-
карда у больных после АКШ пока-
зал, что более чем в 90 % случаев
ПИМ сопровождается нарушения-
ми в системе кровообращения или
комбинацией этих нарушений с по-
лиорганной дисфункцией.
Принципы лечения:
• поддержание адекватной функ-
ции кровообращения и дыхания;
• предупреждение и лечение
опасных для жизни аритмий;
• попытки восстановления коро-
нарного кровотока в месте окклю-
зии (ангиопластика, стентирование
коронарных артерий; экстренная
операция АКШ), которые следует
предпринимать не позднее 6 ч от
развития ПИМ;
• мероприятия, направленные на
ограничение зоны инфаркта (внут-
риаортальная баллонная контрпу-
льсация, бета-адреноблокаторы, ан-
тагонисты кальция, препараты, воз-
действующие на обменные процес-
сы — неотон, актовегин, цитомак и
др.);
• антикоагулянтная и антиагре-
гантная терапия;
• профилактика и лечение сопут-
ствующих осложнений.
Летальность при ПИМ в среднем
колеблется от 20 до 24 % [Барк-
рофт Д., 1937; Лабори А., 1970], од-
нако если он протекает с клиникой
кардиогенного шока, то достигает
60-90 %.
Особую роль в комплексном ле-
чении ПИМ занимает внутриаорта-
льная баллонная контрпульсация.
За последние годы показания к ис-
пользованию данного метода зна-
чительно расширились. Метод при-
меняют в следующих случаях:
• при остром инфаркте миокарда,
осложненном кардиогенным шо-
ком;
• при тяжелых формах нестабиль-
ной стенокардии;
Дата добавления: 2015-10-21; просмотров: 70 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Острая недостаточность кровообращения | | | Синдром острого повреждения легких и острый респираторный дистресс-синдром |