
|
Читайте также: |
Для получения азокрасителей используется реакция азосочетания, представляющая собой процесс электрофильного замещения атома водорода в кольце ароматических аминов или фенолов на группу Аr-N=N-. В качестве электрофила выступает диазоний-катион. Ароматические амины, из которых получаются соли диазония, называются диазосоставляющими. При синтезе водорастворимых азокрасителей в качестве диазосоставляющей часто применяется сульфаниловая кислота. С целью удобства проведения диазотирования используют хорошо растворимую в воде натриевую соль сульфаниловой кислоты. В результате диазотирования образуется п -диазобензолсульфонат, который представляет собой внутреннюю соль (“биполярный ион”, “цвиттер-ион”). Особенностью этой внутренней соли является малая растворимость в водных растворах кислот, поэтому в ходе диазотирования п -диазобензолсульфонат выпадает в виде осадка. Этим он отличается от большинства других солей диазония, которые очень хорошо растворимы в воде и водных растворах кислот. Малая растворимость в воде самой сульфаниловой кислоты также объясняется существованием ее в кристаллическом состоянии в виде биполярного иона (см. стр. 107, 108).
Ароматические соединения, в молекулах которых происходят замещения атомов водорода на арилазогруппы, называются азосоставляющими. При получении метилоранжа в качестве азосоставляющей применяется N,N-диметиланилин (амин), а в синтезе b -нафтолоранжа и резорцинового желтого – соответственно b -нафтол и резорцин (фенолы).
Соотношение реагентов (кислота и щелочь), а также порядок их смешивания подобраны таким образом, чтобы азосочетание с амином проходило в слабокислой, а с фенолами – в слабощелочной среде.
Азокрасители, содержащие сульфогруппы, обладают хорошей растворимостью в воде, особенно в форме натриевых солей. Метилоранж применяется в качестве индикатора при кислотно-основном титровании, так как способен изменять свой цвет в растворе при изменении рН в интервале 3,1– 4,4.

b -Нафтолоранж и резорциновый желтый являются простейшими представителями так называемых кислотных красителей. Более сложные аналоги этих соединений используются для крашения шерсти, шелка, кожи и других материалов, в состав которых входят белки. Процесс крашения подобными красителями проводят в кислой среде, отсюда их название “кислотные красители”.
Выпадающие на заключительных стадиях синтеза осадки не могут быть абсолютно чистыми красителями. Добавки неорганических солей к водным растворам органических соединений уменьшают растворимость последних, и они выпадают в осадок. Такой способ выделения веществ из растворов называется “высаливанием”. При высаливании натриевых солей метилоранжа или b -нафтолоранжа вместе с ними соосаждается часть хлористого натрия.
При необходимости кислотные красители могут быть очищены перекристаллизацией из воды. В некоторых случаях присутствие небольшого количества хлористого натрия в препарате не препятствует дальнейшему применению красителя. Но при этом необходимо знать, сколько чистого красителя или, как принято называть, “активного ингредиента”, содержится в полученном продукте. Для определения концентрации красителей в растворах используют спектрофотометрический метод (рис. 26). В его основе лежит уравнение Ламберта-Бугера-Бера:
A = lg (I 0/ I) = e· c · l.
Здесь A – оптическая плотность раствора; I 0 – начальная интенсивность светового потока; I – то же после прохождения его через слой раствора толщиной l (см) с концентрацией c (моль/л); e – молярный коэффициент погашения.
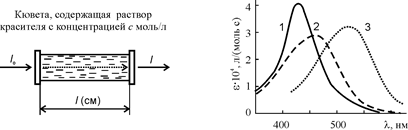
Рис. 26. К принципу фотометрирования
Рис. 27. Спектры поглощения в видимой области: 1 – резорцинового желтого в воде, 2 – метилоранжа в щелочной среде, 3 – метилоранжа в кислой среде
Величина e зависит от длины волны света; эта зависимость называется электронным спектром поглощения. Примеры спектров красителей приведены на рис. 27, а величины e – в таблице 6.
Из уравнения Ламберта-Бугера-Бера следует, что концентрация красителя в растворе Б равна:
c Б = A /(e· l)
Вместе с тем, молярная концентрация красителя в растворе Б равна:
c Б = 0,01 p · a ·1000 v /(M · v A· v Б)
Приравнивая два последних выражения, получаем уравнение, из которого следует расчетная формула (1).
Контрольные вопросы
1. Почему реакцию диазотирования проводят при пониженной температуре?
2. Сколько молей кислоты фактически берется в данном синтезе в расчете на 1 моль ароматического амина? Сравните результаты расчета с требуемым числом молей по уравнению реакции. Чем вызвана необходимость применения избытка кислоты?
3. Как определить конец реакции диазотирования?
4. Объясните механизм реакции азосочетания. Какое влияние на скорость этой реакции оказывают заместители в бензольном кольце диазоний-катиона? Дайте объяснение на примерах пара- нитро- и пара -метокси-замещенных:

5. Почему в качестве азосоставляющих применяются практически только фенолы и ароматические амины?
6. Какие значения рН являются оптимальными при проведении азосочетания: а) с фенолами, б) с аминами? Для объяснения следует рассмотреть кислотно-основные формы диазо- и азосоставляющих в средах с высокими (³ 10) и низкими (£ 5) значениями рН.
7. Свойства и области применения азокрасителей, содержащих сульфогруппы.
8. Объясните сущность спектрофотометрического метода определения концентрации окрашенного вещества в растворе.
Дата добавления: 2015-10-21; просмотров: 330 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Азосочетание | | | Основные теоретические положения |