
|
Читайте также: |

|
| масло какао |
| касторовое масло |
| 32-38 |
| 82-88 |
150-175
Определение иодного числа проводят следующим образом:
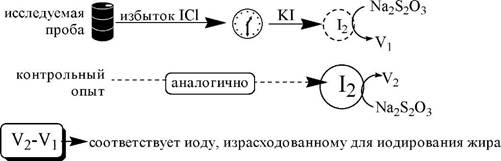
|
18.3. Иодатометрическое титрование
| OH |

| + 3ICl ^ |
| + 3HCl |
| I |
Иодатометрическое титрование - титриметрический метод анализа, в котором в качестве титранта используется KIO3.
В зависимости от условий проведения титрования иодат может восстанавливаться до различных продуктов: в кислой среде - до иоди- да, в 3 - 9 М HCl - до монохлорида иода:
IO-+ 6H ++ 6e ^ I- + 3H2O E0 = +1,08 В IO- + 6H + + 2Cl- + 4e ^ ICl- + 3H2O E0 = +1,23 В
Обратите внимание, что факторы эквивалентности KIO3 в первой и второй реакциях различны. «По умолчанию», согласно Государственной фармакопее СССР, величина /экв KIO3 при приготовлении его стандартного раствора принимается равной 1/6. Если иодатометрическое определение основано на второй полуреакции, то эта величина утрачивает свой смысл и лишь усложняет расчёты.
Иодат калия обладает всеми свойствами первичного стандартного вещества, поэтому стандартные растворы этого вещества можно готовить по точной навеске KIO3. При необходимости стандартизацию растворов проводят иодометрически. Вначале проводят реакцию
KIO3 + 5KI + 3H2SO4 ^ 3I2 + 3K2SO4 + 3H2O
Затем выделившийся иод титруют стандартным раствором Na2S2O3.
| ОБНАРУЖЕНИЕ КОНЕЧНОЙ ТОЧКИ ИОДАТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ | ||||
| титрование основано на восстановлении иодата до иодида и проводится в умеренно кислой среде | титрование основано на восстановлении иодата до ICl и проводится в сильно кислой среде | |||
Г
IO3" + Red ^ I" +...
Дата добавления: 2015-09-07; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Способы иодометрического титрования и его применение в фармацевтическом анализе | | | Крахмал |