
|
Читайте также: |
отношение массы растворённого вещества к объёму раствора
отношение количества растворённого вещества к объёму раствора
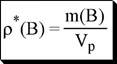
|
[p*(B)] = г/л [C(B)]= моль/л = M
|
Моляльность растворённого вещества представляет собой отношение количества этого вещества, находящегося в растворе, к массе растворителя. Обозначают моляльность как т(В), Ь(В), Ст(В). Размерность моляльности - моль/кг. Её используют в тех случаях, когда раствор находится в неизотермических условиях.
Для количественной характеристики стандартных растворов обычно используют молярную концентрацию (вещества или эквивалента вещества). Иногда для этой цели пользуются титром раствора.
Если стандартный раствор титранта используется для серийных анализов, то для его количественной характеристики удобно использовать титр соответствия (титр по определяемому веществу), который показывает массу определяемого вещества, взаимодействующего с 1 мл данного титранта. Например, титр 0,1000 М HCl по NaOH равен 4,000-10-3 г/мл.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный раствор HCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (к), например, в данном случае он равен 1,005.
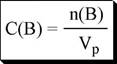
|
Пример 12.1. Какой объём раствора HCl с массовой долей растворённого вещества 16,5% и плотностью 1,08 г/мл необходимо взять для получения 500 мл 0,1 МHCl?
Vисх _ mрисх _ m(HCl) _ n(HCl) - M(HCl) _ C(HCl) - V - M(HCl) _ p _ra(HCl) -p_ ra(HCl) -p _ p-ra(HCl)
При использовании полученной формулы объём раствора, который необходимо приготовить, берут в литрах, а массовую долю - в долях единицы.
,,исх 0,1 - 0,5 - 36,5
V исх _ -------,----- ^ ^ 10 мл
1,08 - 0,165
| V |
Если объём получаемого раствора брать в мл, а массовую долю вещества в исходном растворе в %, то формула для расчёта будет иметь следующий вид:
исх C(HCl) - V - M(HCl) -100 _ C(HCl) - V - M(HCl)
p-a(HCl) -1000 p-ro(HCl) -10
0,1 - 500 - 36,5
10 мл
1,08 -16,5 -10
Дата добавления: 2015-09-07; просмотров: 196 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Объёмная | | | Расчёты, связанные с титрованием |