
Читайте также:
|
ф устойчивое стехио- метрическое соединение известного состава
ф желательно, чтобы её молярная масса превышала молярную массу определяемого вещества
В методе отгонки часть анализируемого объекта является летучей, либо летучее соединение получается из определяемого вещества в процессе химической реакции.
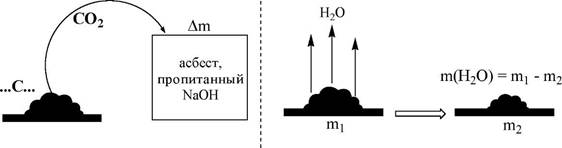 ПРЯМОЙ МЕТОД ОТГОНКИ КОСВЕННЫЙ МЕТОД ОТГОНКИ
ПРЯМОЙ МЕТОД ОТГОНКИ КОСВЕННЫЙ МЕТОД ОТГОНКИ
|
Реже встречается вариант гравиметрического определения, называемый методом выделения, в котором определяемое вещество отделяют от других компонентов смеси фильтрованием, центрифугированием, экстракцией. К такого рода гравиметрическим определениям можно отнести также процесс определения зольности органических материалов. Органическое вещество разрушают с образованием летучих продуктов, и затем измеряют массу оставшейся золы
Наряду с перечисленными известны такие гравиметрические методы как термогравиметрия и электрогравиметрия, которые обычно относят к инструментальным методам анализа. При термогравиметрических определениях с помощью специальных термовесов измеряют изменение массы вещества при его нагревании. В электрогравиметрии в результате протекания процесса электролиза определяемое вещество осаждается на электроде (например, Ag+ в виде Ag на катоде или свинец в виде PbO2 на аноде). Аналитическим сигналом является увеличение массы электрода.
11.3. Понятие о механизме образования осадка
Необходимым условием для образования осадка является превышение произведением концентраций ионов, входяших в его состав, произведения растворимости. Образование осадка является сложным процессом, протекающим во времени и включающим в себя несколько стадий.
Момент смешивания реактивов и визуально заметное появление осадка разделяет некоторый промежуток времени, называемый индукционным периодом. Его величина зависит от химической природы образующегося осадка, концентрации реагентов, методики проведения эксперимента, чистоты реактивов и т.д.
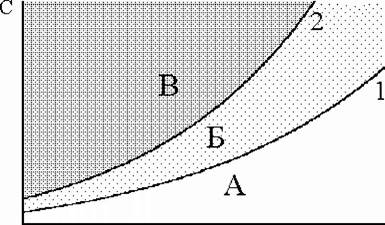 Рис. 11.1. Возможная зависимость растворимости (1) и сверхрастворимости (2) от температуры
А - ненасыщенный раствор, Б - устойчивый (метастабильный) пересыщенный раствор, В - неустойчивый пересыщенный раствор
Рис. 11.1. Возможная зависимость растворимости (1) и сверхрастворимости (2) от температуры
А - ненасыщенный раствор, Б - устойчивый (метастабильный) пересыщенный раствор, В - неустойчивый пересыщенный раствор
|
| t,°С |
| Разность между сверхрастворимостью и растворимости зависит от природы вещества. Например, у BaSO4 сверхрастворимость превышает растворимость примерно в тысячу раз, т.е. о данном веществе можно сказать то, что оно склонно образовывать пересыщенные растворы, у AgCl сверхрастворимость больше растворимости всего лишь в 5 раз. Процесс образования осадка начинается с образованияпервичных центров кристаллизации (первичных зародышей). |
Образованию осадка предшествует образование пересыщенного раствора. Максимальная концентрация вещества в пересыщенном растворе, при которой последний ещё остаётся устойчивым, называется сверхрастворимостью. Возможная зависимость растворимости и сверхрастворимости от температуры приведена на рис. 11.1.
|
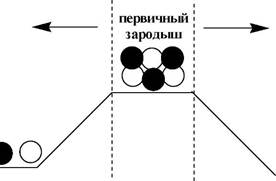
| Частицы, содержащие меньше ионов, чем критический зародыш склонны к разрушению и растворению. |
| Частицы более крупные, чем критический зародыш несклонны к растворению и стремятся к дальнейшему укрупнению. |
Размер критического зародыша зависит от природы образующих его ионов и составляет по одним данным 2-9 ионов, по другим - до 100 ионов.
ОБРАЗОВАНИЕ ПЕРВИЧНОГО ЗАРОДЫША
посторонняя,частичка
|
спонтанное (гомогенное)
осадок

|
| О |
| о |
| о |
| О |
| индуцированное (гетерогенное) |
Образующиеся осадки могут быть:

|

|
©
|

|
| ОП = |
состоят из множества слабо связанных между собой очень мелких кристалликов
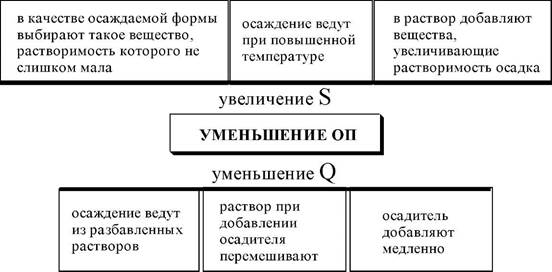
Характер образующегося осадка зависит от соотношения скоростей двух процессов: образования зародышей и роста первичных центров кристаллизации, которые зависят от относительного пересыщения раствора, возникающего при добавлении осадителя.
Q - S
S
где Q - концентрация осаждаемого компонента в какой-то момент времени в пересыщенном растворе; S - концентрация осаждаемого компонента в насыщенном растворе («растворимость»).
Скорости процессов образования первичных зародышей и роста
кристаллов связаны с ОП уравнением: и = k • (ОП)П. Для второго
процесса n = 1, а для первого «4, но величина k для процесса роста кристаллов больше, чем для процесса образования центров кристаллизации
| образование центров кристаллизации/ |
| t |
| а с с е ц о р а л т с о р ко с |
| рост кристаллов |
| относительное пересыщение |
| Рис. 11.2. Зависимость скоростей процессов образования первичных центров кристаллизации и роста кристаллов от величины ОП |
Примерная зависимость скорости процесса образования первичных зародышей и роста образовавшихся кристаллов от относительного пересыщения приведена на рис. 11.2. При малых значениях относительного пересыщения
преобладает рост кристаллов, вследствие чего образуется немного крупных кристаллов, при
больших - образование новых первичных центров кристаллизации, поэтому образуется множество мелких кристалликов.
Для образования крупнокристаллического осадка необходимо, чтобы величина относительного пересыщения при добавлении осадителя была незначительной.
|
Очень медленного поступления осадителя можно добиться с помощью приёма, называемого методом возникающих реагентов или осаждением из гомогенного раствора. К раствору добавляют вещество, образующее осадитель в процессе медленно протекающей реакции.
| S |
| 2+ |
| Cu |
O
HoN-C-NHo + H2O ^ H9N-C-NH9+ H2S
тиомочевина
| H3C C N OH C H3C C N OH |
^C^O
C
| 2+ |
| 1 Ni |
I + 2NH2OH ^ CO
H3C диацетил
Дата добавления: 2015-09-07; просмотров: 150 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Чувствительность | | | Диметилглиоксим |