
ОБЩАЯ ХАРАКТЕРИСТИКА ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ
АНАЛИЗА
12.1. Основные понятия титриметрии
Титриметрическими называют методы анализа, основанные на титровании.
Титрование - это процесс определения вещества, при котором к нему постепенно прибавляют небольшие порции реагирующего с ним другого вещества до того момента, пока всё определяемое вещество не вступит в реакцию. Реагент, используемый для титрования, называется титрантом.
Обычно в титриметрических методах анализа титрант добавляют к анализируемому веществу в виде раствора с точно известной концентрацией растворённого вещества. Количество титранта, вступившего в реакцию, определяется по объёму раствора, затраченному для титрования. Вследствие этого раньше титриметрические методы анализа называли объёмными. Сейчас такой термин не используют, так как понятие "титрование" имеет более широкий смысл, потому что титрант, в принципе, можно добавлять не только в виде раствора, но и в виде порошка, таблеток, бумаги, пропитанной раствором реагента. Известен вид титрования, называемый гравиметрическим, при котором измеряют не объёмы растворов, а их массы, например, взвешивают бюретку с титрантом до и после проведения титрования. Понятие "объёмные методы анализа" в настоящее время имеет другой смысл и обозначает методы анализа, в которых измеряют объём газовой, жидкой или твёрдой фазы.
Момент титрования, при котором количество прибавленного титранта становится химически эквивалентным количеству определяемого вещества, называется точкой эквивалентности.
Точка эквивалентности - теоретическое понятие. Для того чтобы практически определить момент, при котором всё определяемое вещество вступило в реакцию с титрантом, следят за изменением свойства системы, связанного с протекающей при титровании реакцией.
Момент титрования, при котором изменение свойства системы указывает на достижение эквивалентности, называется конечной точкой титрования (точкой конца титрования).

|
| исчезновение окраски фенолфталеина |
| появление розовой окраски раствора |
V
В идеальном случае точка эквивалентности и точка конца титрования должны совпасть. В действительности, вследствие несовершенства нашего зрительного анализатора, применяемых индикаторов и приборов, количество титранта, затраченного для титрования, оказывается, как правило, немного большим или немного меньшим, чем это нужно для достижения химической эквивалентности.
12.2. Классификация титриметрических методов анализа и способов титрования
В зависимости от типа химической реакции, протекающей между определяемым веществом и титрантом, выделяют:
• кислотно-основное титрование - титриметрические методы анализа, основанные на протолитических реакциях;
• комплексометрическое титрование - титриметрические методы анализа, основанные на реакциях образования растворимых комплексных соединений;
• осадительное титрование - титриметрические методы анализа, основанные на реакциях образования малорастворимых соединений;
• окислительно-восстановительное титрование - титримет- рические методы анализа, основанные на окислительно- восстановительных реакциях.
HCl + NaOH 4 NaCl + H2O
| J |
| v |
Титрант добавляют непосредственно к определяемому
Определяемое вещество стехио метр ич ески взаимодействует с другим веществом, способным взаимодействовать с титрантом. Само определяемое вещество с титрантом не реагирует
Ca2+ + C2O42- 4 CaC2O 4l
CaC2O 4l + H2SO4 4 CaSO 4l + H2C2O4
5H2C2O4 + 2KMnO4 +3H2SO4 4
4 2MnSO4 + 10CO 2t + K2SO4 + 8H2O
Вначале проводят стехиометрическую реакцию определяемого вещества со вспомогательным реагентом. Полученный продукт, количество которого эквивалентно количеству определяемого вещества, титруют соответствующим титрантом.
| В зависимости от способа выполнения различают: NH4Cl + NaOH 4 NaCl + NH3t + H2O NaOH + HCl 4 NaCl + H2O К определяемому веществу добавляют точное количество первого титранта, взятого в заведомом избытке. После того, как пройдёт реакция, непрореагировавший первый титрант |
| J |
веществу
^титруют вторым титр антом.
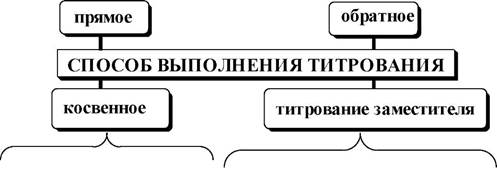
|
| V |
K2Cr2O7 + 6KI + 7H2SO4 4 4 Cr2(SO4)3+ 3I2 + 4K2SO4 + 7H2O I2 + 2Na2S2O3 4 2NaI+ Na2S4O6
Существуют и более сложные методики, сочетающие в себе несколько перечисленных способов титрования.
Реакция, лежащая в основе прямого титрования, должна:
• протекать количественно, иначе говоря, иметь большую константу равновесия, поскольку нет возможности добавлять избыток реагента;
• протекать быстро и, по возможности, при комнатной температуре;
• быть стехиометричной, т.е. протекать строго согласно уравнению реакции. Изменение условий не должно влиять на её ход и на свойства конечных продуктов.
Кроме того
• должен существовать способ обнаружения (визуальный или инструментальный) конечной точки титрования.
Если хотя бы одно из перечисленных требований к реакции не выполняется, приходится использовать другие способы титрования. Так, например, прямое титрование иона NH4+ раствором щёлочи невозможно из-за малой константы равновесия реакции, титрование K2Cr2O7 раствором Na2S2O3 - из-за нестехиометрического протекания реакции и т. д.
В титриметрии, как и в любом другом методе количественного анализа, обычно проводят несколько параллельных определений. При этом существует два подхода к их проведению, называемые методом отдельных навесок и методом пипетирования (рис. 12.1).
 Рис. 12.1. Метод отдельных навесок (1) и метод пипетирования (2)
Рис. 12.1. Метод отдельных навесок (1) и метод пипетирования (2)
|
Метод отдельных навесок более трудоёмок, требует больших количеств анализируемого объекта. Однако результаты анализа этим методом имеют меньшую неопределённость (результат зависит от неопределённости взятия навески, а в методе пипетирования также и от измерения объёмов исходного раствора и аликвот), вследствие чего он чаще используется, например, в фармакопейном анализе.
12.3. Стандартные растворы и стандартные вещества
Как уже упоминалось выше, титрантом называют активный реагент, используемый для титрования. Поскольку титрование обычно проводят с помощью раствора титранта, то иногда титрантом называют не само активное вещество, а его раствор, применяемый для титрования.
Раствор, концентрация активного вещества в котором известна с высокой точностью, называется стандартным раствором.

|
Стандартным веществом в титриметрии называется реагент, используемый для стандартизации раствора титранта.
K2&2O7 Na2B4O7-10H2O
1----------------------------------------------------
| Высокочистые вещества,! используемые для стандартизации j титрантов либо для приготовления! стандартных растворов, которые будут использоваться в качестве самостоятельных титрантов
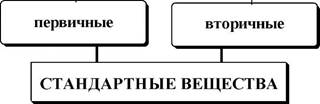
|
В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
• состав строго соответствует химической формуле;
• выпускаются промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаются очистке;
• устойчивы при обычных условиях;
• нелетучи и, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы).
| стандартный раствор HCl Растворы веществ, способных реагировать с титрантом, стандартизированные с помощью первичного стандартного вещества. |
• имеют большую молярную массу (меньше погрешность при измерении массы).
Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом (нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
Дата добавления: 2015-09-07; просмотров: 155 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| МИЦЕЛЛА | | | Объёмная |