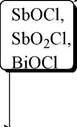Пятая аналитическая группа катионов
К пятой аналитической группе относятся катионы Mg2+, Mn2+,
Fe2+, Fe3+, B13+, Sb (III) и Sb (V). Образуют малорастворимые гидро-
2+
ксиды, карбонаты, сульфиды (кроме Mg), фосфаты. Растворы солей магния, висмута (III) и сурьмы (III, V) бесцветны. Растворы солей Fe (II) имеют бледно-зелёную окраску, Fe (III) - от жёлтой до коричневой (вследствие образования гидроксокомплексов) и Mn (II) - бледно- розовую окраску. Разбавленные растворы солей Fe (II) и Mn (II) бесцветны. Ионы Fe2+, Fe3+, B13+, Sb (III) и Sb (V) способны образовывать
3 4 3
комплексные соединения, например, [Fe(CN)6] ", Fe(CN)6] ", [SbCl6] ",
2+
[SbCl6], [B1I4]. Все катионы данной группы (кроме Mg) проявляют
3+ 3+
окислительно-восстановительные свойства: Fe,B1
Sb (V) - окислители; Fe, Sb (III) - восстановители. Групповым реагентом является раствор NH3, от действия которого выпадают в осадок гидроксиды: белые Mg(0H)2, Mn(0H)2, Fe(0H)2, B1(0H)3, Sb(0H)3, Sb0(0H)3 и красно-бурый Fe(0H)3. Окраска Fe(0H)2 c течением времени изменяется до зелёной, а затем образуется красно-бурый Fe(0H)3. Осадки гидроксидов растворяются в кислотах и не растворяются в избытке щёлочи и аммиака.
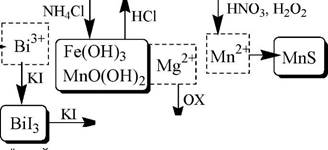
Схема систематического анализа
Sb3+, Sb(V), Bi3+, Fe2+, Fe3+, Mg2+, Mn2+
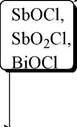
H20
2+ K3[Fe(CN^6];
FeK[Fe(CN)6]
синий
FeK[Fe(CN)6]
| [Fe(SCN)n](3-n)+
кроваво -кр асный
|
| Fe(0H)3, Mn0(0H)2, Mg(0H)2 |! Fe3+ Mn0(0H)2
|
| БЗ, HCl
[Бз+][Sba6]-
зелёный (толуол)
|
синий
Mn04
малиновый
Дата добавления: 2015-09-07; просмотров: 126 | Нарушение авторских прав
Читайте в этой же книге: Кислотно-основные свойства растворителя | Автопротолиз растворителя. Константа автопротолиза | Диэлектрическая проницаемость | Растворы слабых кислот или слабых оснований | Смеси кислот или оснований и многопротонные протолиты | Природа комплексообразователя и лигандов | Концентрация реагентов | Побочные реакции | Общий (одноименный) ион | Побочные реакции |
mybiblioteka.su - 2015-2026 год. (0.137 сек.)