
|
Читайте также: |
Первая аналитическая группа катионов
К первой аналитической группе катионов относятся катионы K+, Na+, NH4+, L1+. Группового реагента не имеют. Ионы NH4+ и K+ образуют малорастворимые гексанитрокобальтаты, перхлораты, хлорпла- тинаты, а также малорастворимые соединения с некоторыми крупными органическими анионами, например, дипикриламином, тетрафе- нилборатом, гидротартратом. Водные растворы солей катионов I группы, за исключением солей, образованных окрашенными анионами, бесцветны.
Li+, Na+, K+, NH4+
(NH4)2CO3
L1+, Na+, K+, NH4+
(NH4)2HPO4, EtOH
L13PO4)
| Гидратированные ионы K+, Na+, L1+ являются очень слабыми кислотами, более выражены кислотные свойства у NH4+ (рКй = 9,24). Несклонны к реакциям комплексообразования. В окислительно-восстановительных реакциях ионы K+, Na+, L1+ не участвуют, так как имеют постоянную и устойчивую степень окисления, ионы NH4+ обладают восстановительными свойствами. Обнаружение катионов I аналитической группы проводят по следующей схеме OH- |
| i |

| чёрные кубические кристаллы |
| Na2Pb[Cu(NO2)6] |
| цинк-уранил-ацетат |
| жёлтые октаэдрические кристаллы |
| Na+, K+, NH4+ |
| —упаривание прокаливание, растворение в воде |
| NaZn(UO2)3(CH3COO)9-9H2Q |
белый желеобразный
NH3t + H2O
Обнаружению K+, Na+, L1+ мешают катионы р- и d-элементов, которые удаляют, осаждая их (NH4)2CO3. Обнаружению K+ мешает NH4+, который удаляют прокаливанием сухого остатка или связыванием с формальдегидом:
4 NH4+ + 6CHOH + 4ОН- ^ (CH2)6N4 + 10Н20
Вторая аналитическая группа катионов
+ 2+
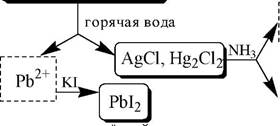
Ко второй аналитической группе относятся катионы Ag, Pb и Hg22+. Катионы данной группы образуют малорастворимые гидрокси- ды, хлориды, хроматы, карбонаты, сульфаты, сульфиды, иодиды, ар- сенаты, арсениты. Большинство солей в растворе бесцветны. Окрашены хроматы, дихроматы, иодиды, сульфиды и др. В присутствии восстановителей ионы Ag+ и Hg22+ восстанавливаются до элементарного состояния. Сильные окислители окисляют Pb2+ в Pb (IV), Hg22+ в Hg2+. Катионы данной группы склонны к образованию комплексных соединений. Групповым реагентом является хлороводородная кислота, осаждающая Ag+, Pb2+ и Hg22+ в виде белых осадков AgCl, Hg2Cl2, PbCl2. Осадок AgCl темнеет на свету в результате восстановления Ag+ до Ag. Осадок AgCl растворим в концентрированных растворах HCl и
хлоридов и легко растворяется в растворе NH3. Осадок Hg2Cl2 при действии NH3 чернеет вследствие образования Hg. Осадок PbCl2 растворяется в избытке HCl и хлорид-ионов, а также в горячей воде.
Схема систематического анализа: Ag+, Hg22+, Pb2+
| i |
| 2M HCl |
| AgCl, Hg2Cl2, PbCl2 |
| HgN^Cl, Hg j |
| жёлтый |
| жёлтый |
| KI |
| + |
| [Ag(NH3)2] |
| чёрный |
AgI
Дата добавления: 2015-09-07; просмотров: 269 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| июня. 2016 год. | | | Пятая аналитическая группа катионов |