
Читайте также:
|
К основным типам комплексных соединений относятся следующие.
Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4] S04, [Co(NH3)6] Cl3, {Pt (ЫНз)в] С14. Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH3NH2 (метиламин), C2H5NH2 (этиламин), NH2CH2CH2NH2 (зтиленднамин, условно обозначаемый En) и др. Такие комплексы называют а мина т а м и.
Аквакомплексы — в которых лигандом выступает вода: [Со(Н20)6] С12, [А1(Н20)6]С13, [Сг(Н20)6]С1з и др. Находящиеся в водном растворе гидратированные катионы содержат в качестве центрального звена аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов удерживают и кристаллизационную воду, например: [Си (Н20) 4] S04- Н20, [Fe(H20)6] S04-H20. Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании.
Ацидокомплексы. В этих комплексах лигандами являются анионы. К ним относятся комплексы типа двойных солей, например К2 [PtCl4], K4[Fe(CN)6] (их можно представить как продукт сочетания двух солей — PtCl4-2KCl, Fe(CN)2-4KCN и т. д.), комплексные кислоты — H2[SiF6], Н2[СоС14], гидроксокомплек- сы — Na2[Sn(OH)4], Na2[Sn(OH)6] и др.
-О—С=0
|
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами. О таких комплексах мы уже упоминали. Приведем переходный ряд между аммиакатами и ацидокомплексами платины(П): [Pt(NH3)4] С12,
[Pt(NH3)3Cl]Cl, [Pt(NH3)2Ci2], K[Pt(NH3)Cl3], K2[PtCl4].
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
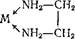
|
В этих комплексах символом М обозначен атом металла, а стрелкой — донорно-акцепторная связь. Примерами таких комплексов служат оксалатный комплекс железа(Ш) [Fe(C204)3]3_ и этилендиаминовый комплекс платины (IV) — [PtEn3]4+. К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцеп- торным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот.
Простейший их представитель — аминоуксусная кислота (глицин)' NH2CH2COOH — образует хелаты с ионами Cu2+, Pt2+, Rh3+, например:
| о=с- |
h2c-h2n4.,„nh2—сн2
-H2N NH2- —о/ хо
-с=о
Известны также комплексы с более сложными аминокарбоно- выми кислотами и их аналогами. Такие лигаиды называются ком- плексонами. Двухзарядный анион этилендиаминтетрауксусной кислоты, называемый в виде двунатриевой соли комплексоном III, или трилоном Б, дает с двухвалетным- металлом комплекс типа:
| -СНг V |
| , НцС- V |
| НО О СП, с. |
| <СН,СООН |
с с
о
Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» циклическим лиган- дом. Наибольшей устойчивостью обладают хелаты с пяти- и ше- стичленными циклами. Комплексоны настолько прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые вещества, как сульфаты кальция и бария, окса- латы и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и изготовлении цветной пленки. Большое применение они находят и в аналитической химии.
Многие органические лиганды хе- латного типа являются весьма чувствительными и специфическими реагентами на катионы переходных металлов. К ним относится, например, диметилглиоксим, предложенный Л. А. Чугаевым как реактив на ионы Ni2+ и Pd2+.
| о |
 Лев Александрович Чугаев(1873—1922)
Лев Александрович Чугаев(1873—1922)
|
Лев Александрович Чугаев принадлежит к числу наиболее выдающихся советских химиков. Родился в Москве, в 1895 г. окончил Московский университет. В 1904—• 1908 г. — профессор Московского высшего технического училища, в 1908—1922 г. — профессор неорганической химии Петербургского университета и одновременно (с 1909 г.) — профессор органической химии Петербургского
технологического института. Занимался изучением химии комплексных соединений переходных металлов, в особенности металлов платиновой группы. Открыл много новых комплексных соединений, важных в теоретическом и практическом отношениях. Чугаев впервые обратил внимание на особую устойчивость 5- и 6-членных циклов во внутренней сфере комплексных соединений и охарактеризовал кислотно-основные свойства аммиакатов платины (IV). Он был одним из основоположников применения органических реагентов в аналитической химии. Много внимания уделял организации и развитию промышленности по добыче и переработке платины и платиновых металлов в СССР. Создал большую отечественную школу химиков-неоргаников, работающих в области изучения химии комплексных соединений.
Большую роль играют хелатиые соединения и в природе. Так, гемоглобин состоит из комплекса — гема, связанного с белком — глобином. В геме центральным ионом является ион Fe2+, вокруг которого координированы четыре атома азота, принадлежащие к сложному лиганду с циклическими группировками. Гемоглобин обратимо присоединяет кислород и доставляет его из легких по кровеносной системе ко всем тканям. Хлорофилл, участвующий в процессах фотосинтеза в растениях, построен аналогично, но в качестве центрального иона содержит Mg2+.
Все перечисленные классы комплексных соединений содержат один центральный атом, т. е. являются одноядерными. Встречаются комплексы и более сложной структуры, содержащие два или несколько центральных атомов одного и того же или разных элементов. Эти комплексы называются поли (много) ядерны- м и.
Существуют различные типы полиядерных комплексов.
Комплексы с мостиковыми атомами или группами атомов, например с мостиковыми атомами хлора —CI: —>- (хлоро-), кислорода
Н Н
-Ю— (оксо-), с мостиковыми группами —N: —(амино), —О: > (гидр-
* Н
оксо). Так, комплекс [Cr(NH3)5 —ОН ■—> (NH3)5Cr]Cl5 является биядерньш комплексом с одной мостиковой гидроксогруппой. К подобным соединениям относится и димер А12С16 (см. стр. 615).
Комплексы кластерного типа, в которых атомы металла непосредственно связаны друг с другом. Это наблюдается, например, в димерах (CO)sMn — Mn(CO)s, [Re2H2Cl8j2-. В последнем соединении между атомами рения имеется тройная связь:
- СЦ /С1 С1у /С\ -.2-
Н—Re Re—Н
- Cl/ ^Cl ci/ Vn -
К многоядерным соединениям относятся также изополи- и гетерополи- кислоты.
Изополи кислоты образуются при соединении двух или нескольких кислотных остатков одной и той же кислородной кислоты за счет кислородных мостиков. В их число входят двухромовая Нг'СгО?, пирофосфорная Н4Р207, тетраборная Н2В407 кислоты, а также поликремниевые кислоты, составляющие основу силикатов.
Гетеропол и кислоты содержат не менее двух различных кислот или оксидов (производных неметалла и металла) и большое количество воды (до 30 молекул). Наиболее важное значение в аналитической химии имеют следующие гетерополикислоты:
Н3Р04 • 12Мо03 • яН20 — фосфорномолнбденовая Н3РО4 • 12W03 • fiH20 — фосфорновольфрамовая H4Si04 • 12МоОз • «Н20 — кремнемолибденовая H4Si04 • I2WO3 • яН20 — кремневольфрамовая
Известно немного комплексов, в которых центром координации является анион, — это полигалоген иды, содержащие анионы [I -xh]" (где х меняется от 1 до 4) или [Вг-хВгд]- (где х 1 или 2); существуют и смешанные полигалогенидные анионы — [I-Br2]-, [I - С11. Большую роль при их образовании играет поляризация: чем больше интенсивность поляризационного взаимодействия между анионом Э~ и молекулой Э2, тем устойчивее комплекс. Именно поэтому наиболее устойчивыми из них оказываются полииодиды (молекулы 12 легко поляризуются), а полифториды не получены. Вследствие наличия "в растворе равновесия
I3- I" + I2
раствор гюлииодида обнаруживает свойства свободного иода.
Существует много способов образования названий комплексных соединений, в том числе и традиция называть их по фамилиям исследователей, их открывших. Такой способ, хотя и отдает дань уважения ученым, сложен для запоминания. Мы приведем номенклатуру главнейших типов комплексных соединений, основанную на рекомендациях Международного союза теоретической и прикладной химии.
Название комплексного аниона начинают с указания состава внутренней сферы.
Во внутренней сфере, прежде всего называют анионы, прибавляя к их латинскому названию окончание «о». Например: С1~ —
хлоро, CN- — циано, SOI" — сульфита, ОН- — гидроксо и т. д. Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква. Число лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4— тетра, 5 — пента, 6 — секса. Затем называют комплексообразователь, используя корень его латинского названия и окончание ат, после чего римскими цифрами указывают (в скобках) степень окисленности комплексо- образователя. После обозначения состава внутренней сферы называют внешнесферные катионы. В случае неэлектролитов степень окисленности центрального атома не приводят, так как она однозначно определяется, исходя из электронейтральности комплекса. Если центральный атом входит в состав катиона, то используют
русское название элемента и в скобках указывают его степень окисленности. Приведем примеры:
■ тетрацианодиамминферрат(1П) калия тетрахлородигидроксоплатинат(1У) аммония
| K[Fe(NH3)2(CN)4] (NH4)2[Pt(OH)2Cl4] [Cr(H20)3F3] [Co(NH3)3 (N02)2C1] • [Pt(NH3)„Cl2]Cl2 [Ag(NH3)2]Cl |
■трифторотриаквахром хлородинитритотриам минкобальт хлорид дихлоротетраамми:-;платины(1У)
■хлорид диамминсеребра(1)
205. Пространственное строение и изомерия комплексных соединений. Одинаковые лиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще встречаются четные координационные числа — 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
Координационное число
| Геометрическая конфигурация ■линеипая |

|
| ■ плоская квадратная |
| — тетраэдрическая |
| • октаэдрическая, схематически изображаемая так: |
_
|
Впервые правильные представления о пространственном строении комплексных соединений были сформулированы А. Вернером. При этом он исходил из найденного опытным путем числа изомеров при наличии двух или более различных лигандов в комплексе и сравнивал его с возможным числом для той или иной предполагаемой конфигурации. Так, для координационного числа 4 и тет- раэдрической конфигурации все положения лигандов относительно

|
| NHj |
| Рис. 158. Пространственное строение изомеров [Pt^NHs^jClj]! слева—транс-изомер; справа—«ие-нзомер. |
СГ
 Рис. 157. Пространственное строение комплексного кона JPlCIgj2". Рис. 158. Пространственное строение изомеров [''((МНз^С^]:
слева — граие-изомер; справа — i5u,-изомер.
Рис. 157. Пространственное строение комплексного кона JPlCIgj2". Рис. 158. Пространственное строение изомеров [''((МНз^С^]:
слева — граие-изомер; справа — i5u,-изомер.
|
центрального атома эквивалентны. Поэтому тетраэдрические комплексы типа [МА2В2] (где М — центральный атом, а А и В — ли- ганды) не имеют изомеров. Другое наблюдается в комплексах платины (И); например, [Pt(NH3)2C12] встречается в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. Отсюда был сделан вывод о расположении лигандов по квадрату вокруг центрального атома, так как именно для этой конфигурации у соединений типа [МА2В2] должно иметься два изомера. В одном из изомеров комплекса [Pt(NH3)2Cl2] атомы хлора разделены центральным атомом (гранс-изомер), а в другом (^ис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 156).
При увеличении числа различных заместителей число изомеров растет и для соединений типа [MABCD] для квадратной конфигурации возможно уже три изомера.

|
Изучая явления изомерии комплексных соединений с координационным числом 6, Вернер пришел к выводу, что в этом случае лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 157). Если все координированные группы одинаковы, как показано на рисунке, то, конечно, перестановка одной группы на место другой не изменит структуры комплекса. Но если группы не одинаковы, то возможно различное их расположение, вследствие чего могут образоваться изомеры. И действительно, опыт показывает, что, например, соединение [Pt (NH3) 2CI4] (где координационное число платины равно 6) существует в двух изомерных формах, отличающихся одна от другой по своей окраске и другим свойствам. Строение этих изомеров,по Вернеру,схематически показано на рис. 158. В одном случае молекулы NH3 помещаются у противоположных вершин октаэдра (транс-изомер), в другом — у соседних (цис-изомер). Подобного рода пространственная изомерия наблюдается и
Рис. 159. Кристаллическая решетка K2[PtCl6].
у ряда других комплексов с шестью лпгандами во внутренней сфере.
Предположения Вернера относительно октаэдрического строения комплекса с координационным числом 6 блестяще подтвердились при рентгенографическом исследовании кристаллов соответствующих соединений. На рис. 159 изображена кристаллическая решетка комплексной соли K2[PtCl6]. В ней комплексные ионы [PtCl6j2~ находятся в вершинах и центрах граней куба, причем хлорид-ионы в комплексе расположены в вершинах правильного октаэдра. Таким образом, ион [РЮЦ]2- не только сохраняется в растворах, но и является самостоятельной структурной единицей в кристаллической решетке.

| К ОМг |
К геометрической изомерии можно отнести и зеркальную (оптическую) изомерию, рассмотренную ранее (стр. 446) на примерах органических соединений. Например, комплексы [СоЕп3]СЦ (En — этилендиамин) и цис- [CoEn2Ci2] С1 существуют в виде двух зеркальных антиподов:
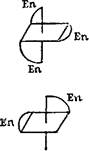
|

|
| fin. |
| D |
| En |
[СоЕпз]3+
цис-[ СоЕп2СЩ+
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидрат пая изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [Cr(H20)5jCl3, [Сг(Н20)5С1]С12-Н20, [Сг(Н20)4С12]С1-2Н20. При этом цвет комплекса меняется от сипе-фиолетового у [Сг(Н20)61С13 до светло-зеленого у [Cr(H20)4Cl!>]Cl • 2Н9О (см. также § 228).
Ионизационная изомерия определяется различным распределением ионов между внутренней и внешней сферами, например: [Co(NH3)5Br]S04 и [Co(NH3)5S04]Br; [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)fj] и [Cr(NH3)6]-,-[Co(CN)6],
Имеются среди комплексных соединений и полимеры: так, составу PIC12'2NH3 отвечают изомерные цис- и граяс-мономеры [Pt(NH3.)2Cl2], ди-
меры [Pt(NH3)4l[PtCl4], [Pt(NH3)3Cl][Pt(NH3)Cl3l и тример [Pt(NH3)3Cl2] • • [PtCl4],
Дата добавления: 2015-08-21; просмотров: 166 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ | | | Природа химической связи в комплексных соединениях. |