
|
Читайте также: |
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами ли- гандов. Наряду с силами притяжения действуют и силы электростатического отталкивания менаду одноименно заряженными (или, в случае полярных молекул, одинаково ориентированными) ли- гандами. В результате образуется устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Количественные расчеты на основе такой электростатической модели впервые были выполнены В. Косселем и А. Магнусом, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих факторов электростатическая теория была дополнена поляризационными представлениями (см. § 46), согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов с?-элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексных соединений, но многие другие их свойства остались необъясненными. Так, с позиций электростатической теории все комплексы с координационным числом 4 должны иметь тетраэдрическое строение, поскольку именно такой конфигурации соответствует наименьшее взаимное отталкивание лигандов. В действительности, как мы уже знаем, некоторые подобные комплексы, например, образованные платиной (II), построены в форме плоского квадрата. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание свойств и строения комплексных соединений может быть получено только на основе квантовомеханиче- ских представлений о строении атомов и молекул.
В настоящее время существует несколько подходов к кванто- вомеханическому описанию строения комплексных соединений,
Теория кристаллического поля основана на представлении об электростатической природе взаимодействия между центральным ионом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение d-орбиталей (см. рис. 20 на стр. 81) и связанное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
Рассмотрим состояние а-орбиталей центрального иона. В свободном ионе электроны, находящиеся на каждой из пяти а-орбиталей, обладают одинаковой энергией (рис. 160, а). Представим себе, что лиганды создают равномерное сферическое электростатическое поле, в центре которого находится центральный ион. В этом гипотетическом случае энергия d-орбиталей за счет отталкивающего действия лигандов возрастает на одинаковую величину, т. е. все d-орбитали останутся энергетически равноценными (рис. 160,6). В действительности, однако, лиганды неодинаково действуют на различные d-орбитали: если орбиталь расположена близко к лиганду, энергия занимающего ее электрона возрастает более значительно, чем в том случае, когда орбиталь удалена от лиганда. Например, при октаэдрическом расположении лигандов вокруг центрального иона наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz> и dx^y2, направленных к ли- гандам (рис. 161, а и б); поэтому их энергия будет более высокой, чем в гипотетическом сферическом поле. Напротив, dxy, dxz и dyz- орбитали направлены между лигандами (рис. 161, в), так что энергия находящихся здесь электронов будет ниже, чем в сферическом поле. Таким образом, в октаэдрическом поле лигандов происходит расщепление d-уровня центрального иона на два энергетических уровня (рис. 160, в): более высокий уровень, соответствующий орбиталям dz- и dX'-y* (их принято обозначать dy или eg), и более низкий, уровень, отвечающий орбиталям dxy, dxz и dyz (эти орбитали обозначают ds или t2s).
В dzt dxy
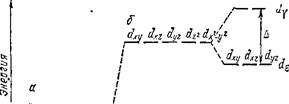 Рис. 160. Схема энергетических уровней d-орбиталей центрального иона:
Рис. 160. Схема энергетических уровней d-орбиталей центрального иона:
|
| а — свободный ион; б — ион в гипотетическом сферическом поле; в — ион в октаэдрическом поле лигандов. |
Разница в энергиях уровней dy и о!е, называемая энергией расщепления, обозначается буквой А; ее можно эксперимен-

|
тально определить по спектрам поглощения комплексных соединений. Значение А зависит как от природы центрального атома, так и от природы лигандов: лиганды, создающие сильное поле, вызывают большее расщепление энергетических уровней, т. е. более высокое значение А.
По величине энергии расщепления лиганды располагаются в следующем порядке (так называемый спектрохимический ряд [132]):
СО, CN" > этилендиамин (En) > NH3 > SCN" > Н20 > ОН" > F" > СГ> Br~ > I"
сильное I среднее I слабое
поле I поле I поле
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце — создающие слабое поле.
Электроны центрального иона распределяются по d-орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на ^е-орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем d-орбиталям, в соответствии с правилом Хунда (см. § 32). Если общее число электронов, находящихся на cf-орбиталях центрального иона, не превышает трех, то они размещаются на орбиталях более низкого энергетического уровня de по правилу Хунда. Так, у иона Сг3+, имеющего электронную конфигурацию внешнего слоя 3d3, каждый из трех d-электро- нов занимает одну из трех с?е-орбиталей.
Иное положение складывается, когда на cf-орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Хунда требует затраты энергии для перевода некоторых электронов на с^-орбитали. С другой стороны, при размещении максимального числа электронов на с£е-орбиталях нарушается правило Хунда и, следовательно, необходима затрата
1 ц -f + 4 14
| f —-Т dy |
| i, |
| Д |
|
Рис. IC2. Распределение электронов иона Со3+ по d-орби- талям:
й — в гипотетическом сферическом поле; б — в слабом ок- таэдрическом поле лигандоз (комплекс ICoFel3"); в—а сильном октаэдрическом поле лигандов (комплекс ICo(CN)6l3-).
энергии для перевода некоторых электронов на орбитали, на кото-- рых уже имеется по одному электрону. Поэтому в случае слабого поля, т. е. небольшой величины энергии расщепления, энергетически более выгодным оказывается равномерное распределение d-электронов по всем й'-орбиталям (в соответствии с правилом Хунда); при этом центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на йе-орбиталях; при этом создается низкоспиновый диамагнитный комплекс.
С этой точки зрения понятно, почему, например, комплекс f[CoFe]парамагнитен, а комплекс [Co(CN)6]3- диамагнитен. Положение лигандов F- и CN- в спектрохимическом ряду (см. выше) показывает, что ионам CN- соответствует значительно более высокая энергия расщепления А, чем ионам F-. Поэтому в рассматриваемых комплексах электроны центрального иона Со3+ распределяются по с(-орбиталям так, как это показано на рис. 162: комплекс [CoFe]3- — высокоспиновый, а комплекс [Co(CN)6]3- — низкоспиновый.
Мы рассмотрели теорию кристаллического поля в приложении к комплексам с октаэдрическим расположением (октаэдрической координацией) лигандов. С аналогичных позиций могут быть рассмотрены и свойства комплексов с иной, например тетраэдриче- ской, координацией.
На основе теории кристаллического поля удается объяснить не только магнитные свойства комплексных соединений, но и их специфическую окраску. Так, в комплексе [Ti(H20)6]3+ ион Ti3+ имеет один rf-электрон (электронная конфигурация d'). В нормальном (невозбужденном) состоянии этот электрон находится на одной из dg-орбиталей, но при затрате некоторой энергии (Д = = 238 кДж/моль) может возбуждаться и переходить на dy-орбиталь. Длина волны света, поглощаемого при этом переходе и соответствующего указанной энергии, равна 500 нм: это и обусловливает фиолетовую окраску комплекса [Ti(H20)e]3+. При таком рассмотрении становится понятным, почему комплексы, образованные ионами Cu+, Ag+, Zn2+ и Сц2+, как правило, бесцветны; эти ионы имеют электронную конфигурацию d10, так что все d-орбитали заполнены и переход электронов с dE на йу-орбитали невозможен. Ион же Си2+ образует окрашенные комплексы: он обладает электронной конфигурацией d9, так что один из rfg-электронов может при возбуждении переходить на dy-орбиталь.
Хотя теория кристаллического поля оказалась плодотворной в трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить положения лигандов в спектрохимическом ряду, а также сам факт образования некоторых комплексов, например, так называемых «сэндвичевых» соединений — дибензолхрома Сг(СбНб)г, ферроцена Fe(CsH5)2 и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный ион, не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами.
Метод валентных связей в приложении к комплексным соединениям базируется на тех же представлениях, что и в простых соединениях (см. §§ 39—44). При этом принимается во внимание, что химические связи, возникающие при комплексооб- разовании имеют донорно-акцепторное происхождение, т. е. образуются за счет неподеленной электронной пары одного из взаимодействующих атомов и свободной орбитали другого атома. Рассмотрим с этих позиций строение некоторых комплексных соединений.
В молекуле аммиака атом азота находится в состоянии sp3-raб- ридизации, причем на одной из его гибридных орбиталей находится неподеленная электронная пара. Поэтому при донорно-акцепторном взаимодействии молекулы NH3 с ионом Н+ образуется ион NH4"» имеющий тетраэдрическую конфигурацию. Аналогично построен комплексный ион [BF]4-: здесь донором электронной пары служит анион F-, а акцептором — атом бора в молекуле BF3, обладающий незанятой орбиталыо внешнего электронного слоя и переходящий при комплексообразовании в состояние 5/?3-гибридизации.
Такую же геометрическую конфигурацию (тетраэдр) имеют некоторые комплексы элементов подгруппы цинка, например [Zn (NH3) 4] 2+, [Cd(NH3)4]2+, [Hgl4]2-. Так, в комплексе [Zn(NH3)4]2+ ион цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну 4s- и три,4р-орбитали
| р | ||
| н | и | и |
| .2* |
| [zn(NH3)4]' |
| н | и | н | U |
| н |
| причем осуществляется 5р3-гибридизация, соответствующая размещению лигандов в вершинах тетраэдра (тетраэдрическая координация). |
| «• | ||
| р | ||
| и | н | ft |
| [in(NH3V]: |
| Н Н Н fi |
| s и |
| Ионы d-элементов с четырьмя занятыми d-орбиталями (Pt2+, Pd2+, Au3+) при координационном числе 4 предоставляют для электронных пар лигандов одну (n— 1)d-, одну ns- и две лр-орбитали, например, в комплексе [Pt (NHS) 4] 2+: Р |
При этом осуществляется гибридизация dsp2, отвечающая размещению лигандов в вершинах квадрата (квадратная координация). Поэтому такие комплексы, как [Pt(NH3)4] 2+, [PtCl4]2-, обладают структурой плоского квадрата.
Координационному числу 6 соответствует гибридизация d2sp3 и октаэдрическое расположение лигандов. Такая координация имеет место, например, в комплексах платины (IV):
| 4 + |
| Н Н ft |
| tl ti |
| I |
| fl |
[pt(NH3)J
Такая же октаэдрическая координация осуществляется в комплексах [Co(NH3)6]3+, [Fe(CN)6]4-, [RhCl6]3- и др.
Координационному числу 2 отвечает гибридизация sp-типа и линейная координация лигандов, например, в комплексе [Ag (NH3)2]+:
| • • | ||
| р | ||
| л | fl |
| |^ ^ | f ^ f i ff |
| [Ag(NH3)2l* |
| Н |
Рассмотренные примеры показывают, что метод ВС успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций этого метода и различия в магнитных свойствах (диа- магнитность или парамагнитность) комплексных соединений. Однако некоторые их свойства (например, спектры поглощения) не находят с позиций метода ВС удовлетворительного объяснения. Кроме того, взаймодействие между центральным атомом и лигандами в комплексных соединениях не сводится только к передаче электронов от лиганда. Существуют лиганды, которые способны
принимать электроны металла па вакантные орбитали, например на свободные d-орбитали (в молекуле PF3 или в ионе SnClj), или на незаполненные разрыхляющие орбитали (в молекулах С2Н(, СО, N0). Такие лиганды называют я-акцепторами, а связь их с центральным атомом л-дативной. Строение многих из открытых в последнее время комплексных соединений, например «сэндвиче- вых», нельзя объяснить с точки зрения метода ВС.
Метод молекулярных орбиталей. Молекулярные орбитали в комплексных соединениях образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах (см. § 45). Отличие заключается в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола (см. § 167).
Метод МО стал в настоящее время ведущим, наиболее плодотворным в теории строения комплексных соединений. В частности, он успешно объясняет строение и свойства уже упоминавшихся «сэндвичевых» соединений, например Сг(СбНб)г, Fe^Hsb, в которых центральный атом находится между циклическими органическими молекулами и связан с ними делокализованными многоцентровыми связями. Приложение метода МО к объяснению строения комплексных соединений рассматривается в специальных руководствах.
207. Диссоциация комплексных соединений в растворах. Мы
уже говорили о том, что внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости;, частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе.
Эта диссоциация называется первично й, она протекает почти нацело, по типу диссоциации сильных электролитов. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, диссоциацию комплекса [Ag(NH3)2]Cl можно записать так:
[Ag(NH3)2]Cl -—>- [Ag(NH3)2]++ СГ — первичная диссоциация [Ag(NH3)2]+ Ag+ + 2\ТН3 — вторичная диссоциация
Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NH3)2]+, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра. Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть значения произведения растворимости хлорида серебра (nPAgCi = 1,8-Ю-10). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости иодида серебра Agl составляет только 1-Ю-16, т. е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра Ag2S, произведение растворимости которого равно Ю-51.
Уравнение протекающих реакций можно записать так: [Ag(NH3)2]+ + I" —Aglj + 2NH3 2[Ag(NH3)2f + H,S —> Ag2Sj + 2NH3 + 2NHJ
'Диссоциация ионов [Ag(NH3)2]+, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
к.. [Ag+ЦШ,]». 0 -8 [[Ag(NH3)2]+] -6'8'10
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул. В разбавленных растворах эти два различных выражения констант нестойкости совпадают друг с другом.
Из приведенной формулы видно, что чем меньше концентрация продуктов распада, т. е. чем устойчивее комплекс, тем меньше его константа нестойкости. Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости. Так, среди однотипных соединений
IAg{N02)2l~ [Ag(NH3)2l+ [Ag(S203)2]3" [Ag(GN)2J~
/Снест 1,3-Ю-3 6,8 • 10~8 ЫО-13 1 ■ 10~21
устойчивость комплекса возрастает при переходе от [Ag(N02)2]- к [Ag(CN)2]~. Ион [Ag(CN)2]~ настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду ничтожно малого значения произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра.
В последнее время для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчи» в ост и. Для иона [Ag(NH3)2] + константа устойчивости равна:
к 1 ^ [[Ag(NHa),][133]]
УСТ к „ест [Ag+] [NH3]2
До сих пор шла речь об общих константах нестойкости и устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например многоосновных кислот.
Так, в водном растворе K2[PtCl4] присутствуют в различных соотношениях все комплексы, участвующие в равновесиях:
[PtCl4r + H20 ^ [PtCl3H20]- + Cr [PtCI3H20]- + Н20 [PtCl2(H20)2] + сг
[PtCI2(H20)2] + Н20 [Pt(HsO)aCir + СГ
/Ci
[Pt(H20)3Cl]+ + H20 [Pt(H20)4]2+ + СГ
Каждое из этих равновесий характеризуется своей ступенчатой константой нестойкости /<4, Кз и т. д. По мере отщепления хлорид- ионов заряд комплекса становится все более положительным, а число ионов С1~ в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона [PtCl4]2- имеет место соотношение: Ка > Кг > К2 > К\.
Такое изменение в значениях последовательных констант нестойкости носит общий характер *. Значение общей константы нестойкости равно произведению всех ступенчатых констант.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2]+ Днест = 6,8-10~8, а для иона NH,+ /Снест = = 5,4-Ю-1; поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH^:
[Ag(NH3)2]++ 2Н+,=fc Ag+ + 2NHI
Комплекс же [Pt(NH3)4]2+ (К„ест = 5-10"34) не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
Процессы комилексообразования широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni2+, Со2+, Zn2+ дают устойчивые растворимые аммиакаты, а Al3+, Fe3+, Сг3+ менее склонны к комплексообра- зованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы для разделения анионов: так, можно осадить смесь хлоридов и иодидов в виде AgCl и Agl и далее обработать ее аммиаком— в раствор перейдет только AgCl, a Agl останется в осадке. Для того чтобы растворить Agl, нужно применить лиганд, связывающий ион Ag+ значительно прочнее, например CN-, так как для комплекса [Ag(CN)2]- Кнест = ЬЮ-21. В растворе KCN иодид серебра растворяется с образованием K[Ag(CN)2]: AgI + 2KCN —v K[Ag(CN)2]+KI
Константы устойчивости однотипных комплексов зависят от ряда факторов, и прежде всего от природы центрального атома и лигандов. В комплексах с центральными ионами, обладающими слабой поляризующей способностью, например с ионами щелочных и щелочноземельных металлов, устойчивость растет по мере увеличения интенсивности электростатического взаимодействия между центральным ионом и лигандами: чем больше заряды центрального иона и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Эти катионы образуют более устойчивые комплексы с лигандами, содержащими элементы малых периодов (кислород, азот) и с ионами F-.
Для другой большой группы комплексообразователей — катионов платиновых металлов, ионов Hg2+, Ag+, Au3+, у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и S.
208. Влияние координации на свойства лигандов и центрального атома. Взаимное влияние лигандов. Координация сопряжена с изменением электронной конфигурации лигандов и в результате приводит к изменению их свойств. Это хорошо видно на примере кислотно-основных свойств комплексных соединений. В то время как свободный аммиак обладает в водном растворе основными свойствами, комплекс [Pt(NH3)6]4+ проявляет свойства кислоты и вступает в обратимую реакцию со щелочью:
[Pt(NH3)e]4- + OH- [Pt(NH3)5NH2]3+ + H20
Причина изменения свойств аммиака заключается в том, что при его координации происходит смещение электронной плотности к положительно заряженному центральному атому. В результате эффективный отрицательный заряд атома азота в молекуле NH3 резко снижается, что и облегчает отщепление протона.
Аналогично ведут себя в поле катионов некоторых переходных металлов и другие полярные или легко поляризующиеся молекулы, способные проявлять протонодонорные свойства — Н2О, NH2OH, органические амины. Выступая в качестве лигандов, они способны к отщеплению протона в водных растворах и с точки зрения протонной теории кислот и оснований (стр. 237) ведут себя как кислоты. Например, взаимодействие гидратированного иона меди с водой следует записать так:
[Cu(H20)4]2++ Н20 [Cu(H2O)30H]++ Н30+
Это уравнение выражает процесс гидролиза иона меди. Таким образом, гидролиз катионов в водных растворах можно рассматривать как кислотную диссоциацию воды в аквакомплексах.
Если в комплексном соединении одновременно содержатся протоподонор- ная молекула лигаида (например, Н20, NH3) и молекула того же лиганда, отщепившая протон и способная, следовательно, к его присоединению (например, ОН", NH2), то такое комплексное соединение будет амфотерным. Так, комплекс [Pt(NH3)5NH2]3+ в реакции со щелочью ведет себя как кислота, а в реакции с кислотой — как основание:
[Pt(NH3)5NH2]3+ + ОН" [Pt(NH3)4 (NH2)2]2+ + Н20
кислота основание
lPt(NH3)6NH2]3++ Н30+ lPt(NH3)6]4++ Н20
основание кислота
Соединение, содержащее только депротонированные ионы (ОН", NHJ NH^O" и т. п.), является уже только основанием.
Основные положения теории кислотно-основных свойств комплексных соединений были разработаны А. А. Гринбергом [134].
Центральный ион также меняет свои свойства в результате ком- плексообразования, что можно видеть, например, по изменению соответствующего электродного потенциала. Так, стандартный электродный потенциал е° системы Fe3+/Fe2+ в водном растворе равен +0,771 В. Если же взять цианидные комплексы, содержащие железо в степени окисленности +2 и +3, то для системы [Fe(CN)6]3-/[Fe(CN)6]4- е° = +0,36 В, из чего следует, что эта система обладает более слабыми окислительными свойствами, чем система Fe2+/Fe3+. В данном, наиболее типичном случае переход
от гидратированных ионов к более устойчивым комплексам сопро- вождается преимущественной стабилизацией комплексного иона, содержащего центральный атом в высшей степени окисленности, вследствие чего окислительная способность этого иона ослабляется.
Кроме влияния комплексообразовання на свойства лигандов и центрального атома, существует и взаимное влияние лигандов в комплексах. Наиболее ярким его проявлением является транс-влияние, открытое И. И. Черняевым [135]. Суть этого явления заключается в том, что в комплексах, для которых возможны цис- и транс-изомеры, взаимное влияние лигандов наиболее сильно проявляется при их размещении в гране-положении по отношению друг к другу.
Некоторые лиганды (их называют транс-активными) ослабляют воздействие центрального атома па свойства лиганда, находящегося в грамс-положе- нни по отношению к рассматриваемому лигапду, и приближают их к свойствам свободного лиганда. Примером проявления граяс-влияния может служить получение изомерных диамминов платины(II). При нагревании тетраамми- нов платйны(Н) с концентрированной НС1 обычно получаются транс-изомеры, а при действии аммиака на K2[PtCl4] — ц«с-изомеры:
[Pt(NH3)4]Cl2 + 2НС1 —* [Pt(NH3)2Cl2] +2NH4C1
тра«с-изомер
K2[PtCl4] + 2NH3 —V [Pt(NH3)2CI2]+2KCl
^ас-изомер
Это объясняется большим транс-влиянием иона С1~ по сравнению с молекулой NH3, что и определяет наиболее лабильный лиганд (обведен) в промежуточно образующихся комплексах:
| [ |
CI NH3-1
Pt + NH3 NH3 CI J
rCl NH3-i Pt
| NH3j NH3" Pt NH3 CI. |
| + cr |
| CI i CI г Pt .CI NH3. |
| CI NH31 + NH3 —*■ I Pt l + Cr CI NH3J |
LCI NH,J
Кинетические характеристики реакций замещения также служат основанием для оценки транс-влияния лигандов. Лиганды, по их способности ускорять процесс замещения граяс-расположенного лиганда, располагаются в ряд CN", С2Н4, СО > N02". г, SCN" > Br" > СГ > ОН" > NH3 > Н20.
транс-Влияние установлено в основном при изучении комплексов Pt(II), но опо проявляется и в комплексах с центральными ионами Pt(IV), Со(III), Au(III), Pd(II), Rh(I). транс-Влияние является электронным эффектом и связано с изменением электронной плотпости. Одна из первых и наиболее наглядных попыток его объяснения была сделана на основе поляризационных представлений: лиганды с большим транс-влиянием имеют легко деформируемую электронную оболочку и являются хорошими восстановителями
(А. А. Гринберг, Б. В. Некрасов). В дальнейшем оказалось, что необходимо также учитывать и способность лиганда к л-акцепторному взаимодействию с центральным атомом.
А. А. Гринбергом и его школой было обнаружено, что кроме транс-влияния имеет место и цис-влияние лигандов, хотя этот вид взаимного влияния лигандов обычно проявляется в более слабой форме. Изменение свойств центрального атома и лигандов при комплексообразовании, а также существование транс- и цис-влияния лигандов полностью согласуется с теорией химического строения А. М. Бутлерова, учитывающей все виды взаимного влияния атома и групп атомов в молекулах (см. §§ 38 и 162),
Дата добавления: 2015-08-21; просмотров: 146 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основные типы и номенклатура комплексных соединений. | | | Глава ВТОРАЯ ГРУППА |