
Читайте также:
|
Экзаменационный билет №1
Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Найдите константу равновесия системы, в которой протекает процесс: 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+, если известно: j0(Fe3+/Fe2+) = +0,77 В; j0(Sn4+/Sn2+) = +0,15 В  Приведите процессы окисления, восстановления.
Приведите процессы окисления, восстановления.
Сравнивая величины стандартных окислительно-восстановительных потенциалов, видим, что Fe3+ — более сильный окислитель, чем Sn4+. Поэтому в системе будут идти следующие процессы:
Fe3+ + e– ® Fe2+ — восстановление
Sn2+ – 2e– ® Sn4+ — окисление
Суммарная схема процесса:
2Fe3+ + Sn2+ D 2Fe2+ + Sn4+
Вычисляем ЭДС.
E = j0(Fe3+/Fe2+) – j0(Sn4+/Sn2+) = 0,77 – 0,15 = 0,62 В.
Вычисляем константу равновесия.
lg K = nE / 0,059
n — наименьшее общее кратное чисел электронов в полуреакциях окисления и восстановления.
lg K = 2 · 0,62 / 0,059 = 21,0
K = 1021.
3. Определите изменение внутренней энергии системы при испарении 250 г воды при 290 К, допуская, что пары воды подчиняются законам идеальных газов. Удельная теплота парообразования воды при этой температуре составляет 2451 Дж/К
Изменение внутренней энергии ΔU = Q – W, где Q — теплота, подведенная к системе, W — работа.
Определяем теплоту испарения 0,250 кг воды.
Q = m · Lисп = 0,250 · 2451 = 612,75 кДж.
Испарение происходит при постоянном давлении, поэтому работа испарения равна:
W = p(V2 – V1)
V2 — объем газообразной фазы, V1 — объем жидкой фазы.
Объемом жидкой фазы пренебрегаем, так как объем жидкости при температурах, далеких от критической, значительно меньше объема пара.
Объем газообразной фазы определяем по закону идеального газообразного состояния:
V2 = nRT / p
Здесь T — нормальная температура кипения, равная для воды 373,15 К.
Найдем количество воды, учитывая молярную массу, равную 18,01 г/моль.
n = m(H2O) / M(H2O) = 250 / 18,01 = 13,88 моль.
W = pnRT / p = nRT = 13,88 · 8,314 · 373,15 = 43061 Дж = 43,06 кДж.
Изменение внутренней энергии:
ΔU = Q – W = 612,75 – 43,06 = 569,69 кДж.
Экзаменационный билет №2
1. Ковалентная химическая связь. Механизмы её образования, характеристика ковалентной связи.
2. Во сколько раз изменится (увеличится или уменьшится) скорость реакции при 298К, если применение катализатора изменяет энергию активации этой реакции на 4 кДж/моль?
Записываем уравнение Аррениуса для двух энергий активации.
K1 = Ae–E1/RT.
K2 = Ae–E2/RT.
E — энергия активации.
Находим отношение констант скоростей реакции
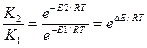
Логарифмируем полученное выражение:

 = 1,61
= 1,61
Находим отношение констант:
 = 5,03
= 5,03
Скорость реакции увеличится в 5 раз.
3. Возможно ли устойчивое существование оксидов: CuO; ZnO; SnO2 в атмосфере водорода? Ответ подтвердите термодинамическими расчётами соответствующих процессов
Запишем возможные процессы:
1) CuO(т) + H2(г) = Cu(т) + H2O(ж)
Вычисляем DG0, учитывая равенство нулю величины изобарно-изотермического потенциала для простых веществ.
DG0 = DG0(H2O, ж) – DG0(CuO, т) = –237,24 – (–129,4) = –107,84 кДж.
DG0 < 0, реакция идет в прямом направлении, устойчивое существование CuO в атмосфере водорода невозможно.
2) ZnO(т) + H2(г) = Zn(т) + H2O(ж)
DG0 = DG0(H2O, ж) – DG0(ZnO, т) = –237,24 – (–320,7) = 83,46 кДж.
DG0 > 0, реакция идет в обратном направлении, устойчивое существование ZnO в атмосфере водорода возможно.
3) SnO2(т) + 2H2(г) = Sn(т) + 2H2O(ж)
DG0 = 2DG0(H2O, ж) – DG0(SnO2, т) = 2 · (–237,24) – (–519,9) = 45,42 кДж.
DG0 > 0, реакция идет в обратном направлении, устойчивое существование SnO2 в атмосфере водорода возможно.
Дата добавления: 2015-10-30; просмотров: 132 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Эффект операционного рычага заключается в том, что любое изменение выручки от реализации всегда порождает более сильное изменение прибыли. | | | Ионная связь. Электроотрицательность элемента. Водородная связь. Межмолекулярные взаимодействия. |