
Читайте также:
|
2. Вычислить константу равновесия суммарной реакции, протекающей в гальваническом элементе 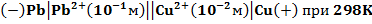
Запишем значения стандартных окислительно-восстановительных потенциалов.
E0(Pb2+/Pb) = –0,13 В
E0(Cu2+/Cu) = +0,34 В
Сравнивая значения потенциалов, делаем вывод о том, что свинцовый электрод — анод, а медный — катод.
Анодный процесс: Pb0 – 2e– ® Pb2+
Катодный процесс: Cu2+ + 2e– ® Cu0
Реакция в гальваническом элементе:
Pb + Cu2+ = Pb2+ + Cu
Рассчитываем ЭДС.
E = E0(Cu2+/Cu) – E0(Pb2+/Pb) = 0,34 – (–0,13) = 0,47 В.
Вычисляем константу равновесия.
lg K = nE / 0,059
n — наименьшее общее кратное чисел электронов в полуреакциях окисления и восстановления.
lg K = 2 · 0,47 / 0,059 = 15,93
K = 1015,93 = 8,55·1015.
3. Для атома углерода возможны два различных электронных состояний: 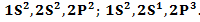 Назовите эти состояния атома. Как перейти от первого состояния ко второму? Как называется этот процесс?
Назовите эти состояния атома. Как перейти от первого состояния ко второму? Как называется этот процесс?
Электронное состояние атома 1s22s22p2 называется основным электронным состоянием.
Электронное состояние атома 1s22s12p3 называется возбужденным электронным состоянием.
Перейти от основного состояния к возбужденному можно, сообщив системе некоторое количество энергии. Это может быть нагревание, действие электромагнитного излучения, в том числе оптического или УФ-диапазона. Этот процесс называется возбуждением.
Экзаменационный билет №7
Условия самопроизвольного протекания и предела протекания процесса. Термодинамика фазовых переходов.
2. Привести схему гальванического элемента, работающего при электрохимической коррозии системы: Cr/Pb, в среде водного раствора H2SO4, записать процессы коррозии.
Запишем значения стандартных окислительно-восстановительных потенциалов.
E0(Pb2+/Pb) = –0,126 В
E0(Cr2+/Cr) = –0,913 В
E0(Cr2+/Cr) < E0(Pb2+/Pb), поэтому хром — анод, свинец — катод.
Схема элемента:
(–) Cr | Cr2+, H2SO4 | Pb (+)
Анодный процесс: Cr0 – 2e– ® Cr2+
Катодный процесс: 2H+ + 2e– ® H2
Уравнение процесса коррозии: Cr + H2SO4 = CrSO4 + H2
3. Сколько грамм HNO3(конц.) потребуется для растворения 6,35 г меди? К какому классу окислительно-восстановительных процессов относится данная реакция, привести процессы окисления, восстановления, уравнять суммарную реакцию
Запишем схемы полуреакций:
1| Cu – 2e– ® Cu2+ — окисление
2| NO3– + 2H+ + e– ® NO2 + H2O — восстановление
-------------------------------------------------------------------
Cu + 2NO3– + 4H+ ® Cu2+ + 2NO2 + 2H2O
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Это реакция межмолекулярного окисления-восстановления.
Найдем количество меди.
n(Cu) = m(Cu) / M(Cu) = 6,35 / 63,546 = 0,1 моль.
По уравнению видно, что для реакции потребуется 0,1 × 4 = 0,4 моль азотной кислоты.
M(HNO3) = 63,01 г/моль.
Вычисляем массу азотной кислоты.
m(HNO3) = M(HNO3) × n(HNO3) = 63,01 × 0,4 = 25,20 г.
Зав. кафедрой.
Дата добавления: 2015-10-30; просмотров: 423 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ионная связь. Электроотрицательность элемента. Водородная связь. Межмолекулярные взаимодействия. | | | Экзаменационный билет №8 |