
Читайте также:
|
2. При некоторой температуре равновесие в системе  установилось при следующих концентрациях:
установилось при следующих концентрациях: 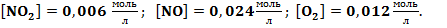 Найдите константу равновесия и исходную концентрацию
Найдите константу равновесия и исходную концентрацию
Схема равновесной системы:
2NO2 D 2NO + O2
[NO2] = 0,006 моль/л
[NO] = 0,024 моль/л
[O2] = 0,012 моль/л
Константа равновесия:
K =  = 0,192.
= 0,192.
Из уравнения видно, что на 1 моль NO2 приходится 1 моль NO.
Вычисляем исходную концентрацию NO2.
[NO2]0 = [NO2] + [NO] = 0,006 + 0,024 = 0,030 моль/л.
3. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен pH раствора, в который погружён анод, если катод погружён в раствор с pH = 3?
Потенциал водородного электрода равен E = 0,059pH.
Для катодного раствора Eкатод = 0,059 · 3 = 0,177 В.
ЭДС = Екатод – Еанод = 0,272 В
Еанод = ЭДС – Екатод = 0,272 – 0,177 = 0,095 В.
Для анодного раствора потенциал равен также равен 0,059pH.
Еанод = 0,059pH
pH = 0,095 / 0,059 = 1,61.
Таким образом, pH анодного раствора 1,61.
Схема элемента:
(–) Pt, H2 | 2H+ | H2, Pt (+)
Катод: 2H+ + 2e– ® H2
Анод: H2 – 2e– ® 2H+
Экзаменационный билет №16
Классификация окислительно-восстановительных процессов (на примерах). Условие самопроизвольного протекания и направленность этих процессов
2. Какое значение pH имеет раствор NaOH, если в 1 л этого раствора содержится 20 г NaOH?
NaOH — сильное основание, полностью диссоциирующее на ионы. Концентрация ионов OH– будет равна молярной концентрации NaOH, которую надо вычислить.
c(NaOH) =  = 0,5 моль/л.
= 0,5 моль/л.
[OH–] = c(NaOH) = 0,5 моль/л.
pOH = –lg [OH–] = –lg 0,5 = 0,30.
pH = 14 – pOH = 14 – 0,30 = 13,70.
3. Реакция CO(г) + Cl2(г) D COCl2(г) протекает при V, T – const; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остаётся 50% начального количества CO. Найдите давление равновесной газовой смеси, если до начала процесса давление составляет 100 кПа
Уравнение реакции:
CO(г) + Cl2(г) D COCl2(г)
Начальное давление смеси 100 кПа.
Пусть начальное количество CO и Cl2 равно 1 моль. Итого имеется 2 моль веществ.
К моменту равновесия осталось 50% начального количества CO, то есть осталось 0,5 моль CO. Такое же количество Cl2 осталось в системе, и 0,5 моль COCl2 образовалось. Общее количество смеси составит 1,5 моль.
Вычисляем давление равновесной смеси.
p = 100 × 1,5 / 2 = 75 кПа.
Дата добавления: 2015-10-30; просмотров: 192 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Какие микрогальванические пары работают при электрохимической коррозии стальной поверхности с включениями меди в атмосферных условиях (привести схему). Напишите процессы | | | Загадочный текст |