
|
Читайте также: |
Тиоцианметрлік әдіс күміс ионын тиоцианат ионымен тұндыруға негізделген:Ag+ + SCN- = AgSCN.Тиоцианат ерітіндісімен күміс немесе сынап ионы бар ерітіндіні титрлейді.Тиоцианметрлік титрлеуді Фольгард әдісімен жүргізеді. Бұл әдіс бойынша галоген ионы бар ерітіндіге күміс нитратының артық мөлшерін қосып, артық қалған күміс ионын тиоцианатпен титрлейді: CI- + Ag+ (артық) = AgCI + Ag+ (артық)
Ag+ (артық) + SCN- = AgSCNФольгард әдісінің индикаторы – (NH4)Fe(SO4)2·12H2O қаныққан ерітіндісі. Титрленетін ерітіндіде күміс ионы бар кезде тиоцианат ионы SCN- күміспен әрекеттесіп, AgSCN тұнбасын түзіп отырады. Ерітіндіде күміс ионы толық тұнбаға түскен соң, тиоцианат ионы индикатор құрамындағы темір ионымен Fe3+ әрекеттесіп қан қызыл комплекс түзеді [Fe(SCN)]2+. Демек, титрлеуді ерітіндінің түсі әлсіз қызыл болған кезде тоқтатады.Бұл әдіс аргентметрлеуге қарағанда көп қолданылады, өйткені қышқылдық ортада титрлеуге кесірін тигізбейді. Бұл әдіспен хлорды сілтілік ортада және қышқылдық ортада да анықтауға болады. Ерітіндіде бөгде Ва2+, Рb2+, Вi3+ және басқа иондар болса да титрлеуге болады. Алайда ерітіндіде тотықтырғыштар болмауы керек, себебі олар SCN- ионын ыдыратады. Егер зерттелетін ерітіндінің ортасы сілтілік болса, титрлеу алдында оны азот қышқылымен бейтараптайды. әйтпесе индикатор құрамындағы темір Fe3+ темір гидроксидін түзіп, Fe(ОН)3 тұнбаға түсуі мүмкін.Титрлеудің қателігін төмендету үшін бірнеше шаралар қолданылады:Индикатордың (Fe3+ ) максималды қажетті концентрациясын (0,2M) асырмайды.Өлшеуіш колбада зерттелетін ерітіндіге AgNO3 -ң стандартты ерітіндісінің белгілі көлемін дистелденген сумен белгісіне дейін келтіреді де, AgCl- дің құрғақ сүзгіш қағаз арқылы сүзіп, ерітіндіден аликвот алып, оны роданидтің стандартты ерітіндісімен титрлейді.Алынған мәліметтердің дәлдігі жоғары болады, бірақ сүзу үрдісі ұзақ уақыт қажет етеді.
Билет 17/1. Тотығу-тотықсыздану титрлеу әдістерінің теориялық негіздері: анықталатын заттар, жұмысшы ерітінділері, әдіс индикаторлары. Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әр түрлі тотықтырғыштардың және тотықсыздандырғыштардың ерітінділері пайдаланылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титриметрлік әдісте тек жылдам, қосымша реакцияға қатыспай, аяғына шейін, белгілі стехиометрлік жолмен жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады. Реакцияның толық жүрген-жүрмегенін тепе-теңдік тұрақтысы (Кт) мәнімен анықтауға болады. Сандық талдауда пайдаланылатын реакциялар үшін Кт ≥ 108 болу керек. Тотығу-тотықсыздану реакцияларының бағытын және олардың толық жүргенін анықтайтын мән Кт – реакцияға қатысатын жүйелердің стандартты тотығу-тотықсыздану потенциалдарының айырымына байланысты. 
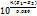 . Мунда, n - реакцияға қатысатын электрондар саны; Е1 мен Е2 – тотықтырғыштың және тотықсыздандырғыштың стандартты электродтық потенциалдары. Сондықтан реакцияны аяғына дейін жүргізу үшін потенциалдар айырымын арттыру керек. Ол үшін көп жағдайда тотығу-тотықсыздану потенциалдарына әсер ететін факторларды пайдалану қажет. Егер тотығу- тотықсыздану жұптарындағы жеке компоненттердің концентрацияларын өзгертсе, бұл жұптарға сәйкес потенциалдардың мәні де өзгереді, кейде реакцияның бағыты да өзгеруі мүмкін.Көптеген тотығу-тотықсыздану реакциялары баяу жүреді, олардың жылдамдығы титриметрлеуге қажетті жылдамдыққа сәйкес келмейді. Мұндай жағдайда реакцияны жылдамдату амалдарын жасау керек: 1.Қыздыру. Мысалы, сурьма (ІІІ) бромат-ионымен тұз қышқылы ортасында бөлме температурасында өте баяу тотығады. Егер температураны 70-80 оС-ге дейін көтерсе, реакцияның жылдамдығы жеткілікті мөлшерге дейін артады. Осыған байланысты сурьманы броматметрлік әдіспен анықтауға болады:
. Мунда, n - реакцияға қатысатын электрондар саны; Е1 мен Е2 – тотықтырғыштың және тотықсыздандырғыштың стандартты электродтық потенциалдары. Сондықтан реакцияны аяғына дейін жүргізу үшін потенциалдар айырымын арттыру керек. Ол үшін көп жағдайда тотығу-тотықсыздану потенциалдарына әсер ететін факторларды пайдалану қажет. Егер тотығу- тотықсыздану жұптарындағы жеке компоненттердің концентрацияларын өзгертсе, бұл жұптарға сәйкес потенциалдардың мәні де өзгереді, кейде реакцияның бағыты да өзгеруі мүмкін.Көптеген тотығу-тотықсыздану реакциялары баяу жүреді, олардың жылдамдығы титриметрлеуге қажетті жылдамдыққа сәйкес келмейді. Мұндай жағдайда реакцияны жылдамдату амалдарын жасау керек: 1.Қыздыру. Мысалы, сурьма (ІІІ) бромат-ионымен тұз қышқылы ортасында бөлме температурасында өте баяу тотығады. Егер температураны 70-80 оС-ге дейін көтерсе, реакцияның жылдамдығы жеткілікті мөлшерге дейін артады. Осыған байланысты сурьманы броматметрлік әдіспен анықтауға болады:
3Sb(III) + BrO3- + 6H+ = 3Sb(V) + Br- + 3H2O
2.Ерітіндінің қышқылдығын өзгерту. Мысалы, перманганатметрлік әдісте MnO4- ионының және дихроматметрлік әдісте Cr2O72- ионының қышқылдық ортада тотықтырғыш қасиеттерінің күшеюіне негізделген: MnO -4 + 8H+ + 5 е- --> Mn2++ 4H2O Cr 2O 72- + 14H+ + 6 е---> 2Cr3+ + 7H2O
3.Катализаторлар пайдалану. Қазіргі уақытта 50-ден артық тотығу-тотықсыздану әдістері белгілі. Олар көбінесе пайдаланылатын тотықтырғыштың атымен аталады. Мысалы, перманганатметрлеуде титрант ретінде KMnO4 ерітіндісі, дихроматметрлеуде – K2Cr2O7, иодметрлеуде – J2 мен Na2S2O3, броматметрлеуде – KB2O3, цериметрлеуде – Ce(SO4)2 ерітінділері пайдаланылады. Тотығу-тотықсыздану титрлеу әдісінде титрлеуді тікелей, кері, орынбасу титрлеу тәсілдерімен жүргізуге болады. Перманганатметрлік әдіс арқылы мор тұзындағы темір мөлшерін, табиғи судың тотығу қасиетін, тыңайтқыштағы кальций мөлшерін, сутегі пероксиді мөлшерін және т.б. анықтауға болады. Иодометрлік әдіс ауыл шаруашылығында табиғи судағы оттек мөлшерін, тотияйындағы мыс мөлшерін, нитриттерді анықтау үшін, ауыз суындағы бос хлордың мөлшерін анықтау үшін қолданылады.
Тотығу-тотықсыздану әдісінің екі түрлі индикаторлары белгілі:
1) титрлеуге қатысатын компоненттің біреуімен химиялық реакцияға түсетін ерекше индикаторлар; 2) жүйенің тотығу-тотықсыздану потенциалының өзгеруіне сезімтал тотығу- тотықсыздану индикаторлары. Ең ерекше индикаторлардың бірі крахмал болып есептеледі. Крахмал үш иодид ионымен (I3-) қою-көк түсті комплекс түзеді. Осы комплекстің пайда болуы, реакцияның нәтижесінде иодтың бөлінуі немесе жұмсалуына негізделген, титрлеудің соңғы нүктесін анықтауға мүмкіншілік береді. Тағы да бір ерекше индикатор - ол калий роданиді. Роданидтің қатысында темір (ІІІ) ионын титан (ІІІ) сульфатының ерітіндісімен титрлеуге болады. Титрлеудің соңғы нүктесі темір (ІІІ)-роданид комплексінің қызыл бояуының жойылуына сәйкес келеді. Титрант ретінде КМnО4 ерітіндісін пайдаланғанда индикатор рөлін титранттың өзі атқарады. Титрлеудің аяғына жеткенде, КМnО4-тің құйылған артық мөлшері ерітіндіні қызғылт түске бояйды. Тотығу-тотықсыздану индикаторлары – жүйеде белгілі тотығу- тотықсыздану потенциалы пайда болғанда, тотығып немесе тотықсызданып, түсін күрт өзгертетін заттар. Тотығу-тотықсыздану титрлеуін жүргізгенде, таңдап алынған индикатордың түсінің өзгерту аралығына сәйкес келетін потенциал титрлеу қисығының эквивалентті бөлігіне сәйкес келуі керек.
Билет 18/1. Тотығу-тотықсыздану титрлеу әдістерінің негіздері. Тотығу-тотықсыздану титрлеу әдістерін жіктеу және оны орындау әдістері. Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әр түрлі тотықтырғыштардың және тотықсыздандырғыштардың ерітінділері пайдаланылады. Қазіргі уақытта 50-ден артық тотығу-тотықсыздану әдістері белгілі. Олар көбінесе пайдаланылатын тотықтырғыштың атымен аталады. Мысалы, перманганатметрлеуде титрант ретінде KMnO4 ерітіндісі, дихроматметрлеуде – K2Cr2O7, иодметрлеуде – J2 мен Na2S2O3, броматметрлеуде – KB2O3, цериметрлеуде – Ce(SO4)2 ерітінділері пайдаланылады. Тотығу-тотықсыздану титрлеу әдісінде титрлеуді тікелей, кері, орынбасу титрлеу тәсілдерімен жүргізуге болады. Перманганатметрлік әдіс арқылы мор тұзындағы темір мөлшерін, табиғи судың тотығу қасиетін, тыңайтқыштағы кальций мөлшерін, сутегі пероксиді мөлшерін және т.б. анықтауға болады. Иодометрлік әдіс ауыл шаруашылығында табиғи судағы оттек мөлшерін, тотияйындағы мыс мөлшерін, нитриттерді анықтау үшін, ауыз суындағы бос хлордың мөлшерін анықтау үшін қолданылады. Перманганатметрлік әдіс деп жұмысшы ерітіндісі ретінде калий перманганаты ерітіндісі пайдаланылатын титриметрлік талдау әдісін айтады. Калий перманганаты (KMnO 4) қышқылдық, бейтарап және сілтілік ортада да тотықтырғыш қасиет көрсетеді. Оның тотықтырғыштық қасиеті қышқылдық ортада күшейе түседі: MnO 4 - + 8H + + 5е - = Mn +2 + 4H 2 O; Е 0 = +1,52 В Калий перманганаты эквивалентісінің молярлық массасы тотықтырғыш ретінде мынаған тең: М Э(KMnO4) = 158,04/5 = 31,6 г/моль. Перманганатметрлік әдіс арқылы тек тотықсыздандырғыштың ғана емес, сонымен қатар тотықтырғыштың да сандық мөлшерін анықтауға болады. Тотықсыздандырғыштарды калий перманганаты жұмысшы ерітіндісімен тікелей титрлеу арқылы анықтайды. Тотықтырғыштарды анықтауда кері титрлеу қолданылады: тотықтырғыш ерітіндісіне титрленген тотықсыздандырғыштың белгілі бір көлемін құйып, оның артық қалған мөлшерін калий перманганаты ерітіндісімен титрлейді.Калий перманганаты ерітіндісінің түсі қышқылдық ортада күлгін түсті, оның ерітіндісімен тотықсыздандырғыш ерітіндісін титрлегенде, перманганат ерітіндісінің түсі түссізденіп отырады. Әрекеттесуші зат калий перманганатымен түгел тотығып болған кезде, оның артық бір тамшысы ерітіндіні ақшыл қызғылт түске бояйды. Бұл көрсеткіш титрлеудің аяқталғанын көрсетеді. Яғни бұл әдіс индикатор қолдануды қажет етпейді (индикаторсыз титрлеу). Тотығу-тотықсыздану титрлеудің йодметрлеу әдісі йод немесейодидтердің қатысында жүретін тотығу-тотықсыздану реакцияларына негізделген әдістерді біріктіреді:I20 + 2e → 2I -.Осы реакцияның стандартты тотығыу-тотықсыздану потенциалы +0,54 В тең. Йодметрлеу әдісімен тотықсыздандырғыштың да, тотықтырғыштың да өлшерін анықтауға болады. Тотықсыздандырғыштарды анықтағанда, олардың стандартты тотығу-тотықсыздану потенциалы +0,54 В мәнінен кем, мысалы, натрий тиосульфатын, күкіртті сутек, күкіртті, күшән (мышьяк) қышқылдарын және оның тұздарын анықтағанда тура титрлеу әдісі қолданылады. Бұл тотықсыздандырғыштар йодпен әрекеттеседі. Титрант ретінде йод ерітіндісі, ал индикатор ретінде крахмал қолданылады. Тотықтырғыштарды анықтағанда, олардың стандартты электродтық потенциалы +0,54 В мәнінен үлкен, мысалы, калий перманганатын, калий дихроматын, хлорды, бромды, мыстың екі валентті тұздарын анықтағанда кері титрлеу әдісі қолданылады. Бұл тотықтырғыштар калий йодидінің ерітіндісімен әрекеттесіп, йодты бөліп шығарады. Негізгі жүмысшы ерітінділеріне калий йодиді және натрий тиосульфатының ерітінділері жатады. Индикатор ретінде крахмал ерітіндісі қолданылады. Крахмал әсерінен, тіпті бос йодтың азғантай мөлшері болса да, ерітінді көк түске боялады. Натрий тиосульфатының жұмысшы ерітіндісін калий перманганаты стандартты ерітіндісімен стандарттайды: 2KMnO4 + 10KI + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O...Иодты натрий тиосульфатының стандартталған ерітіндісімен титрлейді:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI Әдетте крахмалды титрлеу соңында, яғни ерітіндіде бос йодтын, мөлшері азайғанда құйған жөн. Себебі йод көп болса, ол крахмалмен әрекеттесіп тұрақты комплексті қосылыс түзіп, талдау дәлдігін кемітеді.
2.Комплексонометрлік титрлеуде титрлеудің соңғы нүктесін анықтау. Индикаторларға қойылатын талаптар. Комплексонометрлеу әдісінде титрант ретінде трилон Б ерітіндісіпайдаланылса, ол әдіс трилонметрлеу деп аталады. Комплексонометрлік титрлеу кезінде эквивалент нүктесін көбінесе органикалық бояғыш индикаторлар көмегімен анықтайды. Индикатор ретінде қара хромоген (қара эриохром Т), қышқылдық қою-көк хром, мурексид қолданылады. Олар органикалық бояғыш заттар, металлиндикаторлар тобына жатады. Бұл индикаторлар анықтайтын катиондармен суда жақсы еритін тұрақсыз комплексті қосылыстар түзеді. Трилон Б ерітіндісімен тиртлеу кезінде бұл қосылыстар бұзылып, бос күйінде индикатор бөлініп шығады. Нәтижесінде ерітіндінің түсі, индикатордың анықтайтын катиондармен түзген комплексті қосылыстардың түсінен ерекше, индикатор анионының түсіне айналады. Мысалы, қара хромоген мен қышқылдық қою-көк хром индикаторларының түрі көк түсті болса, олардың металл катиондарымен комплексті қосылыстарының түсі қызыл болады. Сондықтан эквиваленттік нүктеде ерітіндінің түсі қызыл түстен көк түске айналады. Неғұрлым комплексті қосылыс берігірек болса, солғұрлым анықтайтын катионның комплекстегі байланысы мықтырақ болады. Ең тұрақты комплексті қосылыстар сілтілік ортада түзіледі, сондықтан титрлеуді рН = 8 13 аралығында жүргізіледі. Титрлеу үрдісінде орта сілтілік болу үшін аммиакты буферлік ерітіндісін пайдаланады. Ол бөлінген Н + иондарын байланыстырып, ерітінді ортасын бірқалыпты ұстап тұрады. Карбонатты кермектікті судың белгілі бір көлемін, метилоранж индикаторы қатысында, HCI жұмысшы ерітіндісімен титрлеу арқылы анықтайды. Ал жалпы кермектікті комплексонметрлік титрлеу әдісімен анықтайды. Карбонатты емес кермектік жалпы кермектік (комплексонметрлік титрлеу әдісі) пен карбонатты кермектіктің (бейтараптау әдісі) айырымына тең.
Билет 19/1. Комплексонометрлік титрлеу әдісінің негізі. Комплекс түзу реакцияларына қойылатын талаптар. Маңызды комплексондар. Комплексті қосылыстарда сыртқы мен ішкі сфералар иондық байланыс арқылы байланысқан, ал комплекс түзуші ионмен лигандалар электровалентті (коваленттік, сутектік, координациялық) байланыстар арқылы қосылған.Сондықтан комплексті қосылыстың ішкі және сыртқы сфераларға ыдырауы күшті электролиттер диссоциациясы сияқты толық жүреді, ал ішкі сфераның ыдырауы әлсіз электролиттердің иондауына ұқсас, яғни бұл үрдіс қайтымды. Мысалы, K 4 [Fe(CN) 6 ] ішкі және сыртқы сфераларға ыдырауы күшті электролиттер тәрізді толық диссоциацияланады:K 4 [Fe(CN) 6 ] → 4K + + [Fe(CN) 6 ] 4-; [Fe(CN) 6 ] 4- ыдырауы қайтымды үрдіс; [Fe(CN)6] 4- → Fe 2+ + 6CN- ; Қайтымды үрдіс болғандықтан, әрекеттесуші массалар заңын пайдаланып, тепе-теңдік константасын жазуға болады, оны тұрақсыздық константасы д.а.
Кт = [Fe2+][CN-]6 / [[Fe(CN)6]4-] Тұрақсыздық константасының мәні неғұрлым жоғары болса, комплексті ион солғұрлым тұрақсыз болып, тез диссоциацияланады. Көп лигандты қосылыстардың иондану үрдісі сатыланып жүреді, әр сатысы өзіне тән, арнайы тұрақсыздық константасымен сипатталады. Комплексті қосылыстың тұрақсыздық константасына кері шама тұрақтылық константасы деп аталады. 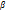 = I/ К Т
= I/ К Т
Анықтамаларда көбінесе тұрақсыздық, тұрақтылық константаларының орнына олардың көрсеткіштері пайдаланылады. рК = -lgK т = lg 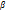 .
.
Маңызды комплексондар. Бұл әдіс металл катиондарының (тотығу дәрежелері 2-4 тең) комплексондеп аталатын реагенттермен, суда жақсы еритін, тұрақты ішкі комплекстіқосылыстар түзу реакциясына негізделген. Комплексондар – аминполикарбонқышқылдарының туындылары болып табылатын органикалық қосылыстартобы. Ең көп пайдаланылатын мына комплексондар: этилендиаминтетрасіркеқышқылы (ЭДТУ) – комлексон ІІ және оның екі натрий тұзы (ЭДТА), оныкомплексон ІІІ немесе трилон Б (қысқаша формуласы Na 2 H 2 У) деп атайды:
HOOCH2C – N – CH2 – CH2 – N – CH2COOH
NaOOCH2C CH2COONa
Билет 20/1. Физикалық-химиялық талдау әдістері, олардың жіктелуі, сипаттамасы. Физикалық-химиялық талдау әдістері (Ф.Х.Т.Ә.) деп заттың физикалық қасиеттерінің (жарықтың жұтылуы, жарықтың сынуы, электрөткізгіштік, жылуөткізгіштік және т.б.) оның химиялық құрамына тәуелділігіне негізделген әдістерді айтады. Талдаудың физикалық-химиялық әдістерінде заттың құрамын, химиялық реакция жүргенде, өзгеретін физикалық қасиеттерді құралдарда өлшеу арқылы анықтайды. Мысалы колориметрлік талдауда молекула немесе ионның сандық мөлшерін, боянды ерітіндінің өзінен өткен жарық шоғын сіңіру дәрежесіне байланысты, анықтайды. Талдаудың химиялық әдістеріне қарағанда физикалық-химиялық талдау әдістерінің артықшылықтары да және кемшіліктері де бар. Себебі олардың анықтау шегі анағұрлым аз (10-5 - 10-10 %), өте тез, талдауды қашықтықта (дистанциялық бақылау) жүргізуге, талдау үрдісін автоматтандыруға, ажырамайтын бақылау әдістерін қолдануға мүмкіндік береді (артықшылықтары). Сонымен қатар эталондар (салыстыру), стандартты ерітінділер және градуирленген графиктер қажет (кемшіліктері). Талданатын заттың жоғарғы концентрацияларында Ф.Х.Т.Ә. қателігі талдаудың химиялық әдістерімен пара-пар. Клиникалық биохимияда және ауылшаруашылық талдауларында оптикалық, электрохимиялық және хроматографиялық әдістер іс жүзінде көбірек қолданылады. Оптикалық әдістерге спектроскопия, фотометрия, люминисценция жатады. Электрохимиялық әдістерге потенциометрия, кондуктометрия, вольтамперометрия жатады. Хроматографиялық әдістерге газды, сұйықтық және ионалмасу хроматографиялары жатады.
| Анықталатын зат мөлшері | Сынаманың массасы, г |
| Макромөлшер Жартылай микромөлшер Микромөлшер Ультрамикромөлшер Субмикромөлшер | 0,05-0,5 г 0,01-0,05 г 0,1-10 мг 10-100 мкг <10 мкг |
Талдауды. оптикалы..дістері аны.талатын затты. оптикалы. к.рсеткіштерін: с.уле энергиясыны. с.улеленуін, сі.іруін ж.не ша.ылуын.лшеуге негізделген. Олар.а эмиссиялы. спектрлік талдау, фотометриялы. (колориметрия, спектрофотометрия, турбидиметрия, нефелометрия), рефрактометрия, поляриметрия, жалынны. фотометриясы, атомды.-адсорбциялы. ж.не люминесценттік.дістер, рентген спектрлік талдау, магниттік спектроскопия (ядролы. магниттік резонанс ж.не электронды. парамагниттік резонанс) жатады. Фотометрлеу физикалық-химиялық талдау әдістерінің жеке бір түріне жатады. Фотометрлік талдау әдісі зат молекулаларының кейбір жағдайларда белгілі бір толқын ұзындығы бар электромагниттік саулелерді сіңіруіне негізделген. Заттың жарық сіңіруі оның химиялық құрамына тәуелді. Фотометрлік талдау әдісі колориметрлік, фотоэлектрколориметрлік және спектрфотометрлік болып бөлінеді. Жарықтың сіңірілуі оптикалық тығыздықтың А (адсорбциялану) шамасынан көрінеді: A= l g I0 / I
мұнда:
А – оптикалық тығыздық;
I 0 – түскен жарықтың қарқындылығы;
I – ерітінді арқылы өткен жарықтың қарқындылығы.
Ерітіндінің оптикалық тығыздығының боянды компоненттің концентрациясы мен ерітінді қабат қалыңдығына тәуелділігі – жарық сіңірудің негізгі заңы (Бугер-Ламберт-Бер заңы) болып табылады: A= ε c l,,, мұнда: ε – жарық сіңірудің молярлық коэффициенті (С = 1 моль/л және l = 1 см болғанда, ε = A); С – боянды компоненттің концентрациясы, моль/л; l – ерітінді қабатының қалыңдығы, см. Оптикалық тығыздықты өлшегенде «нөлдік» және боянды ерітінділер арқылы өткен жарық ағынының қарқындылығын салыстырады. «Нөлдік» ерітіндіге, анықтайтын компоненттен басқа, стандартты және зерттелетін ерітінділердің құрамындағы барлық компоненттер кіреді. Фотоэлектрколориметрлеуде жарық сіңіру дәрежесін (түсінің қарқындылығын) фотоэлектроколориметр (ФЭК) аспабы арқылы анықтайды. ФЭК атқаратын қызметі, зерттелетін боянды заттар ерітінділері арқылы өткен жарық сәулесі әсерінен, фотоэлементте пайда болған электр тогын микроамперметрмен өлшеу болып табылады.
Билет 21/1. Бастапқы және жұмысшы ерітінділер және оларды дайындау тәсілдері. Бастапқы ерітіндіге қойылатын талаптар. Біріншілік стандартты ерітінділер немесе дайындалған ерітінділер немесе титрленген ерітінділер дегеніміз аналитикалық таразыда заттың нақты массасын өлшеп, өлшеуіш колбасында ерітіндісі дайындалған ерітінділер.Бұл ерітінділердің титрі мен конц/сы келесі формулалармен есептеледі: Т = m/V (г/мл) СЭ= M Э*1000/ T, моль/л
Титрленген ерітінділер дайындау үшін заттар келесі шарттарды қанағаттандыруы тиіс:
1) Құрамы химиялық формуласына сәйкес келуі тиіс; 2) Сақтағанда сұйық күйінде де қатты күйінде де тұрақты болуы тиіс; 3) Өлшеу қатесі аз болу үшін молекулалық массасы үлкен болуы тиіс; 4) Зат химиялық таза болуы керек; 5) Суда оңай еруі тиіс, ылғал тартпауы керек.
Осы шарттарды қанағаттандыратын, яғни біріншілік стандартты ерітінділер дайындайтын бастапқы заттарға Na2CO3, K2Cr2O7, Na2B4O7·Н2О - бура, Н2С2О4·2Н2О – қымыздық қышқылы, НООС-(СН2)2-СООН - янтарь қышқылы, С6Н5СООН – бензой қышқылы, КНС4Н4О6 – калийдің гидротартраты т.б. жатады. Екіншілік стандартты ерітінділер немесе титрант ерітіндісі немесе жұмысшы ерітінділер дегеніміз концентрациясы біріншілік стандартты ерітінділер көмегімен анықталған ерітінділер. Мысалы тотығу тотықсыздану әдісі былай бөлінеді: перманганатметрлеу әдісі – титрант ретінде КMnO4 ерітіндісі пайдаланылады; иодметрлеу әдісі – титрант ретінде І2 және Na2S2O3·5H2O ерітінділері пайдаланылады; Хроматметрлеу, дихроматметрлеу әдісі – титрант ретінде сәйкесінше К2CrO4, К2Cr2O7 ерітіндісі пайдаланылады; броматметрлеу әдісі – титрант ретінде КВrO3 ерітіндісі пайдаланылады; бромметрлеу әдісі – титрант ретінде КВr+КВrO3 қоспасының ерітіндісі пайдаланылады; ванадатметрлеу әдісі - титрант ретінде NH4VO3 ерітіндісі пайдаланылады; цериметрлеу әдісі - титрант ретінде Се(IV) тұздарының ерітінділері пайдаланылады.
2. Иодиметрлік және иодометрлік титрлеу әдісі, практикадақолданылуы. Тотығу-тотықсыздану титрлеудің йодметрлеу әдісі йод немесе йодидтердің қатысында жүретін тотығу-тотықсыздану реакцияларына негізделген әдістерді біріктіреді: I2 0+ 2 e → 2I-... Осы реакцияның стандартты тотығыу-тотықсыздану потенциалы +0,54 В тең. Йодметрлеу әдісімен тотықсыздандырғыштың да, тотықтырғыштың да мөлшерін анықтауға болады. Тотықсыздандырғыштарды анықтағанда, олардың стандартты тотығу-тотықсыздану потенциалы +0,54 В мәнінен кем, мысалы, натрий тиосульфатын, күкіртті сутек, күкіртті, күшән (мышьяк) қышқылдарын және оның тұздарын анықтағанда тура титрлеу әдісі қолданылады. Бұл тотықсыздандырғыштар йодпен әрекеттеседі. Титрант ретінде йод ерітіндісі, ал индикатор ретінде крахмал қолданылады. Тотықтырғыштарды анықтағанда, олардың стандартты электродтық потенциалы +0,54 В мәнінен үлкен, мысалы, калий перманганатын, калий дихроматын, хлорды, бромды, мыстың екі валентті тұздарын анықтағанда кері титрлеу әдісі қолданылады. Бұл тотықтырғыштар калий йодидінің ерітіндісімен әрекеттесіп, йодты бөліп шығарады. Негізгі жүмысшы ерітінділеріне калий йодиді және натрий тиосульфатының ерітінділері жатады. Индикатор ретінде крахмал ерітіндісі қолданылады. Крахмал әсерінен, тіпті бос йодтың азғантай мөлшері болса да, ерітінді көк түске боялады. Натрий тиосульфатының жұмысшы ерітіндісін калий перманганаты стандартты ерітіндісімен стандарттайды: 2KMnO4 + 10 KI + 8H2SO4= 5I2 + 2MnSO4 + 6K2SO4 + 8H2O Иодты натрий тиосульфатының стандартталған ерітіндісімен титрлейді: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
Әдетте крахмалды титрлеу соңында, яғни ерітіндіде бос йодтын, мөлшері азайғанда құйған жөн. Себебі йод көп болса, ол крахмалмен әрекеттесіп тұрақты комплексті қосылыс түзіп, талдау дәлдігін кемітеді.
Билет 22/1. Қышқылдық-негіздік титрлеу әдістерінде эквиваленттік нүктені анықтау тәсілдері. Индикаторлар теориясы. Қышқылдық-негіздік титрлеу әдісі сутек немесе гидроксоний иондарының гидроксил тобымен әрекеттесуіне негізделген: Н+ + ОН- ↔ Н2О немесе Н3О+ + ОН- ↔ 2Н2О (су ерітінділерінде), В + Н3О+ ↔ ВН+ + Н2О (органикалық ерітінділерде). Бұл әдіспен күшті қышқылдар мен негіздердің, әлсіз қышқылдар мен негіздердің, суда гидролизденетін тұздардың, органикалық қосылыстардың концентрацияларын анықтайды. Титрлеуде пайдаланылатын титранттың табиғатына байланысты қышқылдық-негіздік титрлеу әдісі екіге бөлінеді. Ацидиметрлеу – негіздерді сандық анықтау тәсілі. Титрант ретінде қышқылдар пайдаланады: HCl, H2SO4 т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде Na2CO3, Na2B4O7·Н2О т.б. пайдаланады. Бұл тәсілмен күшті және әлсіз негіздерді, негіздік тұздарды, әлсіз қышқылдардың тұздарын, тұз қоспаларын және органикалық аминдерді анықтайды. Алкалиметрлеу - қышқылдарды сандық анықтау тәсілі. Титрант ретінде сілтілер пайдаланады: NaOH, KOH т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде Н2С2О4·2Н2О, янтарь қышқылы НООС-(СН2)2-СООН, бензой қышқылы С6Н5СООН, калийдің гидротартраты КНС4Н4О6 т.б. пайдаланылады. Бұл тәсілмен әлсіз және күшті қышқылдарды, қышқыл тұздарды, әлсіз негіздердің тұздарын, органикалық қышқылдарды, фенолды т.б анықтайды. Қышқылдық-негіздік титрлеуді су және су емес (органикалық) ерітінділерде орындауға болады. Қышқылдық-негіздік титрлеуде тепе-теңдік канстантасының мәні К ≥ 108 тең болу тиіс. Бұл жағдайда титрленбей қалған қышқылдың немесе негіздердің массалық үлесі 0,01 %-ға тең болады. Бейтараптау тәсілінде индикаторларды Іnd дұрыс таңдау үшін сапалық көрсеткіштерімен қатар, сандақ сипаттамаларды (титрлеу қисықтарын, индикаторлық қателерді) есептей білу қажет. Титрлеу қисықтары қосылған титранттың көлеміне байланысты ерітінді рН-ының өзгеруін көрсетеді. Титрлеу қисығын тұрғызу үшін әртүрлі нүктедегі рН мәндерін есептейді: 1) бастапқы нүкте; 2) эквиваленттік нүктеге дейін; 3) эквиваленттік нүкте; 4) эквиваленттік нүктеден кейін.Титрлеудің соңғы нүктесін әртүрлі тәсілдермен анықтауға болады. Іс жүзінде жиі қолданылатын тәсілдердің бірі – индикаторлық тәсіл. Яғни, титрлеудің соңғы нүктесі индикатор түсінің өзгеруімен анықталады. Индикатор дегеніміз – эквиваленттік нүктеде немесе оған жақын нүктеде өзінің түсін өзгертетін әлсіз органикалық қышқылдар немесе негіздер. Индикаторды дұрыс таңдаған жағдайда, эквиваленттік нүкте титрлеудің соңғы нүктесіне сәйкес келеді. Қышқылдық-негіздік титрлеу әдісінде қышқылдық– негіздік немесе рН индикаторлар пайдаланылады, бұл индикаторлар ерітіндінің рН мәніне тәуелді түсін өзгертеді, мысалы: фенолфталеин, метил қызыл сарысы (метилоранж), лакмус, метилқызыл т.б. Индикаторларға қойылатын шарттар: 1.Индикаторлар эквиваленттік нүктеде немесе оған жақын нүктеде өзінің түсін өзгертуі тиіс, осы жағдайда титрлеу қатесі төмен болады.2.Индикатор титрантпен жоғары жылдамдықта әрекеттесуі тиіс.
Индикаторлар теориясы. Индикаторлардың сандық сипаттамалары
Индикаторларды сипаттайтын бірнеше теория бар: 1. Иондық теория немесе Оствальд теориясы. Бұл теория бойынша қышқылдық-негіздік титрлеуде пайдаланылатын индикаторлар ерітіндінің рН- ына байланысты өзінің түсін өзгертетін әлсіз органикалық қышқылдар немесе негіздер. Бұл тәсілде индикаторлардың молекула түрі мен ион түрінің түстерінде айырмашылық болады. Мысалы, индикатор лакмусты алсақ, қышқыл ортада түсі – қызыл (молекула түрі), сілтілік ортада түсі – көк (ион түрі). HInd + Н2О ↔ H3О+ + Ind-
2. Индикаторлардың хромофорлы теориясы. Қышқылдық-негіздік индикаторлардың, яғни органикалық қосылыстардың түстерінің болуы олардың құрамындағы белгілі топтардың болуына байланысты, бұл топтар хромофорлы топтар деп аталады. Хромофорлы топтарға: карбонил (>С=О), нитрозо (-N=O), азотобы (–N=N–), хиноид тобы () т.б. жатады. Органикалық қосылыстардың құрамында хромофорлардан басқа түстерін қанықтыра түсетін ауксохромдар болады. Ауксохромдарға: -NH2, -OH, -OCH3 т.б. жатады. 3. Қышқылдық-негіздік индикаторлардың ионды - хромофорлы теориясы. Бұл теория алғашқы екі теорияны біріктіреді. Индикатордың түсінің өзгеруі ерітіндінің рН байланысты. Иондық тепе-теңдіктің және оған сәйкес индикатордың құрылысының өзгеруімен анықталады. Индикатор түсінің ауысу интервалы. Индикатор түсі өзгеретін рН ауданды индикатор түсінің ауысу интервалы деп атайды. Индикатордың молекула және ионданған түрлерінің қатынасы немесе тең болғанда индикатор түсінің өзгергендігін адам көзбен байқауға болатындығы тәжірибе нәтижесінде анықталған. 1 Индикатордың титрлеу көрсеткіші. Индикатордың түсі шұғыл өзгеретін рН мәнін индикатордың титрлеу көрсеткіші деп атайды және рТ деп белгілейді. Индикаторлық қателер және оларды есептеу жолдары. Индикаторды дұрыс таңдау үшін титрлеу қисығын тұрғызады немесе титрлеудің индикаторлық қателігін есептейді. Индикаторлар өзінің түсін өзгертетін рН мәні эквиваленттік нүктеге сәйкес келе бермейді, осыған байланысты зерттелетін ерітінді кейде кішкене титрленбей қалады, кейде кішкене артық титрленеді, яғни біршама қателер кетеді. Индикаторлық қателерге әртүрлі факторлар әсер етеді (температура, концентрация, бөгде электролиттер, еріткіштің табиғаты, индикатордың концентрациясы, титрлек реті). Индикаторлық қателердің түрлері. 1. Сутектік қате. Титрлеу аяқталғанда ерітіндіде артық сутек иондарының болуымен анықталады. 2. Гидроксидтік қате. Титрлеу аяқталғанда ерітіндіде артық гидроксил иондарының болуымен сипатталады. 3. Қышқылдық қате. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз қышқыл молекулаларының болуымен анықталады. 4. Негіздік қате. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз негіз молекулаларының болуымен анықталады. Егер индикатор дұрыс таңдалған болса, онда индикаторлық қатені ескермеуге болады. Кез келген титрлеуде индикаторлық қатенің шамасы ±0,2 %-дан аспауы тиіс. Минус таңбасы қышқылдың немесе негіздің толық титрленбегенін көрсетеді.
Билет23/1.Титрлеу нәтижелеріне байланысты, ерітінділердің концентрациясы жұмысшы ерітіндінің және анықталатын заттың титрі арқылы өрнектеуді пайдаланатын есептеулер. Химиялық таза, сақтағанда тұрақты болып келетін заттарды бастапқы заттар деп атайды, ал олардың титрленген ерітінділерін даярланған дейді.Осындай заттардың титрленген ерітінділері арқылы басқа ерітінділердің титрін анықтауға болады. Ерітіндінің титрі ерітіндінің бір куб сантиметріндегі (бір миллилитріндегі) еріген заттың массасы. Титрді төмендегі формуламен есептеуге болады: Т = m/V. Ерітіндінің титрі белгілі болса, онда эквиваленттің молярлық концентрациясын есептеуге болады: C э = T *1000/ Mэ … Керісінше, эквиваленттің молярлық концентрациясы белгілі болса, оның титрінмына формуламен есептеуге болады: T = C э * Mэ / 1000. Tитриметрлік талдаудағы есептеулердің негізі эквивалент заңына сүйенген.Ерітіндідегі әрекеттесуші заттар үшін эквивалент заңы мына теңдеуменөрнектеледі: C Э 1 * V Э 1= Сэ 2 * V Э 2 Әрекеттесуші заттар ерітінділерінің біреуінің концентрациясы мен көлемі белгілі болса, осы теңдеуді пайдаланып екінші ерітіндінің концентрациясын анықтауға болады. Мысалы, СЭ 1 = Сэ 2 *V 2 / V1. Ерітіндідегі талданатын заттың массасын (г) анықтау үшін мына теңдеу қолданылады: m = C Э * М Э * V /1000... C Э және V – жұмысшы ерітіндісінің эквивалентісінің молярлық концентрациясы мен көлемі; М Э – анықтайтын зат эквивалентісінің молярлық массасы.Ал егер талдау барысында зерттелініп отырған ерітіндінің көлемін өлшеуіш колбада белгілі бір көлемге дейін сумен сұйылтса және титрлеуге оның қажетті аликвотты мөлшері алынатын болса, онда заттың массасын мына формула бойынша есептейді: m = C Э * М Э * V * V ө.к. / 1000 * V ал; мұнда: C Э және V – жұмысшы ерітіндісінің эквивалентісінің молярлық концентрациясы мен көлемі; М э – анықтайтын зат эквивалентісінің молярлық массасы, V ө.к. – өлшеуіш колбаның көлемі; V ал. – аликвоттың көлемі. Кері титрлеу әдісі бойынша есептеу: Талдайтын ерітіндіге (В) стандартты ерітіндінің (А) артық мөлшерін қосады, артық қалған А- ның мөлшерін басқа бір стандартты ерітіндімен (С) титрлейді. Мысалы, фольгард әдісімен СІ - ионының концентрациясын анықтау: CI - + AgNO 3 → AgCI ↓ + артық қалған AgNO3 ; артық қалған AgNO 3 + NH 4 SCN → AgSCN↓ + NH 4 NO3. Егер AgNO 3, NH 4 SCN ерітінділерінің эквивалентісінің молярлық концентрациялары және титрлеуге жұмсалған көлемдері белгілі болса, СІ -ионының мөлшерін былай табуға болады::  . Егер
. Егер  талдау барысында ерітіндінің көлемін өлшеуіш колбада белгілі бір көлемге дейін сумен сұйылтса және титрлеуге оның қажетті аликвотты мөлшері алынатын болса, онда заттың массасын мына формула бойынша есептейді:
талдау барысында ерітіндінің көлемін өлшеуіш колбада белгілі бір көлемге дейін сумен сұйылтса және титрлеуге оның қажетті аликвотты мөлшері алынатын болса, онда заттың массасын мына формула бойынша есептейді: 
2.Тотығу-тотықсыздану титрлеу әдісі. Бромо-, броматометриялық, нитритометриялық және цериметриялық титрлеу әдістері. Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әр түрлі тотықтырғыштардың және тотықсыздандырғыштардың ерітінділері пайдаланылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титриметрлік әдісте тек жылдам, қосымша реакцияға қатыспай, аяғына шейін, белгілі стехиометрлік жолмен
жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады.Реакцияның толық жүрген-жүрмегенін тепе-теңдік тұрақтысы(К т) мәнімен анықтауға болады. Сандық талдауда пайдаланылатын реакциялар үшін К т ≥ 10 8 болу керек. Тотығу-тотықсыздану реакцияларының бағытын және олардың толық жүргенін анықтайтын мән К т – реакцияға қатысатын жүйелердіңстандартты тотығу-тотықсыздану потенциалдарының айырымына байланысты. Қазіргі уақытта 50-ден артық тотығу-тотықсыздану әдістері белгілі. Олар көбінесе пайдаланылатын тотықтырғыштың атымен аталады. Мысалы, перманганатметрлеуде титрант ретінде KMnO4 ерітіндісі, дихроматметрлеуде– K2Cr2O7, иодметрлеуде – J 2 мен Na2S2O3, броматметрлеуде – KB2O3, цериметрлеуде – Ce(SO 4) 2 ерітінділері пайдаланылады.Тотығу-тотықсыздану титрлеу әдісінде титрлеуді тікелей, кері, орынбасутитрлеу тәсілдерімен жүргізуге болады.
Билет24/1. Перманганатометрия Әдістегі титрант пен стандартты ерітінділер. Перманганатпен қышқылдық және сілтілік ортада титрлеу. Перманганатметрлік әдіс деп жұмысшы ерітіндісі ретінде калий перманганаты ерітіндісі пайдаланылатын титриметрлік талдау әдісін айтады. Калий перманганаты (KMnO4) қышқылдық, бейтарап және сілтілік ортада да тотықтырғыш қасиет көрсетеді. Оның тотықтырғыштық қасиеті қышқылдық ортада күшейе түседі:
MnO4- + 8H+ + 5е- = Mn+2 + 4H2O; Е0 = +1,52 В Калий перманганаты эквивалентісінің молярлық массасы тотықтырғыш ретінде мынаған тең:
МЭ(KMnO) = 158,04/5 = 31,6 г/моль. Перманганатметрлік әдіс арқылы тек тотықсыздандырғыштың ғана емес, сонымен қатар тотықтырғыштың да сандық мөлшерін анықтауға болады. Тотықсыздандырғыштарды калий перманганаты жұмысшы ерітіндісімен тікелей титрлеу арқылы анықтайды. Тотықтырғыштарды анықтауда кері титрлеу қолданылады: тотықтырғыш ерітіндісіне титрленген тотықсыздандырғыштың белгілі бір көлемін құйып, оның артық қалған мөлшерін калий перманганаты ерітіндісімен титрлейді. Стандартты ерітінділері. Калий перманганаты ерітіндісі Калий перманганатының белгілі бір мөлшерін ерітіп, титрі нақты болатын ерітінді дайындауға болмайды, себебі оның құрамында, аздаған болса да, қосалқы бөлшектер кездеседі. Сонымен қатар, жаңа дайындалған калий перманганатының ерітіндісінің концентрациясы ауадағы әр түрлі заттардың (аммиак, органикалық заттар және тағы басқа тотықсыздандырғыштардың) әсерінен өзгеріп кетуі мүмкін. Сондықтан оның ерітіндісін алдын ала, титрін анықтаудан 7-10 күн бұрын дайындайды. Калий перманганатының ерітіндісін қараңғы жерде немесе күңгірт ыдыста сақтайды.
Қымыздық қышқылы ерітіндісі. Калий перманганаты ерітіндісінің титрін анықтау үшінтотықсыздандырғыштық қасиеті бар қымыздық қышқылын H 2C2O4 ·2H 2 Oнемесе оның тұздарын (натрий немесе калий оксалатын) пайдаланады.Қымыздық қышқылы қышқылдық ортада калий перманганатымен мынатеңдеу бойынша әрекеттеседі:5H 2C2O4 + 2KMnO 4 + 3H2SO 4 = 2MnSO4 + 10CO 2 + K2SO 4 + 8H2O
С2О4 2- анионы 2 электрон беріп жіберіп, екі бейтарап CO2 молекуласына айналады. Сондықтан тотықсыздандырғыш ретінде қымыздық қышқылы эквивалентісінің молярлық массасы мынаған тең: 
2. Өлшегіш ыдыстардың сыйымдылығын тексеру: колба, бюретка, пипетка. Өлшеуіш колбаның сыйымдылығын тексергенде, оны тазалап жуады,кептіреді және 0,01 г дәлдікпен технохимиялық таразыда өлшейді. Белгіге дейін колбаны дистилденген сумен толтырады да, тағы да технохимиялық таразымен өлшеп, колбадағы судың массасының айырмашылығын табады. Сосын судың температурасын, кестені қолдану арқылы тығыздығын тауып, колбаның нақты сыйымдылығын анықтайды. Мысалы: сыйымдылығы 250 мл өлшеуіш колбадағы судың массасы 250,06 г тең болып, судың температурасы 180С болса, оның тығыздығы 0,99756 г/см3 тең. Онда колбаның нақты сыйымдылығы: 250,06: 0,99756 = 25,76 мл болады. Бюретканың сыйымдылығын келесі тәсілмен тексереді. Тазалап жуылған бюретканы О деңгейіне дейін (температурасы шамамен өлшенген) сумен толтырылады. Бюксті алып (0,001 г дәлдікте бос өзін өлшеп алады, содан кейін бюреткадан 5 мл-ден су құйып алынып, қайта-қайта өлшенеді. Әрбір 5 мл судың массасын алынған температураға сай тығыздығына бөліп, сөйтіп бюретканың нақты сыйымдылығын табады. Пипетканың сыйымдылығын анықтау үшін, оны белгісіне дейін сумен толтырады, содан соң суды алдын-ала 0,001 г дәлдікпен өлшенген бюкске құяды және бюксті қайта өлшейді. Әрі қарай өлшеуіш колбаның сыйымдылығын анықтағандай түзетулер жасалынады. Мысалы: сыйымдылығы 25 мл пипеткаға судың 170С температурасындағы 24,920 г және тығыздығы 0,99774 г/см3 болса, сонда пипетканың нақты сыйымдылығы 24,920: 0,99774 = 24,98 мл-ге тең болады.
Билет25/1. Тиоцианатометриялық, меркурометриялық және сульфатометриялық титрлеу әдістері. Тиоцианметрлік әдіс күміс ионын тиоцианат ионымен тұндыруға негізделген: Ag+ + SCN- = AgSCN Тиоцианат ерітіндісімен күміс немесе сынап ионы бар ерітіндіні титрлейді. Тиоцианметрлік титрлеуді Фольгард әдісімен жүргізеді. Бұл әдіс бойынша галоген ионы бар ерітіндіге күміс нитратының артық мөлшерін қосып, артық қалған күміс ионын тиоцианатпен титрлейді: CI- + Ag+ (артық) = AgCI + Ag+ (артық) Ag+ (артық) + SCN- = AgSCN
Фольгард әдісінің индикаторы – (NH4)Fe(SO4)2·12H2O қаныққан ерітіндісі. Титрленетін ерітіндіде күміс ионы бар кезде тиоцианат ионы SCN- күміспен әрекеттесіп, AgSCN тұнбасын түзіп отырады. Ерітіндіде күміс ионы толық тұнбаға түскен соң, тиоцианат ионы индикатор құрамындағы темір ионымен Fe3+ әрекеттесіп қан қызыл комплекс түзеді [Fe(SCN)]2+. Демек, титрлеуді ерітіндінің түсі әлсіз қызыл болған кезде тоқтатады.
Бұл әдіс аргентметрлеуге қарағанда көп қолданылады, өйткені қышқылдық ортада титрлеуге кесірін тигізбейді. Бұл әдіспен хлорды сілтілік ортада және қышқылдық ортада да анықтауға болады. Ерітіндіде бөгде Ва2+, Рb2+, Вi3+ және басқа иондар болса да титрлеуге болады. Алайда ерітіндіде тотықтырғыштар болмауы керек, себебі олар SCN- ионын ыдыратады. Егер зерттелетін ерітіндінің ортасы сілтілік болса, титрлеу алдында оны азот қышқылымен бейтараптайды. әйтпесе индикатор құрамындағы темір Fe3+ темір гидроксидін түзіп, Fe(ОН)3 тұнбаға түсуі мүмкін Меркурометрлік титрлеу әдісі
Бұл титрлеу әдісі Cl-,Br-,I- сынап (І) нитратының ерітіндісімен тұндырып титрлеуге негізделген:2Сl- + Hg22+ →Hg2Cl2Индикатор ретінде темір (ІІІ) тиоцианатының немесе дифенилкарбазон ерітіндісін пайдаланады.Анализ нәтижелері дұрыс болуы үшін бақылау тәжірибе жасау керек. Бұл жағдайда титрлеу қателігін ескеру үшін индикатормен әрекеттескен титранттың көлемінен алып тастау қажет.Индик. ретінде дифенилкарбазонның 1-2% спирт ерітіндісінің 2-3 тамшысы пайд. Индикаторды титрлеудің аяқталуы жақындағанда қосады. Эквиваленттік нүктеде Hg22+ иондарының дифенилкарбазонмен әрекеттесу нәтижесінде көк түсті тұнба түзіледі.Аргентометрлік әдіске қарағанда кейбір артықшылықтары.1.Оның сезгіштігі жоғары 2.Титрлеуді қышқылдық ортада тура титрлеу әдісімен орындауға болады. 3.Сонымен сынап (І) нитратына қарағанда арзан препаратБірақ сынап(І) тұздары улы, сондықтан бұл әдісті пайдаланғанда қауіпсіздік ережелерін сақтап, өте ұқыпты болу қажет. Сульфатометрлік титрлеу әдісі. Бұл титрлеу әдісін Ba-ді H2SO4-ң стандартты ерітіндісімен титрлеуде пайдаланады: Ba2+ +H2SO4↔BaSO4↓+2H+...Титрлеуде қолданылатын H2SO4 ерітіндісі Na2B 4O7 немесе Na2CO3ерітінділерімен стандартталады, ал Ba тұздарының ерітінділері H2SO4 ерітіндісі арқылы стандартталады.Нитрохромазо және ортанил А бос күйінде қызғылт түсті Ba-мен күлгін түсті комплексті қосылыс түзеді, кері титрлеуде күлгін түстен қызғылт түске айналады.Сонымен қатар титрлеудің соңғы нүктесін анықтау үшін S қызыл ализаринді де пайдаланады.
Дата добавления: 2015-10-30; просмотров: 1169 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ышқыл-негіздік индикаторлар. Индикатордың ауысу интервалы. Индикатор таңдау. | | | Жалпы медицина» 2 курс 2014 – 2015 оқу жылы. |