
Читайте также:
|
Конспект лекций по курсу
«Физико-химические основы технологии редких элементов»
Предназначен для студентов очной формы обучения по специальности 240601 «Химическая технология материалов современной энергетики»
Модуль 2: «Пирометаллургические процессы в технологии производства редких, рассеянных и радиоактивных элементов»
Екатеринбург
УДК 669.2/.8.001(075.8)
Авторы – А.Р.Бекетов, В.Н. Рычков, В.А.Иванов, А.В.Щетинский
Научный редактор – проф., д-р тех. наук, С.П. Распопин
Физико-химические основы технологии редких элементов: Конспект лекций. Модуль 2 «Пирометаллургические процессы в технологии производства редких, рассеянных и радиоактивных элементов»/ А.Р.Бекетов, В.Н. Рычков, В.А.Иванов, А.В.Щетинский. Екатеринбург: ГОУ ВПО УГТУ-УПИ, 2008. 54 с.
В предлагаемом конспекте представлен материал лекций по курсу «Физико-химические основы технологии редких элементов». В отдельных разделах конспекта рассмотрены способы изучения физико-химических свойства редких элементов. Приведены данные по физико-химическим свойствам соединений редких элементов, нашедших наиболее широкое применение. Описаны технологии получения и характерные особенности процессов с участием редких элементов. Рассмотрены способы рафинирования и методы получения особо чистых веществ. При изложении курса особое внимание уделено аппаратурному оформлению процессов.
Во второй раздел конспекта лекций включено три главы. В первой из них приводятся данные по системам уран-кислород и уран углерод с подробным анализом процессов восстановления окислов урана. Вторая глава посвящена металлотермическому способу получения редких металлов в чистом виде, третья – плавке металлов в вакууме.
Конспект предназначен для студентов старших курсов, обучающихся по специальности 240601 – «Химическая технология материалов современной энергетики».
Рис. 16, табл. 15.
© ГОУ ВПО «Уральский государственный технический университет – УПИ имени первого Президента России Б.Н. Ельцина», 2008
© А.Р.Бекетов, В.Н. Рычков, В.А.Иванов, А.В.Щетинский. 2008
Конспект лекций подготовлен в рамках выполнения Инновационной образовательной программы.
Содержание
1. ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ПРОЦЕССОВ ДИССОЦИАЦИИ И ВОССТАНОВЛЕНИЯ ОКИСЛОВ УРАНА.. 5
1.1. Система уран – кислород. 5
1.1.1. UO2 – двуокись урана. 7
1.1.2. U4O9 8
1.1.3. Тетрагональная фаза (U3O7) 9
1.1.4. U3O8 – закись-окись урана. 9
1.1.5. UO3 – трехокись урана. 9
1.2. Фазовые соотношения в системе уран-кислород. 9
1.2.1. U – UO2 10
1.2.2. UO2 – UO2,25 10
1.2.3. UO2,25 – UO2,67 10
1.2.4. UO2,67 – UO3 12
1.3. Диссоциация окислов урана. 13
1.4. Восстановление окислов урана окисью углерода. 17
1.4.1. Восстановление трехокиси урана. 18
1.4.2. Восстановление закиси – окиси урана. 20
1.4.3. Восстановление U4O9 21
1.4.4. Восстановление двуокиси урана (UO2). 21
1.5. Восстановление окислов урана водородом. 22
1.6. Углетермическое восстановление двуокиси урана. 23
2.ОСНОВЫ МЕТАЛЛОТЕРМИИ.. 28
2.1. Термодинамические основы металлотермического восстановления. 28
2.2. Механизм металлотермического восстановления. 35
2.3. Роль побочных реакций образования шлаков. 38
2.4. Металлотермическое восстановление двуокиси урана. 38
3.ТЕРЕТИЧЕСКИЕ ОСНОВЫ ПЛАВКИ МЕТАЛЛОВ В ВАКУУМЕ.. 42
3.1. Растворимость газов в металлах. 42
3.1.1. Двухатомные газы.. 42
3.1.2. Сложные газы.. 45
3.2. Сведения о растворимости газов в металлах. 47
3.3. Значение вакуумной плавки в технике. 48
3.4. Физико – химические процессы при плавке металла в вакууме. 50
Рекомендуемая литература: 54
ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ПРОЦЕССОВ ДИССОЦИАЦИИ И ВОССТАНОВЛЕНИЯ ОКИСЛОВ УРАНА
1.1. Система уран – кислород
Отличительной особенностью актинидных элементов является их способность образовывать большие количества фаз постоянного и переменного состава. В этом отношении уникальной по сложности является система уран – кислород.
В литературе имеются указания о существовании следующих окислов урана: UO3, U3O8, U2O5, U5O13, U3O7, U7O16, U4O9, UO2, UO.
Макаровым Е. С. Высказано предположение о существовании гомологического ряда окислов урана, описываемого общей формулой
UnO2n+2,
где n – целое число. Все восемь начальных гомологов этого ряда реально существуют в виде окислов.
Однако из всех перечисленных выше окислов только три: UO3, U3O8, UO2 имеют большое практическое значение и известны уже больше ста лет. Что касается остальных окислов, то хотя существование некоторых из них и не вызывает сомнения, в то же время недостаточно изучены их структура и валентные состояния урана.
В дальнейшем остановимся на характеристике лишь некоторых наиболее изученных соединений урана с кислородом. Обзор начнем с соединения, отвечающего его низшей степени окисления – моноокиси урана. Но прежде всего несколько слов об уране. Металлический уран в твердом состоянии существует в виде трех модификаций: Ua, Ub, Ug. Температуры фазового равновесия имеют следующие значения:
Тαβ = 940 0К (667 0С)
Тβγ = 1045 0К (772 0С)
Тγж = 1406 0К (1133 0С)
Кислород незначительно растворяется в металлическом уране. Изменение растворимости кислорода с температурой показано на рис. 1. Из этого рисунка видно, что даже в жидком уране растворимость кислорода незначительна: при температуре плавления урана, т.е. при 1133°С она составляет 0,003% (вес), а при 2000°С –
0,03% (вес). Растворимость кислорода в твердом уране изучена слабо. Известно только, что она меньше растворимости в жидкой фазе.
Из рис. 1. Следует также, что растворимость кислорода в жидком уране возрастает с повышением температуры. А это означает, что суммарный процесс растворения является эндотермическим процессом. Следовательно, при растворении кислорода в уране должна иметь место такая стадия, на осуществление которой затрачивается определенное количество тепла. Такой стадией является диссоциация молекулы кислорода на атомы, протекающая на поверхности металла. Поэтому в металлическом уране кислород находится не в молекулярной, а в атомарной форме.
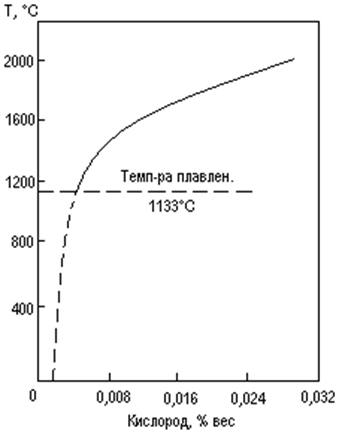
Рис. 1
UO – моноокись урана. О существовании моноокиси урана впервые было сообщено в 1948 г., когда ее обнаружили в виде тонкого поверхностного слоя на металлическом уране. В небольших количествах она была получена несколько позднее. Моноокись урана имеет кубическую решетку (типа NaCl) с параметром а = 4,91Å. Эта структура отличается от структуры металлического урана в любой из трех его модификаций. В то же время она очень сходна со структурой мононитрида UN (а=4,880±0,001Å) и монокарбида UC (а=4,951±0,001Å).
Соединения UO, UN, UC легко образуют смешанные кристаллы, т.е. являются изоморфными.
Трудность получения моноокиси урана в значительных количествах, по-видимому, обусловлена следующими причинами:
1. в чистом виде это соединение устойчиво лишь при повышенных температурах (выше 1200 К);
2. термодинамически моноокись устойчива против диспропорционирования только в присутствии монокарбида и мононитрида. Поэтому все попытки получить UO свободную от азота и углерода оказались неудачными.
Моноокись урана – хрупкое вещество серого цвета с металлическим блеском. Рентгеновская плотность ее равна 14,2 г/см3. Приращение теплосодержания ∆Н при образовании моноокиси из элементов оценивается в - 129 ккал/моль (наиболее вероятное значение). Изменение изобарного потенциала ∆Z°298 = - 123 ккал/моль.
Дата добавления: 2015-10-28; просмотров: 134 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Оценка фактов и событий | | | UO2 – двуокись урана |