
Читайте также:
|
2.1. Термодинамические основы металлотермического восстановления
Металлотермический способ получения металлов основан на восстановлении химических соединений (окислов, солей) металлами, обладающими более высоким химическим сродством, чем получаемый металл к элементам, входящим в состав соединений.
Этот метод получил широкое распространение в металлургии для получения в чистом виде ряда редких металлов (Ti, Zr, Ta и др.), легких металлов(Rb, Cs, Mg, Ba), а также металлических сплавов (особенно с железом и алюминием). Он служит основной крупной отрасли металлургии – производства ферросплавов, а также используется в пиротехнике и др.
Первые исследования по вытеснению металлов из химических соединений (окислов, галоидных солей) другими металлами были проведены русскими ученым профессором Н.Н. Бекетовым в 1850 – 1860 гг.
Свои исследования он обобщил в труде «Исследования над явлениями вытеснения одних элементов другими» в 1865 году. Существенный вклад в развитие теории и практики металлотермического процесса был сделан школой Н.С. Курнакова, особенно его учеником, выдающимся русским ученым С.Ф. Жемчужным (1873 – 1929 гг).
Ряд работ по металлотермии был выполнен также В.А. Боголюбовым, С.А. Погодиным, В.П. Елютиным, Н.Н. Мурачем, В.П. Батраковым и др.
В общем виде реакция металлотермического восстановления может быть выражена следующим уравнением:
MeX + Me’ = Me’X + Me (1)
где Ме – восстанавливаемый металл;
X – кислород, сера, хлор, фтор и т.п.;
Ме′ - металл – восстановитель.
Уравнение этой реакции может быть получено путем комбинирования двух следующих уравнений:
а) Ме + Х = МеХ
б) Ме’ + Х = Ме’Х
Вычитая из уравнения (б) почленно уравнение (а), получаем уравнение (1). Примем следующие обозначения:
∆Z0(a) – стандартное изменение изобарного потенциала для реакции (а);
∆Z0(б) – то же самое для реакции (б);
∆Z0 – стандартное изменение изобарного потенциала для реакции металлотермического восстановления.
Тогда на основании закона, аналогичного закону Гесса, имеем:

Для того, чтобы реакция (1) протекала слева направо, необходимо, чтобы
∆Z0 < 0, а это возможно тогда, когда ∆Z0(б) < ∆Z0(a).
Известно, что для реакции образования окислов и сульфидов ∆Z0 величина отрицательная. Причем, чем больше абсолютное значение ∆Z0, тем больше сродство металла к элементу (кислороду, сере). Применим к рассматриваемой системе правило фаз:
f = K – P + 1; K = 3, P = 4, f = 0.
Т. е. система является нонвариантной (система не имеет ни одной степени свободы). Равновесие по этой реакции, т.е. одновременное сосуществование всех четырех фаз возможно только в точке, в частности, при одной вполне определенной температуре.
Эту температуру можно определить графически, если в координатах ∆Z0 и Т построить кривые зависимости ∆Z0(a) и ∆Z0(б) (рис. 8). Точка пересечения этих кривых (точка а) и дает температуру, при которой устойчивы все четыре фазы. Затем из этого рисунка видно, что при температуре ниже Т1, ∆Z0 = ∆Z0(б) - ∆Z0(a) >0, и реакция протекает в обратном направлении. При температурах ниже Т > Т1, ∆Z0 = ∆Z0(б) - ∆Z0(a) < 0 и реакция протекает в нужном направлении. Следовательно, восстановление металла Ме с помощью Ме′ в данном случае возможно при температурах выше Т1.

Рис. 8
На рис. 9 представлен несколько иной случай. В данном случае во всем взятом интервале температур ∆Z0(a) > ∆Z0(б) и поэтому во всем этом интервале возможно металлотермическое восстановление Ме.
При построении кривых зависимостей ∆Z0 от температуры, мы не учитывали до сих пор возможности фазовых превращений металла или химического соединения (окисла, сульфида и т.д.).

Рис. 9
В точках плавления, кипения или аллотропического перехода металла или химического соединения эти прямые претерпевают излом и приобретают иной наклон. Угловой коэффициент каждого участка прямой, как это следует из уравнения:

равен отрицательному значению изменения энтропии. Для процесса
MeX + X = MeX

Из физической химии известно, что энтропия есть мера беспорядка в системе. В твердом теле имеется наибольший порядок в расположении частиц, поэтому энтропия для него имеет наименьшее значение.
В жидком теле имеет место лишь ближний порядок в расположении частиц. Энтропия жидкого тела больше, чем твердого. В газообразном состоянии имеется полный беспорядок в расположении частиц. Поэтому в этом состоянии вещество имеет наибольшее значение энтропии. Т.е. для одного и того же вещества существует следующее соотношение:
Sгаз > Sжид > Sтв
Что касается энтропии различных модификаций твердого тела, то они мало отличаются друг от друга. Поэтому в точках полиморфных превращений излом кривой ∆Z0 мало заметен. При изменении же агрегатных состояний наблюдаются следующие закономерности.
При фазовом превращении металла (∆S = SMEX – SMe – Sx уменьшается, следовательно - ∆S возрастает) кривая изгибается вверх (рис. 10). При фазовом же превращении химического соединения (окисла, сульфида) кривая изгибается вниз
(рис. 11). Эти перегибы круче всего в точках кипения, вследствие резкого изменения энтропии.
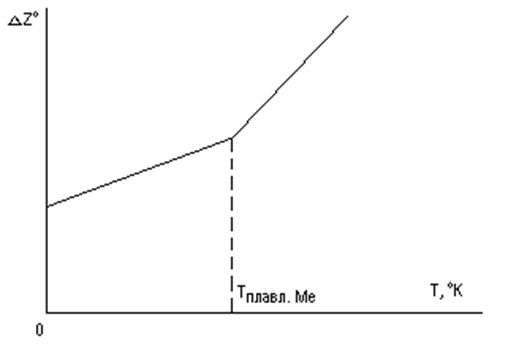
Рис. 10

Рис. 11
Наконец, необходимо иметь в виду, что величиной ∆Z0 можно пользоваться только тогда, когда процесс протекает в стандартных условиях. Если же система находится в нестандартных условиях, то нужно пользоваться значением ∆Z, которое подсчитывается по уравнению:

но

поэтому
 (2)
(2)
Второе слагаемое в правой части уравнения (2) представляет поправку на начальные активности реагентов. Эта поправка имеет большое значение в том случае, если один или два участника реакции (металл и окисел в реакции окисления металла) присутствуют в газообразном состоянии. Для реакции окисления типа:
Me + O2 (1 an) = MeO2
поправка на начальные активности участников реакции в общем виде выразится следующим образом

причем активности концентрированных фаз равны единице, активности же газов равны парциальным давлениям (при общем давлении Р < 10 ат).Рассмотрим два следующих случая:
а) газообразен только окисел металла:

б) газообразен только металл:

Пользуясь этими уравнениями, можно показать как будет смешаться кривая зависимости изменения изобарного потенциала от температуры при учете начальных активностей компонентов по сравнению с кривой стандартного изменения изобарного потенциала. Направление смешения видно из следующей таблицы:
Таблица 10
| Величина исходного парциального давления | Газообразный участник реакции | |
| Металл | Окисел | |
| Р > 1 ат | Кривая смещается вниз | Кривая смещается вверх |
| Р < 1 ат | Кривая смещается вверх | Кривая смещается вниз |
Для окислов, образование которых сопровождается большими тепловыми эффектами, т.е. большими приращениями теплосодержания, удобно полагать приближенной мерой прочности окисла абсолютное значение приращения теплосодержания (∆Н). Наибольшим изменением теплосодержания сопровождается образование окислов кальция, магния, алюминия, натрия, кремния, циркония и бора. Перечисленные элементы, кроме двух последних, используются для осуществления металлотермических реакций. Выбор восстановителя обусловлен не только указанными выше термодинамическими свойствами, но также его летучестью, которая при проведении металлотермического процесса при атмосферном давлении должна быть минимальной. При использовании низкокипящих восстановителей процесс восстановления часто приходится проводить под повышенным давлением, создаваемым аргоном или другими инертными газами. В некоторых случаях в качестве восстановителей используются не металлы, а их гидриды, т.е. соединения Ме′zНр. Реакция восстановления в этом случае может быть отображена следующим уравнением:
MexOy + Me’zHp = x Me + Me’zOy-p/2 + p/2 H2O
Избыток гидрида может разлагаться с выделением водорода, который создает восстановительную атмосферу, а в ряде случаев может вступать во взаимодействие с МехОу, будучи еще в активном состоянии. Этим методом могут получаться и гидриды металлов, разлагающиеся при нагревании с выделением водорода и образованием тонкого металлического порошка.
Для успешного протекания металлотермического процесса необходима определенная разность теплот образования исходного окисла и окисла металла восстановителя, т.е. определенный тепловой эффект реакции восстановления. Этого тепла должно быть достаточно для расплавления компонентов шихты и в большей части металлотермических процессов также расплавления получаемого металла или сплава.
Таким образом, для проведения реакции необходимо, чтобы на единицу веса шихты приходилось некоторое определенное количества тепла. Оно называется термичностью процесса. Термичность процесса максимальна при стехиометрическом соотношении компонентов (МеО и Ме′). При избытке любого из компонентов термичность процесса снижается за счет расхода тепла на нагрев и расплавление избытка вещества, не участвующего в реакции. Сказанное можно проиллюстрировать следующим рисунком (рис. 12).

Рис. 12
Согласно С.Ф. Жемчужному, для нормального течения алюмотермических реакций в небольших масштабов (порядка 0,5 кг) необходимо, чтобы термичность была не ниже 550 кал/г.
Н.Н. Мурачом с сотрудниками выполнен ряд работ по исследованию алюмо- и силикотермии, которые позволили им сделать следующие выводы:
1. Все металлотермические реакции, в зависимости от тепловых факторов, могут быть подразделены на четыре группы:
a. вяло - термичные, часто протекающие без образования раздельных слоев металла и шлака,
b. спокойно термичные, наиболее удобные на практике,
c. бурно термичные, протекающие в течение короткого времени при высокой температуре,
d. взрывного типа, часто сопровождающиеся выбросом шихты.
2. Между величиной теплоты образования восстанавливаемого окисла и величиной минимально необходимой термичностью существует полуэмперическая экспоненциальная зависимость, которая может быть выражена формулой

где QMeO – теплота образования восстанавливаемого окисла, ккал/моль,
Т – термичность в кал/г восстанавливаемого окисла, а в случае замедлителей, которые Мурач называет нейтральной добавками, на 1 г суммы весов восстанавливаемого окисла и замедлителя.
Таблица 11 – Расчетная термичность восстановления алюминием некоторых окислов (при стехиометрическом соотношении компонентов)
| Окисел | Термичность, кал/г | Окисел | Термичность, кал/г | Окисел | Термичность, кал/г |
| TiO2 | Cr2O3 | Fe2O3 | |||
| Ta2O5 | WO3 | CuO | |||
| ZrO2 | NiO | MoO3 | |||
| Nb2O5 | V2O5 | Mn2O3 |
Для металлов IV группы периодической системы, обладающих способностью образовывать прочные низшие окислы (типа МеО), дающих твердые растворы с металлами, выше приведенное уравнение принимает вид:

Величина минимально необходимой термичности, кроме теплового эффекта реакции и абсолютного веса шихты, зависит также от ряда дополнительных факторов: величины частиц реагирующих компонентов, степени окисленности восстанавливаемого металла, качества смешения шихты, относительной поверхности теплоотдачи реагирующей шихты.
Поэтому показатель термичности 550 кал/г, установленный Жемчужным, не является абсолютным и изменялся в связи с указанными факторами, особенно в сторону увеличения.
2.2. Механизм металлотермического восстановления
При металлотермическом восстановлении смесь восстанавливаемого окисла и порошка-восстановителя поджигается или подогревается специальными возбудителями, например смесью магния и селитры. В результате этого расплавляются или все компоненты шихты, или один восстановитель, что приводит к началу реакции восстановления в данной точке.
За счёт тепла выделяемого этой реакцией возбуждается реакция в соседней точке и т.д., т.е. процесс развивается по типу цепных реакций. При температуре реакции, достаточно высокой для расплавления образовавшегося окисла металла-восстановителя, капли восстанавливаемого металла опускаются вниз или поднимаются вверх (в случае очень лёгких металлов и сплавов типа бора) и объединяются в жидком слое, который после затвердевания образует королек металла или сплава и слой шлака.
В случае высокой температуры плавления окисла восстановителя или высокой вязкости образовавшегося шлака, капли восстановленного металла содержатся в быстро твердеющем шлаке в виде мелкодисперсных включений и отдельных корольков металла. Были сделаны попытки связать механизм восстановления с диффузией металла-восстановителя в восстанавливаемом окисле со всеми вытекающими отсюда последствиями. Но маловероятно, что такое представление является правильным.
Батраковым было исследовано влияние различных кинетических факторов на протекание металлотермического процесса. Было установлено: металлотермический процесс может протекать только тогда, когда концентрация активных комплексов будет больше некоторой определенной величины. Под активным комплексом понимается смесь реагентов в данной точке в стехиометрическом отношении.
Концентрация активных комплексов в шихте определяет интенсивность и эффективность металлотермического процесса. В свою очередь она зависит от следующих основных факторов: количества восстанавливаемого окисла, металла – восстановителя и других компонентов в шихте, степени дисперсности частиц, качества смешения и т.д.
Увеличение дисперсности частиц и улучшение перемешивания приводит к возрастанию концентрации активных комплексов. Однако максимально допускаемая степень дисперсности восстановителя определяется склонностью его к окислению.
Особенно это проявляется при использовании в качестве восстановителя алюминия, который покрыт окисной пленкой, тормозящей процесс восстановления. Толщина окисной пленки на алюминиевой крупке, применяемой для алюмотермического восстановления, колеблется в зависимости от методов ее получения от 100 до 2000 Å.
На алюминии, чистотой 99,6% при комнатной температуре толщина окисной пленки составляет 50 – 100 Å, при повышении же температуры до 550 - 600°С она достигает 2000Å. С этим связано образование так называемых «холодных шихт», совершенно не способных реагировать даже при длительном нагреве при недостаточно высоких температурах. Ликвидация этих пленок необходима для нормального протекания реакции и требует затраты известного количества тепла и введение дополнительных реагентов в шихту (например криолита Na3AlF6).
Содержание окиси алюминия (g - Al2O3) уменьшается при применении более крупных порошков алюминия, по при этом снижается концентрация активных комплексов, что в свою очередь приводит к замедлению реакции.
На скорость реакции и степень извлечения металла из восстанавливаемого окисла существенное влияние оказывает размер частиц этого окисла. Это влияние обусловлено главным образом увеличением времени, необходимого для смешения шихты при уменьшении размеров частиц окисла, а также уносом из тигля слишком тонких частиц при металлотермической плавке.
При металлотермическом восстановлении различают два понятия: начальная температура восстановления и температура, при которой необходимо вести процесс, чтобы расплавить окисел металла восстановителя и полностью перевести его в слой шлака. Величина начальной температуры восстановления повышается с увеличением прочности восстанавливаемого окисла; например начальная температура восстановления алюминием Na2O2 составляет 410°С; BaO2 - 560°С; Fe2O3 - 1025°С; MgO, V2O5 и окислов ряда других металлов между 950 - 1050°С.
В таблице 12 приводятся температуры реакций алюмотермического восстановления некоторых окислов.
Таблица 12 – Температуры реакций алюмотермического восстановления некоторых окислов
| Окисел | MnO2 | MoO3 | Co3O4 | Fe2O3 | Fe3O4 | MoO2 | V2O5 | CoO | NiO | WO3 |
| Температура, °С | ||||||||||
| Окисел | Cr2O3 | SiO2 | Nb2O5 | WO2 | TiO2 | V2O3 | B2O3 | Ta2O5 | ZrO2 | - |
| Температура, °С | - |
Температура плавления Al2O3 равна 2050°С. Поэтому, достаточно полное отслаивание окиси алюминия возможно без дополнительного подогрева шихты и введение флюсующих добавок только при восстановлении первых десяти окислов, т.е. когда
tреакц > tплав Al2O3
Выше было указано, что максимальное значение термичности процесса имеет место при стехиометрическом соотношении между восстанавливаемым окислом и металлом – восстановителем.
С уменьшением количества металла – восстановителя смеси термичность процесса снижается и необходим подогрев реактора, либо внешний, либо за счет подогревающих добавок. Подогревающие добавки представляют собой смесь активного окислителя с металла (обычно основным металлом восстановителем шихты).
Характеристика некоторых окислителей дается в таблице 13.
Таблица 13 – Свойства некоторых окислителей для подогревающих добавок металлотермических процессов
| Окислитель | Удельный вес | Температура плавления, °C | Теплота образования окислителя, ккал/моль | Реакция распада окислителя с образованием О2 |
| KClO3 | 2,3 | 2KClO3=2KCl+3O2 | ||
| KClO4 | 2,5 | 2KClO4=2KCl+4O2 | ||
| NaNO3 | 2,2 | 2NaNO3=NaO2+N2+2,5O2 | ||
| KNO3 | 2,1 | 2KNO3=K2O+N2+ 2,5O2 | ||
| BaO2 | 5,0 | - | ||
| CaSO4 | 3,0 | CaSO4=CaS+2O2 | ||
| BaSO4 | 4,5 | BaSO4=BaS+2O2 |
2.3. Роль побочных реакций образования шлаков
Выше было дано следующее уравнение реакции металлотермического восстановления:
MeO + Me’ = Me’O + Me
из которого видно, что побочным продуктом этого процесса является окисел Ме′О. В действительности побочным продуктом является не окисел металла – восстановителя, а более сложное соединение (шлак). Если реакция протекает без посторонних добавок, то состав образующегося шлака можно отобразить в формуле nMeO mMe′O. Поскольку восстановителями обычно являются алюминий или кремний, получаемые шлаки представляют собой соответственно алюминаты или силикаты восстанавливаемых металлов. В частности, реакция восстановления окиси кальция алюминием протекает с образованием алюмината кальция по схеме:
а) 3CaO + 2Al = 3Ca + Al2O3
б) 3CaO + Al2O3 = 3CaO·Al2O3
а) + б) 6CaO+2Al=3Ca+3CaO·Al2O3
На заводах обычно стремятся получить достаточно плавкие шлаки, в пределах же вакуумной металлотермии, осуществляемых при умеренных температурах, шлаки получаются обычно твёрдыми.
Образование шлаков облегчает термодинамически процесс металлотермического восстановления.
2.4. Металлотермическое восстановление двуокиси урана
Раньше было показано, что косвенное восстановление двуокиси урана до урана термодинамически не возможно. При углетермическом же восстановлении этого окисла получается не металл, а карбиды урана. Поэтому представляет интерес рассмотреть реакции металлотермического восстановление двуокиси урана. В качестве возможных восстановителей выберем следующие металлы: цирконий, кальций, магний, алюминий. Проведем графический анализ реакций металлотермического восстановления. Для построения зависимостей стандартных изменений изобарного потенциала для реакций образования окислов из элементов от температуры воспользуемся следующими данными:
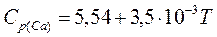




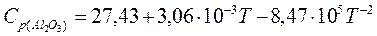
 ккал/моль;
ккал/моль;  ккал/моль;
ккал/моль;
 ккал/моль;
ккал/моль; 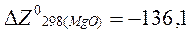 ккал/моль;
ккал/моль;
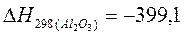 ккал/моль;
ккал/моль;  ккал/моль.
ккал/моль.
На основании этих данных находим следующие зависимости:
1. 2Са(тв)+ О2 = 2СаО(тв)

Это уравнение справедливо только для случая, когда кальций и окись кальция находятся в твердом состоянии, т.е. не учитывается возможность изменения агрегатных состояний участников реакций (в частности кальция).
2. 2Mg(тв) + О2 = 2MgO(тв)

3. 4/3Al + O2 = 2/3Al2O3

4. Zr(тв)+ O2 = ZrO2(тв).
В литературе приводится следующая зависимость упругости диссоциации двуокиси циркония от температуры:

Для реакции (4)  , а так как ∆Z0= - 4,574T lgK, то подставляя вместо К упругость диссоциации, имеем ∆Z0= - 4,574T lgРО2.
, а так как ∆Z0= - 4,574T lgK, то подставляя вместо К упругость диссоциации, имеем ∆Z0= - 4,574T lgРО2.
Поэтому

5. U + O2 = UO2
При рассмотрении процессов диссоциации окислов урана приводилась зависимость упругости диссоциации этого окисла от температуры. Используя эту зависимость, получаем:

На рис. 41 в координатах ∆Z0 – Т построены кривые для указанных выше окислов. При построении кривых для CaO и MgO учитывалось изменение агрегатного состояния металлов. На основании данных, приведенных на рис. 13, можно сделать следующие выводы:
1. цирконий не может являться восстановителем урана из его двуокиси,
2. термодинамически маловероятно восстановление двуокиси урана алюминием.

Рис. 13
В качестве металлов восстановителей для осуществления металлотермического восстановления двуокиси урана могут быть использованы кальций и магний.
В одной из работ описано восстановление двуокиси урана кальцием. Найдено, что при осуществлении процесса в интервале температур 900 - 1200°С и при отношении  процесс заканчивается в течение 40 мин. Если восстановление производилось в железном тигле, то содержание урана в готовом продукте составляло 97,5 %, а содержание железа 2,4 %, т.е. получался уран, загрязненный железом. При восстановлении в тигле, футированном окисью кальция, содержание урана в готовом продукте составляло 99,9 %, но при этом резко уменьшался выход урана. Начальная температура восстановления двуокиси урана кальцием ~ 800 °С.
процесс заканчивается в течение 40 мин. Если восстановление производилось в железном тигле, то содержание урана в готовом продукте составляло 97,5 %, а содержание железа 2,4 %, т.е. получался уран, загрязненный железом. При восстановлении в тигле, футированном окисью кальция, содержание урана в готовом продукте составляло 99,9 %, но при этом резко уменьшался выход урана. Начальная температура восстановления двуокиси урана кальцием ~ 800 °С.
Дата добавления: 2015-10-28; просмотров: 298 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Восстановление двуокиси урана (UO2). | | | Двухатомные газы |